1. 天津中医药大学, 天津 301617;
2. 天津中医药大学第一附属医院, 天津 300193
收稿日期:2019-03-15
基金项目:国家自然科学基金项目(81603329)
作者简介:牛子长(1978-), 男, 博士, 主治医师, 主要从事中药心血管疾病的临床和基础研究.
丹红注射液是由丹参和红花制成的常用中药复方制剂,临床上广泛用于心脑血管系统疾病的治疗[1]。中医理论认为丹参具有活血祛瘀,通经止痛,清心除烦,凉血消痈之功效;红花具有活血化瘀,散湿去肿的功效。现代药理学实验表明丹红注射液具有抑制心肌细胞肥大、抗炎、抗凝抑栓、抑制急性脑梗死神经细胞凋亡等作用[2-7]。
心肌缺血再灌注损伤中常见氧化应激反应,氧化应激引起的线粒体损伤是介导心肌细胞凋亡的主要原因之一。氧化应激导致活性氧簇(ROS)含量增加,从而导致线粒体受损,线粒体膜电位下降,去极化产生,从而启动心肌细胞凋亡程序[8]。有研究发现丹红注射液具有上调凋亡抑制基因bcl-2的作用,提示丹红注射液具有抗心肌细胞凋亡的作用[9]。线粒体途径作为细胞凋亡的主要通路之一,其是否参与调控丹红注射液抗心肌细胞凋亡过程还不得而知。为了进一步清楚和完善丹红注射液抗心肌细胞凋亡的具体机制,研究采用流式细胞术检测了丹红注射液抗异丙肾上腺素(ISO)诱导的心肌细胞凋亡作用,从线粒体损伤角度研究了丹红注射液的抗心肌细胞凋亡作用。
1 材料
1.1 实验材料
H9c2心肌细胞来自美国ATCC细胞率。
1.2 实验受试药物和试剂
丹红注射液(批号:13062020,菏泽步长制药有限公司);DMEM,(Hyclone);胎牛血清(FBS,Biological Industries);抗生素(青霉素,链霉素,Hyclone);二甲基亚砜(DMSO,Sigma公司);PBS(Neuronbc);0.25%胰蛋白酶(Biological Industries);异丙肾上腺素(ISO,Sigma公司);CellROX® Oxidative Stress Reagents、JC-1 Mitochodrial Potential Sensors Kit(Invitrogen);Annexin V-FITC/PI凋亡试剂盒(BD);fluo-3 AM(碧云天)。
1.3 主要仪器
流式细胞仪FACS Aria3(BD)、活细胞荧光成像仪IncuCyte Zoom(Essen BioSience公司)、激光共聚焦显微镜,德国Zeiss公司以及多功能读板机Flexstation(MD)。
2 实验方法
2.1 细胞培养
H9c2细胞复苏后转移到含有5 mL完全培养液(90%DMEM+10%FBS+1%双抗)的25 cm2培养瓶中,在37 ℃、5%CO2、饱和湿度的培养箱中培养,24 h后更换新的完全培养基继续培养。当细胞融合90%左右时,传代。24 h后更换含1%胎牛血清的全培基,使其细胞生长同步化24 h。加入不同浓度的实验药物处理24 h。实验分组为:对照组、模型组10 μmol/L ISO、10 μmol/L ISO+丹红注射液(20、200 μL/L)剂量组。
2.2 丹红注射液对ISO诱导的H9c2细胞凋亡的影响
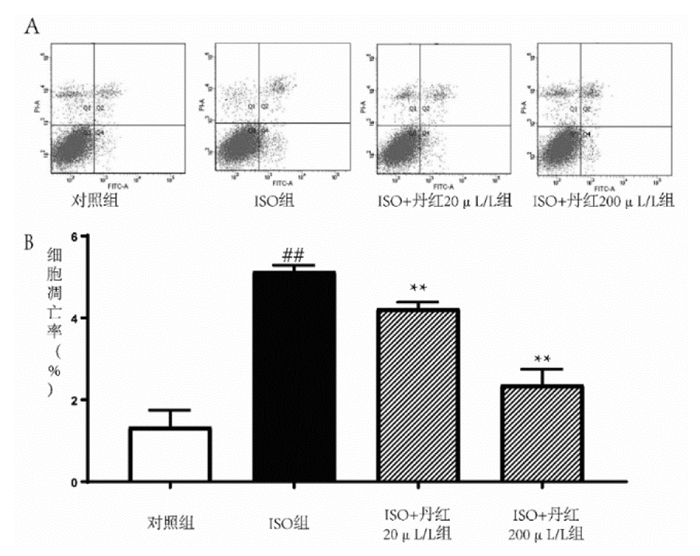
PBS洗涤细胞3次后,每孔细胞分别加入200 μL试剂盒自带缓冲液,分别加入Annexin V和PI,避光孵育细胞30 min。加入500 mL缓冲液后经180目尼龙网过滤后立即上机检测。凋亡细胞百分比取第4象限细胞数值。
2.3 丹红注射液对ISO诱导H9c2细胞线粒体膜电位去极化的影响
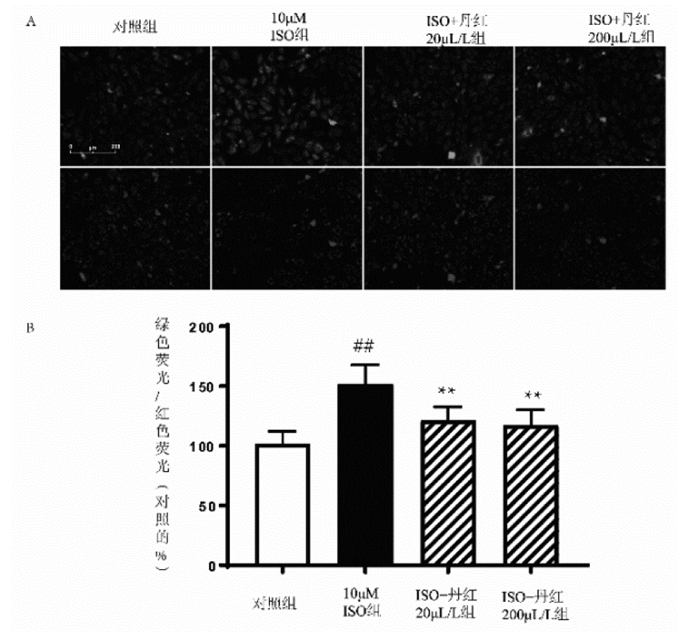
细胞以3×104个/mL的密度接种到96孔培养板中,每孔接种100 μL细胞悬液,24 h后更换含1%FBS的培基,使其细胞生长同步化。24 h后弃去上清,加入JC-1(终浓度为10 μmol/L)50 μL/孔。37 ℃孵育20 min。DMEM冲洗细胞3次,最后1次加入100 μL DMEM,Incucyte Zoom中拍照,使之作为基准值。弃去DMEM,加入药物。实验分组为:对照组、模型组ISO10 μmol/L、ISO10 μmol/L+丹红注射液(20、200 μL/L)剂量组。Incucyte Zoom中拍照,观察红绿荧光的变化。
2.4 丹红注射液对ISO诱导的H9c2细胞内活性氧的影响
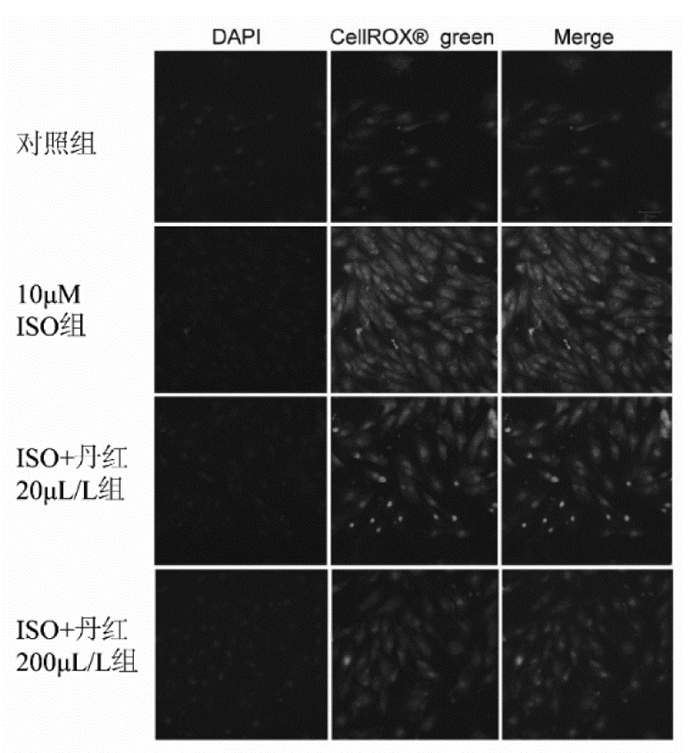
细胞内活性氧通过CellROX® Oxidative Stress Reagents试剂盒检测。PBS冲洗细胞2次,3.7%甲醛溶液固定细胞10 min,0.1%曲拉通细胞打孔5 min,加入终浓度为5 μmol/L的活性氧检测试剂,37 ℃孵育30 min。然后加入DAPI(稀释比例=1:100)孵育15 min。共聚焦拍照分析荧光强度。
2.5 细胞内钙离子浓度检测
使用Fluo-3,AM ester试剂检测细胞内钙离子浓度。细胞给药24 h后PBS冲洗3次,使用含5 μmol/L Fluo-3 AM ester试剂的细胞培养液37 ℃孵育30 min。PBS冲洗细胞3次后使用多功能读板机,激发光波长488 nm,发射光波长526 nm读取荧光光度值。
2.6 统计学处理
采用SPSS 19.0统计软件分析,实验数据均以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法。P < 0.05表示差异具有显著性。
3 结果
3.1 丹红注射液对ISO诱导的H9c2细胞凋亡的影响
流式细胞检测结果显示与对照组细胞凋亡率(1.33%±0.42%)相比,用ISO处理细胞24 h后,细胞凋亡率(5.13%±0.15%)显著上升,差异具有统计学意义,显示ISO诱导细胞凋亡成功。加入20、200 μL/L丹红注射液后,细胞凋亡率分别下降为4.23%±0.15%和2.37%±0.38%,提示丹红注射液具有抑制ISO诱导的H9c2细胞凋亡的作用,见图 1。
3.2 丹红注射液对ISO诱导H9c2细胞线粒体膜电位去极化的影响
JC-1是一种检测线粒体膜电位的荧光探针。当线粒体膜电位去极化,JC-1荧光由红变绿。线粒体膜电位发生去极化时显示绿色荧光强度增加。因此本实验选择JC-1作为检测丹红注射液对ISO诱导线粒体膜电位改变的指标。数据表明,给予ISO后,H9c2细胞的绿色荧光/红色荧光比值显著升高。然而,丹红注射液显著降低绿色荧光与红色荧光强度比,见图 2。结果提示丹红注射液可抑制ISO诱导的线粒体膜电位去极化。
3.3 丹红注射液对H9c2细胞内活性氧含量的影响
Cell ROX®氧化应激试剂是一种检测活性氧的荧光探针试剂。图 3显示了典型的活性氧染色激光共聚焦显微镜图片。ISO作用24 h后,心肌细胞中活性氧水平显著增加。和ISO组相比,共同给药丹红注射液后可显著降低活性氧含量,见图 3。
3.4 丹红注射液对ISO诱导的H9c2细胞内钙离子浓度升高的影响
10 μmol/L ISO显著升高细胞内钙离子浓度(与对照组相比,P < 0.01)。200 μL/L丹红注射液显著抑制ISO诱导的细胞内钙离子浓度升高(与ISO组相比,P < 0.01)。
4 讨论
丹红注射液是一种临床应用广泛的中药制剂,其较好的心脑血管系统保护疗效得到了许多学者的肯定并已应用于缺血性脑卒中、冠心病心绞痛、心肌缺血等的临床治疗[10-12]。经过查阅文献发现,对丹红注射液丹的研究更多的是集中在其临床疗效观察。丹红注射液对心脑血管系统保护作用的具体机制研究主要集中在抗炎作用、抗氧化作用、降血脂以及神经保护和心肌保护等几个方面[13-17]。在抗细胞凋亡方面,虽然丹红注射液抗脑神经元凋亡和抗心肌细胞凋亡作用均有见报道,但是以抗脑神经凋亡机制研究较多。丹红注射液抗心肌细胞凋亡的作用机制相关研究相对较少,认为其抗心肌细胞凋亡与其抑制凋亡相关蛋白bax、caspase3的表达,上调抗凋亡蛋白bcl-2的表达有关[18-19],其抗心肌细胞凋亡作用与线粒体损伤的相关性仍不明确。因此,本研究采用ISO为诱导因素,从线粒体损伤及细胞内钙离子超载角度进一步研究了其抗心肌细胞凋亡的作用机制。
交感神经系统,尤其是β肾上腺素受体[20-22],在心血管系统疾病的发生与发展过程中扮演了极其重要的角色。心血管系统疾病过程中常伴随发生心室重构,心脏为维持有效循环量、保持血压稳定,在心输出量减少时激活交感神经系统(SNS)分泌肾上腺素和去甲肾上腺素,从而激活β肾上腺素受体直接或间接诱导心肌细胞肥大或凋亡,反过来加重心室重构的发生。因此,抗β肾上腺素受体激活药物的发现对心血管系统疾病的有效防治具有重要意义。有报道称β-AR在心脏中表达三种亚型:β1-,β2-AR和近期发现的β3-AR。其中β1-,β2-AR研究最为广泛。它们和激动性G蛋白Gs或抑制性G蛋白Gi结合,在心肌功能变化的进程中发挥着不同的作用[23]。有研究表明β1-AR和Gs结合,激活AC-cAMP- PKA-Ca2+信号通路。相比之下,β2-AR和Gs,Gi都能结合。β2-AR和Gs结合,作用类似于β1-AR,激活AC-cAMP- PKA-Ca2+信号通路。然而,β2-AR和Gi结合,通过PI3K-AKt信号通路发出心肌细胞生存信号[24-26]。异丙肾上腺素ISO,作为一种β受体激动剂,广泛用于心肌肥大、凋亡的诱导剂[27]。ISO可通过直接或间接激动肾上腺素受体产生与交感神经兴奋相似的效应。ISO对β受体具有较强的激活作用,表现为正性肌力和正性频率作用,可使心肌收缩力增强,心率加快,导致心肌细胞肥大以及心肌细胞凋亡。本研究采用流式细胞术发现经10 μmol/L ISO作用后,细胞凋亡率显著上升,说明模型制备成功。丹红注射液显著降低ISO诱导的H9c2细胞凋亡率,提示丹红注射液具有抗心肌细胞凋亡的作用。
细胞凋亡,也叫细胞程序性死亡,是指细胞在正常生理条件下为了维持自我稳态,在特定基因严格控制下发生的一种主动死亡现象。心肌细胞凋亡发生于多种心血管系统疾病中,研究发现心肌细胞凋亡参与了心力衰竭、心肌梗死和心律不齐等多种心脏相关疾病的发生和发展过程[28-30]。细胞凋亡的主要机制有经典线粒体损伤(内源性途径)和死亡受体活化(外源性途径)介导的传导通路细胞凋亡以及近来发现的内质网应激启动的细胞凋亡[31]。其中,线粒体损伤是最主要的细胞凋亡诱因[8]。细胞在受到应激或胞外凋亡诱导信号刺激时,线粒体损伤凋亡途径被激活,导致促凋亡蛋白Bax/抗凋亡蛋白Bcl-2比值升高,引起细胞线粒体膜去极化,激活caspase-3从而引起细胞凋亡的发生。采用线粒体膜电位试剂JC-1,发现10 μmol/L ISO显著引起H9c2细胞线粒体膜电位去极化,而丹红注射液能显著抑制ISO诱导的细胞线粒体膜电位下降(P < 0.05),提示丹红注射液的抗H9c2细胞凋亡与其抑制细胞线粒体损伤有关。
此外,有研究报道细胞内源性凋亡途径可能由细胞氧化应激、钙超载等因素诱发从而导致细胞内线粒体膜电位下降,线粒体损伤导致细胞凋亡的产生。氧化应激是导致包括动脉粥样硬化、急性心肌梗死和心力衰竭等多种心血管疾病发生的重要途径之一。氧化应激不仅可以通过增加脂质过氧化水平、降低抗氧化防御机制导致心肌细胞膜通透性增加,导致心肌细胞膜通透性增加,还可以通过直接损伤线粒体促使凋亡诱导因子释放到细胞质,从而引发细胞凋亡[32]。线粒体在有氧代谢过程中产生的副产物活性氧簇过量会引起线粒体损伤,从而导致细胞凋亡。Ca2+是一种细胞内重要的第二信使,钙离子浓度升高也是引起线粒体膜去极化的因素之一[33]。因此,研究进一步研究了丹红注射液对ISO引起的细胞内活性氧及钙超载的影响。研究发现丹红注射液能显著抑制细胞内ROS的产生,同时抑制细胞内钙离子浓度的升高。
综上所述,研究发现丹红注射液对ISO引起的H9c2细胞凋亡具有显著抑制作用,这与其抑制线粒体膜电位下降、抑制细胞内ROS产生及降低细胞内钙离子浓度升高有关。
Mechanisms research of anti-apoptosis by Danhong Injection in H9c2 myocardial cells
1. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2019, Vol. 36
2019, Vol. 36