清肺消炎丸对幼龄小鼠急性毒性实验研究
吴佳蓉
,
岳晓月
,
王艳秋
,
付苏凝
,
崔元璐
,
樊官伟
天津中医药  2019, Vol. 36 2019, Vol. 36 Issue (8): 801-807 Issue (8): 801-807 |

清肺消炎丸源于汉代医圣张仲景所著的《伤寒论》中的“麻杏石甘汤”加减,由麻黄、石膏、地龙、牛蒡子、葶苈子、牛黄、苦杏仁和羚羊角等组成,主治清肺化痰,止咳平喘。临床上主要用于痰热阻肺,咳嗽气喘,吐痰黄稠;上呼吸道感染,急性支气管炎,慢性支气管炎急性发作及肺部感染见上述症状者。现代药理学研究显示,清肺消炎丸具有抗炎、止咳、平喘、免疫调节、抗病毒等多种药理作用[1-4]。清肺消炎丸在儿科临床上应用广泛[5-6],为进一步了解其儿科临床用药的安全性,本研究参照经典的急性毒性实验方法[7],根据《中药、天然药物急性毒性研究技术指导原则》[8],进行LD50预试和最大给药量实验[9-11],观察幼龄小鼠对清肺消炎丸的急性毒性反应,评价其用药安全性,为清肺消炎丸在儿科临床的安全应用奠定基础。
1 材料 1.1 实验动物实验动物为健康SPF级昆明小鼠,雌雄各半,体质量16~18 g,3周龄,购于北京维通利华动物实验中心(动物合格证编号:SCXK(京)2016-0011),并饲养于天津中医药大学实验动物中心。饲养期间,保持自由饮水和进食,环境温度为(24±1)℃,湿度为55%±5%,每只动物仅使用1次。动物实验遵循美国国立卫生研究院(NIH)指导原则和天津中医药大学的伦理委员会指导原则。
1.2 实验药品清肺消炎丸(批号:T013),由天津中新药业集团股份有限公司达仁堂制药厂提供。
1.3 实验仪器万分之一精密分析天平,AL204,Mettler-Toledo仪器(上海)有限公司。涡旋振荡器,QL-901,海门市其林贝尔仪器制造有限公司。全自动封闭脱水机,ASP300S,德国Leica仪器公司。生物组织包埋机,BMJ-1,天津航空机电公司。石蜡切片机,RM2135,德国Leica仪器公司。全自动生化分析仪,日本Hitachi公司。
2 方法参照经典的急性毒性[5](半数致死量LD50、最大给药量)实验方法,进行清肺消炎丸的幼龄小鼠急性毒性实验研究。
2.1 药液的配制取清肺消炎丸适量,用研钵研磨后,称取一定量的清肺消炎丸,用生理盐水配制成浓稠混悬液,并稀释成以灌胃针测试吸取较为顺畅的最大药物浓度为600 mg/mL。
2.2 小鼠LD50预试选取健康的SPF级幼龄昆明小鼠40只,随机分为5组,每组8只,雌雄各半,分笼饲养。经预试清肺消炎丸以灌胃针吸取较为顺畅的最大药物浓度为600 mg/mL,给药剂量按等比级数1:0.75设计,组别分别为空白对照组、10.125 g/kg、13.5 g/kg、18 g/kg和24 g/kg清肺消炎丸给药组,适应性喂养2 d后进行实验。灌胃前1 d及灌胃当天称质量,灌胃前12 h禁食,自由饮水,各给药组小鼠以能够接受的最大体积给药(0.8 mL/20 g),分别灌胃给予10.125 g/kg、13.5 g/kg、18 g/kg和24 g/kg清肺消炎丸,空白对照组灌胃给予相同体积的生理盐水,灌胃给药2次,间隔8 h。最后1次给药后2 h恢复进食并常规喂养7 d,于第7天处死小鼠,观察脑、心、肝、脾、肺、肾等重要脏器有无异常。
2.3 小鼠最大给药量实验选择LD50预试中的最大给药浓度及最大给药体积进行幼龄小鼠最大给药量实验。选取健康的SPF级幼龄昆明小鼠64只,随机分为2个亚组,分别为清肺消炎丸给药后7 d(24只)和14天(40只)观察组。7 d亚组分为两组,每组12只,雌雄各半,分笼饲养:1)空白对照组;2)清肺消炎丸给药组。14 d亚组分为两组,每组20只,雌雄各半,分笼饲养:1)空白对照组;2)清肺消炎丸给药组。各组小鼠适应性喂养2 d后进行实验,灌胃前1 d及灌胃当天称质量,灌胃前12 h禁食,自由饮水,以最大给药浓度(600 mg/mL),能够接受的最大给药体积(0.8 mL/20 g)给药,各清肺消炎丸给药组给予清肺消炎丸(24 g/kg),空白对照组给予相同体积的生理盐水,灌胃给药3次,间隔6 h。最后1次给药后2 h恢复进食并进行连续观察。
2.4 小鼠急性毒性实验观察方法各组小鼠每次灌胃给药后,即刻观察动物的毒性反应情况。每次给药0.5、1、2、4 h后观察各组小鼠的行为活动有无异常,逐日观察并记录各小鼠的外观、行为活动、饮水纳食、精神状态、二便毛色、呼吸及鼻眼口腔等有无异常分泌物。并于灌胃前1 d、灌胃当天、灌胃后第1、3、5、7、9、11、13天称取小鼠体质量,记录饲料消耗量和饮水量,灌胃后第7天或14天处死小鼠。处死并解剖小鼠后,肉眼观察脑、心、肝、脾、肺、肾等重要脏器有无异常(实验过程中因濒死而处死的小鼠应及时进行大体解剖并肉眼观察各个重要脏器有无异常。各项观察指标判定详见中药、天然药物急性毒性研究技术指导原则[8])。
各亚组小鼠分别在给药7 d或14 d后,用异氟烷麻醉,眼球取血,室温凝血离心,分离血清,并保存于-20 ℃冰箱,备用。取小鼠脑、心、肝、脾、肺、肾等组织样本,用生理盐水冲洗并用滤纸擦干称质量,计算脏器系数[脏器系数=脏器质量(mg)/小鼠体质量(g)]。
2.5 病理学分析为进行组织病理学分析,取小鼠肝、脾、肺、肾组织用10 %多聚甲醛固定,进行脱水、浸蜡、包埋、切片和HE染色。
2.6 小鼠肝肾功能的检测将保存在-20 ℃冰箱的血清取出,用全自动生化分析仪检测幼龄小鼠血清中天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)、血尿素氮(BUN)和血肌酐(SCr)的浓度。
2.7 统计学分析实验数据以平均值±标准误(x±s)表示,采用OriginPro 8.0软件进行数据统计分析并做图。组间比较使用单因素方差分析(One-Way ANOVA)法,P < 0.05表示差异具有统计学意义。
3 实验结果 3.1 LD50预试结果 3.1.1 清肺消炎丸对小鼠健康状态的影响每次灌胃给药后,与空白对照组小鼠比较,清肺消炎丸给药组小鼠活动行为均无异常。灌胃2 h后各组小鼠恢复进食,均开始正常饮食,并无显著差异。实验观察期间,受试小鼠均未出现死亡,也未表现出明显的中毒症状,并且观察期间小鼠毛发光泽、活动自如、进食及大小便正常,精神状态良好。
3.1.2 清肺消炎丸对幼龄小鼠体质量的影响对所有组小鼠的体质量进行统计,结果如表 1所示,灌胃前各组小鼠的体质量差异无显著性,不同剂量的清肺消炎丸给药7 d后,各给药组小鼠的体质量增长与空白对照组基本一致,均呈现上升的趋势。结果表明,与空白对照组比较,清肺消炎丸的各给药组在给药后7 d内,差异均无显著性。说明不同剂量的清肺消炎丸对幼龄小鼠的生长发育没有影响。
对各组小鼠的饲料消耗量进行统计,结果如表 2所示,与空白对照组进行比较,不同剂量的清肺消炎丸给药7 d后幼龄小鼠各时间段的饲料消耗量差异均无显著性。对小鼠的饮水量进行统计,结果如表 3所示,与空白对照组比较,除了10.125 g/kg清肺消炎丸组雄性小鼠给药1 d后饮水量差异有显著性(P < 0.05),其他各组的各时间段的饮水量差异均无显著性;各清肺消炎丸雌性小鼠给药7 d后,与空白对照组比较差异均无显著性,说明不同浓度的清肺消炎丸不会影响幼龄小鼠的饮食饮水。
每次灌胃给药后,与空白对照组小鼠比较,清肺消炎丸给药组小鼠活动行为均无异常。灌胃2 h后各组小鼠恢复进食,均开始正常饮食,并无显著差异。实验观察14 d期间,受试小鼠均未出现死亡,也未表现出明显的中毒症状,并且观察期间小鼠毛发光泽、活动自如、进食及大小便正常,精神状态良好。
3.2.2 清肺消炎丸对幼龄小鼠体质量的影响由于实验小鼠为幼龄小鼠,正处于生长发育阶段,因此小鼠的体质量是评价清肺消炎丸毒性的一个指标。对各组小鼠的体质量进行统计,实验结果如表 4所示,清肺消炎丸给药后14 d内,给药组小鼠的体质量增长与空白对照组基本一致,均呈现上升的趋势。结果表明,与空白对照组比较,清肺消炎丸组雄性小鼠除了灌胃后第1天和第3天差异有显著性(P < 0.05),其他时段差异均无显著性;清肺消炎丸组雌性小鼠在给药后14 d内,与空白对照组比较差异均无显著性,说明在小鼠的急性毒性最大给药量实验中,清肺消炎丸不会影响幼龄小鼠的生长发育。
正常小鼠各脏器与体质量的比值比较恒定,小鼠中毒后,受损脏器质量会发生改变,脏器系数也会随之发生变化,脏器系数增大,表示脏器可能发生了充血、水肿或增生肥大等;脏器系数减小,表示脏器可能发生了萎缩及其他退行性改变,因此脏器系数是毒理实验中常用的指标[12-14]。表 5、表 6为清肺消炎丸给药7 d和14 d后对幼龄小鼠脏器系数的影响。结果表明,清肺消炎丸给药7 d或14 d后,与空白对照组比较,各给药组小鼠的脏器系数(肝、肾、脑、心、肺、脾)差异均无显著性。
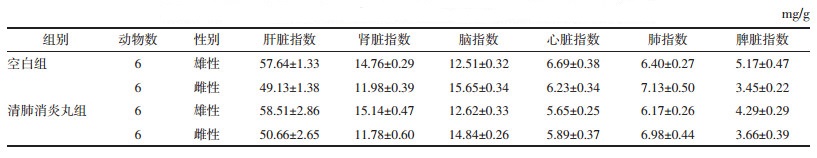
|
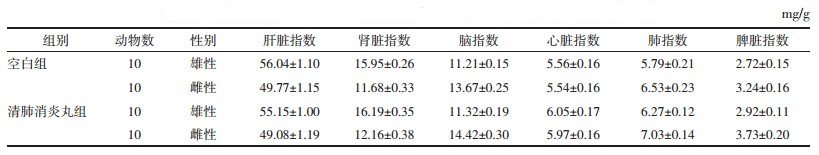
|
AST、ALT、ALP和A/G是临床上常用的评价肝功能的指标[15],ALT和AST主要分布在肝细胞内,如果肝脏受损,肝细胞中的转氨酶便进入血液,使血液中的ALT和AST水平升高,因此AST和ALT是评判肝损伤的重要指标[16-17]。因此本实验通过定期检测小鼠血清中AST、ALT、ALP、TP和ALB等指标评价清肺消炎丸对幼龄小鼠肝功能的影响。如图 1所示,清肺消炎丸给药7 d或14 d后,雄性小鼠血清中的AST、ALT、ALP浓度以及A/G没有发生显著变化,说明在小鼠急性毒性最大给药量实验中清肺消炎丸对雄性小鼠的肝功能无显著影响。如图 2所示,清肺消炎丸给药7 d和14 d后,雌性小鼠血清中的AST、ALT浓度以及A/G没有发生显著变化,说明极高剂量的清肺消炎丸没有造成急性肝损伤;清肺消炎丸给药7 d后,与空白对照组比较,雌性小鼠的ALP浓度显著升高,但是给药14 d后,ALP浓度又恢复正常,与空白对照组比较差异无显著性,说明给药后小鼠可能出现一过性肝功能异常,之后药物经过肝脏代谢,肝功能恢复正常。

|
| 图 1 对雄性小鼠血清AST(A)、ALT(B)、ALP(C)和A/G(D)含量的影响 Fig. 1 Effect of serum AST(A), ALT(B), ALP(C) and A/ G(D) in male mice |
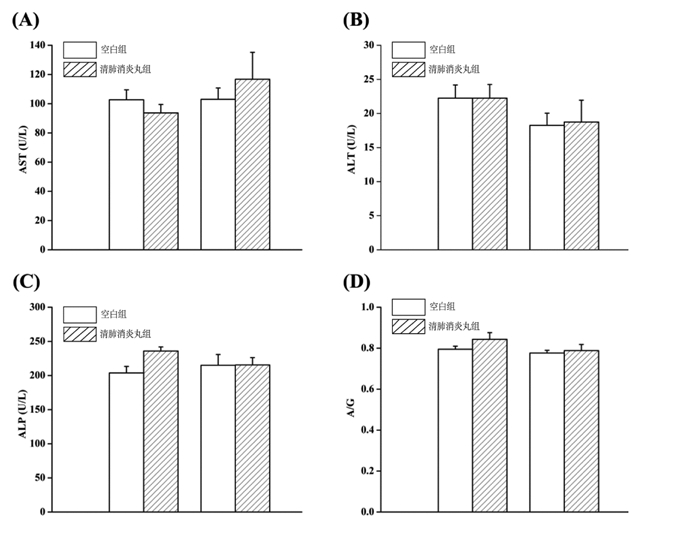
|
| 与空白组7 d比较,*P < 0.05 图 2 对雌性小鼠血清AST(A)、ALT(B)、ALP(C)和A/G(D)含量的影响 Fig. 2 Effect of serum AST(A), ALT(B), ALP(C) and A/ G(D) in female mice |
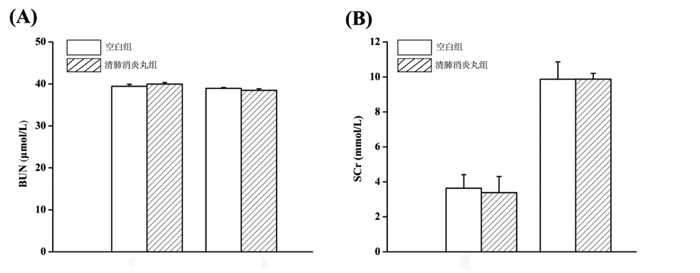
BUN和SCr是临床上常用的评价肾功能的指标[18-19]。因此本实验通过定期检测小鼠血清中BUN和SCr等指标评价清肺消炎丸对小鼠肾功能的影响。如图 3、图 4所示,清肺消炎丸给药7 d或14 d后,与空白对照组比较,幼龄小鼠血清中的BUN和SCr浓度均没有发生显著变化,说明在小鼠急性毒性最大给药量实验中清肺消炎丸对幼龄小鼠的肾功能无显著影响。
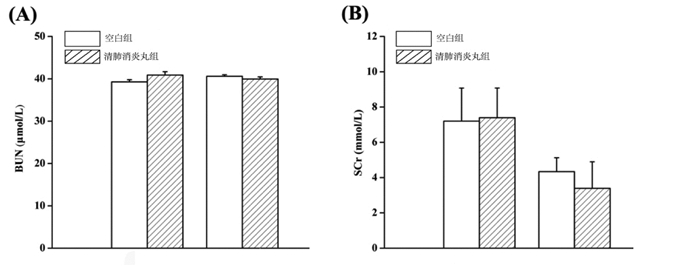
|
| 图 3 对雄性小鼠血清BUN(A)和SCr(B)含量的影响 Fig. 3 Effect of serum BUN(A)和SCr(B) in male mice |
|
| 图 4 对雌性小鼠血清BUN(A)和SCr(B)含量的影响 Fig. 4 Effect of serum BUN(A)和SCr(B) in female mice |
清肺消炎丸给药7 d和14 d后,分别处死各组小鼠并解剖,肉眼观察小鼠的各主要脏器有无异常。结果表明,与空白对照组比较,7 d和14 d各给药组小鼠的肝、肾、脑、心、肺、脾等重要脏器均无异常。
幼龄小鼠肝、肾、肺和脾组织的HE染色显微照片如图 5所示。空白对照组和清肺消炎丸组无显著差异,各组肝组织细胞均排列紧密,细胞形态良好,肝小叶结构完整;肾组织结构清晰,肾小球正常;肺组织肺泡结构清晰,间隔正常,管壁结构良好;脾组织淋巴细胞排列紧密,无淤血和点状坏死;各组各个脏器无明显炎性细胞浸出、纤维化和坏死等病理变化。说明在小鼠急性毒性最大给药量实验中清肺消炎丸对幼龄小鼠的各脏器无显著影响。

|
| 图 5 幼龄小鼠肝、肾、肺和脾组织切片HE染色照片(×100,左下角为×400) Fig. 5 HE staining of liver, kidney, lung and spleen in young mice(×100, lower left corner ×400) |
清肺消炎丸是在中医药理论指导下,按照“君臣佐使”的组方原则,选择适宜的药味与剂量配伍而成的一种中成药,是目前儿科临床的常用药。从中医角度来讲,清肺消炎丸主治清肺化痰,止咳平喘,主方为汉代医圣张仲景《伤寒论》“麻杏石甘汤”加减,方中麻黄宣肺平喘,为君药;杏仁、牛蒡子、葶苈子降气平喘,一升一降,调畅气机;石膏清泻肺火,地龙化痰平喘,共为臣药;人工牛黄,羚羊角清热解毒[20]。小儿纯阳体质,肺脾不足,肝常有余,故容易外感六淫邪气;加之喂养不当,容易形成食积;外感邪气,郁闭肺气,日久化热,肺气失宣,故而出现发热、咳嗽、咳黄白黏痰、喘息、鼻翼煽动,即所谓小儿喘嗽,热盛至极,肝风内动,则会抽搐。清肺消炎丸解小儿肺气郁闭,加地龙化痰平喘,葶苈子和牛蒡子降肺止咳,牛黄、羚羊角为寒凉之物,归肝经,最善解肝热动风,所以清肺消炎丸可用于治疗小儿高热引起的肺炎喘嗽且伴有高热抽搐等热盛动风之症。
现代药理学研究已经显示,清肺消炎丸具有多种抗炎成分,包括牛蒡子苷、牛蒡子苷元、绿原酸、麻黄碱、胆酸、介子酸等[21-23]。如牛蒡子苷在人体内分解为牛蒡子苷元发挥抗炎作用,而牛蒡子苷元可能是通过调节免疫应答起到抗炎作用;绿原酸是通过抑制COX-2、NF-κBp65发挥抗炎作用[24]。研究表明清肺消炎丸可以有效减少枸橼酸诱发的豚鼠咳嗽次数,显著延长咳嗽潜伏期;有效缓解乙酰胆碱引起的豚鼠离体气管平滑肌收缩;有效延长组胺致喘的豚鼠哮喘潜伏期[25]。此外,清肺消炎丸可以有效缓解肺心病患者的咳嗽、喘息等症状,改善患者肺功能,降低并发症发生率且安全性较高,还能提高肺心病患者急性感染后CD4+、CD4+/CD8+比值,具有一定免疫调节作用[26-27]。因此,清肺消炎丸具有镇咳,祛痰,平端,抗炎等多种药理作用,值得临床广泛应用。
为了更好地评价清肺消炎丸的用药安全性,本文研究了其对幼龄小鼠的LD50预试和最大给药量实验。LD50预试中,受试小鼠均未出现死亡,也未表现出明显的中毒症状,其毒性较小,无法测出LD50。而LD50预试中幼龄小鼠1 d的最高给药剂量为48 g/kg,相当于6~12岁儿童(体质量按35 kg计算,用量为40丸/次,3次/日,5 g/60丸)临床用药量的168倍,其毒性反应对其他安全性实验及临床的提示意义已不大,故直接进行最大给药量实验。在最大给药量实验中,幼龄小鼠1 d的给药剂量为72 g/kg,相当于6岁至12岁儿童临床用药量的252倍,但是清肺消炎丸不会影响幼龄小鼠的生长发育、肝肾功能以及各脏器的组织形态学。本研究表明清肺消炎丸的毒性极低,在儿科应用具有较高的临床安全性。
| [1] |
Hou Y, Nie Y, Cheng B, et al. Qingfei Xiaoyan Wan, a traditional Chinesemedicine formula, ameliorates Pseudomonas aeruginosa-induced acute lung inflammation by regulation of PI3K/AKT and Ras/MAPK pathways[J]. Acta Pharmaceutica Sinica B, 2016, 6(3): 212-221. DOI:10.1016/j.apsb.2016.03.002 |
| [2] |
Zhao Z, Miao Y, Pan P, et al. Qingfei Xiaoyan Wan alleviates asthma through multi-target network regulation[J]. BMC complementary and alternative medicine, 2013, 13(1): 206. DOI:10.1186/1472-6882-13-206 |
| [3] |
Cheng B, Hou Y, Wang L, et al. Dual-bioactivity based liquidchromatography coupled quadrupole time of flight mass spectrometry for NF-κB inhibitors and β2AR agonists identification in Chinese Medicinal Preparation Qingfei Xiaoyan Wan[J]. Analytical and bioanalytical chemistry, 2012, 404(8): 2445-2452. DOI:10.1007/s00216-012-6332-9 |
| [4] |
Hou Y, Cheng B, Zhou M, et al. Searching for synergistic bronchodilators and novel therapeutic regimens for chronic lung diseases from a traditional Chinese medicine, Qingfei Xiaoyan Wan[J]. Plos one, 2014, 9(11): e113104. DOI:10.1371/journal.pone.0113104 |
| [5] |
胡思源, 李金惠, 唐方, 等. 清肺消炎丸治疗小儿急性支气管炎(痰热壅肺证)的临床观察[J]. 中草药, 2016, 47(10): 1746-1749. DOI:10.7501/j.issn.0253-2670.2016.10.019 |
| [6] |
赵晓敏. 清肺消炎丸联合西药治疗小儿病毒性肺炎临床观察[J]. 中草药, 2007, 38(9): 1384-1385. DOI:10.3321/j.issn:0253-2670.2007.09.036 |
| [7] |
魏伟, 吴希美, 李元建. 药理实验方法学[M]. 第4版. 北京: 人民卫生出版社, 2010.
|
| [8] |
国家食品药品监督管理局.中药、天然药物急性毒性研究技术指导原则[S].北京: 2005.
|
| [9] |
Pan H, Zhang Y, Liang B, et al. Acute and subchronic toxicity of Dusky-Skinned mushroom, amauroderma rude (Agaricomycetes)[J]. International journal of medicinal mushrooms, 2017, 19(8): 727. DOI:10.1615/IntJMedMushrooms.2017021269 |
| [10] |
Tang R, Tian R, Cai J, et al. Acute and sub-chronic toxicity of Cajanus cajan leaf extracts[J]. Pharmaceutical biology, 2017, 55(1): 1740-1746. DOI:10.1080/13880209.2017.1309556 |
| [11] |
El Kabbaoui M, Chda A, El-Akhal J, et al. Acute and sub-chronic toxicity studies of the aqueous extract from leaves of Cistus ladaniferus L. in mice and rats[J]. Journal of ethnopharmacology, 2017, 209: 147-156. DOI:10.1016/j.jep.2017.07.029 |
| [12] |
Shi J, Li S, Ma Z, et al. Acute and sub-chronic toxicity of tetrandrine in intravenously exposed female BALB/c mice[J]. Chinese journal of integrative medicine, 2016, 22(12): 925-931. DOI:10.1007/s11655-015-2303-2 |
| [13] |
Ong YS, Yazan LS, Ng WK, et al. Acute and subacute toxicity profiles of thymoquinone-loaded nanostructured lipid carrier in BALB/c mice[J]. International journal of nanomedicine, 2016(11): 5905. |
| [14] |
Antonelli-Ushirobira TM, Blainski A, Fernandes HG, et al. Acute toxicity and long-term safety evaluation of the crude extract from rhizomes of Limonium brasiliense in mice and rats[J]. Journal of ethnopharmacology, 2015(174): 293-298. |
| [15] |
Bower G, Toma T, Harling L, et al. Bariatric surgery and non-alcoholic fatty liver disease:a systematic review of liver biochemistry and histology[J]. Obesity surgery, 2015, 25(12): 2280-2289. DOI:10.1007/s11695-015-1691-x |
| [16] |
Söderberg C, Stål P, Askling J, et al. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up[J]. Hepatology, 2010, 51(2): 595-602. DOI:10.1002/hep.23314 |
| [17] |
Gonzalez FA, Van den Eynde E, Perez-Hoyos S, et al. Liver stiffness and aspartate aminotransferase levels predict the risk for liver fibrosis progression in hepatitis C virus/HIV-coinfected patients[J]. HIV medicine, 2015, 16(4): 211-218. DOI:10.1111/hiv.12197 |
| [18] |
Moledina DG, Hall IE, Thiessen-Philbrook H, et al. Performance of serum creatinine and kidney injury biomarkers for diagnosing histologic acute tubular injury[J]. American Journal of Kidney Diseases, 2017, 70(6): 807-816. DOI:10.1053/j.ajkd.2017.06.031 |
| [19] |
Hatakeyama Y, Horino T, Nagata K, et al. Evaluation of the accuracy of estimated baseline serum creatinine for acute kidney injury diagnosis[J]. Clinical and experimental nephrology, 2018, 22(2): 405-412. DOI:10.1007/s10157-017-1481-y |
| [20] |
何媛, 李冬生, 徐桐柏. 清肺消炎丸治疗肺源性心脏病(痰热壅肺证)疗效观察[J]. 辽宁中医杂志, 2016, 43(9): 1892-1894. |
| [21] |
崔庆新, 廖承美, 陈志凯, 等. HPLC法测定清肺消炎丸中三种抗炎成分含量[J]. 实验技术与管理, 2016, 33(10): 55-58, 63. |
| [22] |
罗辉, 王原, 李昂, 等. HPLC法测定清肺消炎丸中盐酸麻黄碱的含量[J]. 世界科学技术(中医药现代化), 2009, 11(3): 461-464. |
| [23] |
马福家, 曾晓娟, 司晓莉. 比色法测定清肺消炎丸中胆酸的含量[J]. 上海医药, 2014, 35(3): 58-59. |
| [24] |
Shan J, Fu J, Zhao Z, et al. Chlorogenic acid inhibits lipopolysaccharide-induced cyclooxygenase-2 expression in RAW264. 7 cells through suppressing NF-κB and JNK/AP-1 activation[J]. International immunopharmacology, 2009, 9(9): 1042-1048. DOI:10.1016/j.intimp.2009.04.011 |
| [25] |
侯媛媛, 李若洁, 程彬峰, 等. 清肺消炎丸对豚鼠的镇咳平喘作用研究[J]. 药物评价研究, 2010, 33(2): 103-105. |
| [26] |
马翮. 清肺消炎丸对肺心病患者免疫功能影响的临床研究[J]. 世界最新医学信息文摘, 2018, 18(50): 123-124. |
| [27] |
徐桐柏, 李冬生, 胡国华, 等. 清肺消炎丸对肺心病患者免疫功能影响的临床研究[J]. 天津中医药, 2016, 33(11): 658-660. DOI:10.11656/j.issn.1672-1519.2016.11.06 |