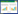文章信息
- 张瑜, 张富赓, 朱明丹, 张少强, 杜武勋, 肖学凤
- ZHANG Yu, ZHANG Fugeng, ZHU Mingdan, ZHANG Shaoqiang, DU Wuxun, XIAO Xuefeng
- 芪苈强心胶囊中酚酸类成分在大鼠体内药动学研究
- Pharmacokinetic study of phenolic acids in rat plasma after oral administration of Qili Qiangxin Capsule
- 天津中医药, 2019, 36(8): 808-813
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(8): 808-813
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.08.19
-
文章历史
- 收稿日期: 2019-03-29
2. 天津市环湖医院, 天津 300350;
3. 天津中医药大学第二附属医院, 天津 300150
近年来,慢性心力衰竭的发病率呈上升趋势,成为心血管疾病患者的主要死亡原因之一[1]。芪苈强心胶囊首次收载于2015版《中国药典》中,具有益气温阳,活血通络,利水消肿的功效。多中心临床试验研究显示芪苈强心胶囊联合西药能够提高慢性心力衰竭患者的运动耐力和生活质量,降低心血管事件和再住院率[2-3]。丹参为方中臣药,配伍人参、葶苈子,具有通经活血利水的功效。其中丹参的酚酸类化合物是心脏保护作用的主要活性物质,具有保护心肌缺血再灌注损伤、保护血管内皮细胞、抗血栓及抗动脉粥样硬化等多种药理活性[4],作用机制涉及改善心肌能量代谢、抑制炎症反应和氧化应激、提高心肌细胞活力、抑制凋亡等[5-8]。因此,本实验建立高效液相色谱-串联质谱(HPLC-MS/MS)的方法测定芪苈强心胶囊中臣药丹参的6种酚酸类活性成分(丹酚酸A、丹酚酸B、丹参素、紫草酸、迷迭香酸及原儿茶酸)的血药浓度,并研究上述活性成分在大鼠体内的药动学特征,为进一步明确芪苈强心胶囊的药效物质基础提供实验依据。
1 材料和仪器HPLC-MS/MS质谱仪:采用API 4000 trap液质联用系统,SER. N:AR26221101(美国应用生物系统公司,装备岛津LC-20 AD泵、SIL-20 AC恒温自动进样器、CBM-20 A控制器、CTO-20 A柱温箱、Analyst Software色谱工作站(1.5.2版本)),XS 205型电子天平(瑞士Mettler Toledo公司),Sorvall RC6+型离心机(美国Thermo scientific公司),MIKRO 220R型低温高速离心机(德国Hettich公司),Targin VX-02多管蜗旋振荡器(北京踏锦科技有限公司)。
芪苈强心胶囊(丹酚酸A0.772 mg/g,丹酚酸B 3.987 mg/g,丹参素1.770 mg/g,紫草酸0.337 mg/g,迷迭香酸0.354 mg/g,原儿茶酸0.050 mg/g)[9]购自石家庄以岭药业(批号140805);标准品丹酚酸B(批号111562-201515,质量分数96.2%),丹参素(批号110855-201614,质量分数98.1%),迷迭香酸(批号111871-201505,质量分数98.5%),原儿茶酸(批号110809-201205,质量分数99.9%)均购自中国食品药品检定研究院;丹酚酸A(批号H1315006,质量分数≥98%),紫草酸(批号H1624050,质量分数≥ 98%)均购自上海阿拉丁试剂有限公司;水为超纯水,乙腈、甲酸为色谱纯,其他试剂均为分析纯。
SPF级健康雄性SD大鼠(200~240 g)由解放军军事医学科学院实验动物中心提供,合格证号SCXK(军)2012-0004,在天津中医药大学的动物房内饲养,适应性喂养1周后进行实验。本课题经过天津中医药大学伦理委员会批准(批准号:TCM-CAEC2015023)。
2 方法与结果 2.1 色谱与质谱条件Agilent ZOBRAX XDB-C18(4.6 mm×50 mm,3.5 μm),柱温40 ℃,流动相0.1%甲酸水溶液(A)-含0.1%甲酸的乙腈溶液(B)梯度洗脱(0.01~0.6 min,7% B;0.6~0.8 min,7%~15% B;0.8~7.8 min,15%~65% B;7.8~8.8 min,65%~100% B;8.8~9.8 min,100% B;9.8~9.81 min,100%~7% B;9.81~12 min,7% B),流速0.45 mL/min,进样量10 μL。
电喷雾离子源(ESI),负离子模式检测,多反映监测(MRM)扫描方式,喷雾电压-4 200 V,脱溶液温度600 ℃,气帘气20 L/min,雾化气65 L/min,加热辅助气55 L/min。6种酚酸类成分质谱参数见表 1。
精密称取丹酚酸A、丹酚酸B、丹参素、紫草酸、迷迭香酸及原儿茶酸标准品适量,分别加二甲基亚砜(DMSO)溶解并稀释成2 mg/mL的储备液。分别精密吸取上述储备液适量,混合并用甲醇:水(1:1)溶液进行逐级稀释,得到混合标准品系列溶液质量浓度如下:丹酚酸A、原儿茶酸(5、10、25、100、250、1 000、2 500、5 000、1×104 ng/mL);丹酚酸B、紫草酸、迷迭香酸(10、20、50、200、500、2 000、5 000、1×104、2×104 ng/mL);丹参素(50、100、250、500、1 000、2 500、1×104、2.5×104、1×105 ng/mL),上述储备液和标准系列溶液均置于4 ℃储存。
2.2.2 内标溶液精密称取氯霉素标准品适量,加甲醇:乙腈(1:1)溶解摇匀,配制成浓度100 ng/mL的内标溶液(IS),置于4 ℃储存备用。
2.3 血浆样品处理取大鼠血浆样品50 μL,依次加入5 μL标准溶液(50%甲醇水)、10 μL维生素C(1.4 mg/mL-100% H2O)和150 μL IS溶液,涡旋30 s,离心10 min(4 ℃ 15 000 r/min),取上清液10 μL进样分析。
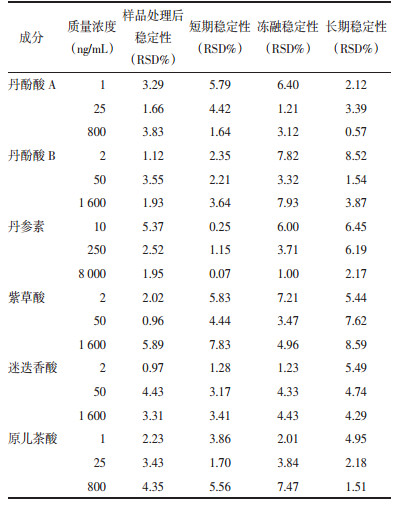
2.4 方法学验证 2.4.1 专属性考察分别取空白血浆(等体积甲醇代替内标溶液)、空白血浆+标准品(丹酚酸A、原儿茶酸血浆样品溶液的质量浓度为0.5 ng/mL,丹酚酸B、紫草酸、迷迭香酸血浆样品溶液的质量浓度为1 ng/mL,丹参素血浆样品溶液的质量浓度为5 ng/mL)及灌胃给予芪苈强心胶囊混悬液后20 min的大鼠血浆样品,按2.3项处理血浆样品,并按2.1项下条件进行HPLC-MS/MS分析,得到空白血浆、空白血浆+标准品和给药后血浆样品的色谱图,结果见图 1。结果表明:丹酚酸A、丹酚酸B、丹参素、紫草酸、迷迭香酸、原儿茶酸及IS的保留时间分别为7.42、7.59、4.97、7.41、7.45、6.78及8.23 min,各酚酸类成分和IS能够完全分离,不会受到大鼠血浆样品中杂质及内源性物质的干扰,方法专属性良好。

|
| A.丹酚酸A;B.丹酚酸B;C.丹参素;D.紫草酸;E.迷迭香酸;F.原儿茶酸;G.氯霉素 图 1 空白血浆(1)、空白血浆+标准品(2)和灌胃1.3g/kg芪苈强心胶囊后20 min的含药血浆(3)的HPLC-MS/MS色谱图 Fig. 1 HPLC-MS/MS chromatogram of blank plasma(1), blank plasma + reference substances(2), and plasma samples after oral administration of 1.3 g/kg Qili Qiangxin Capsule at 20 min(3) |
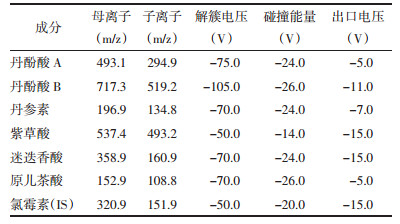
取大鼠空白血浆50 μL,加入混合标准品系列溶液,得到质量浓度为0.5、1、2.5、10、25、100、250、500、1 000 ng/mL的丹酚酸A和原儿茶酸血浆样品溶液;1、2、5、20、50、200、500、1 000、2 000 ng/mL的丹酚酸B、紫草酸、迷迭香酸血浆样品溶液;5、10、25、50、100、250、1 000、2 500、1×104 ng/mL的丹参素血浆样品溶液。根据2.3项处理血浆样品,并按2.1项下条件进行HPLC-MS/MS分析。以标准品质量浓度为横坐标(X),标准品与内标峰面积比值为纵坐标(Y)进行线性回归分析,结果见表 2。
|
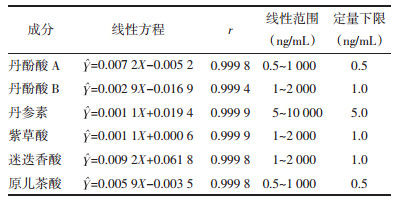
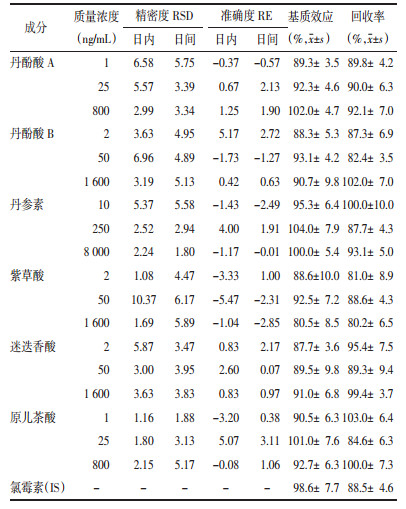
取大鼠空白血浆,加入低、中、高3个质量浓度的混合标准品溶液,得到丹酚酸A(1、25、800 ng/mL),丹酚酸B(2、50、1 600 ng/mL),丹参素(10、250、8 000 ng/mL),紫草酸(2、50、1 600 ng/mL),迷迭香酸(2、50、1 600 ng/mL)及原儿茶酸(1、25、800 ng/mL)低、中、高3个质量浓度的质控样品(QC),根据2.3项处理血浆样品,并按2.1项下条件进行HPLC-MS/MS分析。于同日内连续进样6次,计算日内精密度;连续测定3 d,计算日间精密度,并测定均值与真实值的相对误差,计算准确度。精密度以相对标准偏差(RSD)表示,准确度以相对误差(RE)表示,结果见表 3。在上述3个质量浓度下,各成分日内和日间精密度的RSD均 < 15%,且准确度的RE在±15%之间,符合生物样品测定的要求。
|
取上述低、中、高3个质量浓度的QC样品,根据2.3项处理血浆样品,并按2.1项下条件进行HPLC-MS/MS分析,记录成分峰面积(A);另取甲醇水溶液代替空白血浆,其余操作如上,得到成分峰面积(B);另取大鼠空白血浆,根据2.3项处理血浆样品后加入QC样品,进样分析,记录成分峰面积(C),A和B的比值为基质效应,A和C的比值为回收率,结果见表 3。各成分和IS的基质效应的范围在80.5%~104%,回收率的范围在81.0%~103%。
2.4.5 稳定性考察取上述低、中、高3个质量浓度的QC样品,各6份,考察样品在自动进样器中放置24 h(样品处理后稳定性),室温放置24 h(短期稳定性),在-20℃条件下冻融3次(冻融稳定性)及在-80 ℃条件下放置30 d(长期稳定性)的稳定性,结果见表 4。血浆中6种酚酸类成分稳定性的RSD均 < 15%,说明样品在上述条件下放置均稳定。
|
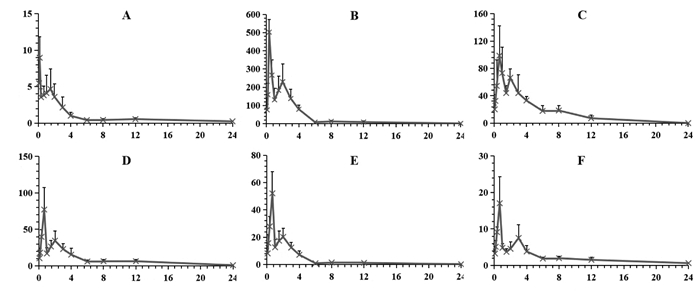
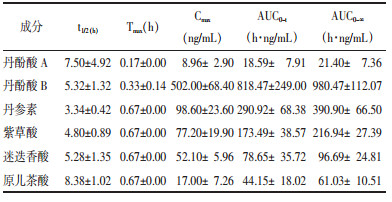
取6只雄性SD大鼠,实验前大鼠禁食12 h,自由饮水。灌胃给予芪苈强心胶囊混悬液(0.5% CMC-Na配制成混悬液),给药剂量1.3 g/kg,于给药后0.083、0.167、0.333、0.667、1、1.5、2、3、4、6、8、12、24 h经目内眦静脉丛取血0.5 mL,置于肝素钠抗凝管中,在12 000 r/min的条件下离心10 min,分离血浆,置于-20 ℃的冰箱中保存待测,测定前根据2.3项处理血浆样品。大鼠灌胃芪苈强心胶囊后血浆中6种酚酸类成分(丹酚酸A、丹酚酸B、丹参素、紫草酸、迷迭香酸及原儿茶酸)的药时曲线如图 2。采用DAS 3.0软件非房室模型计算药动学参数,结果见表 5。
|
| A:丹酚酸A;B:丹酚酸B;C:丹参素;D:紫草酸;E:迷迭香酸;F:原儿茶酸 图 2 大鼠灌胃芪苈强心胶囊后血浆中6种酚酸类成分的药时曲线(n=6) Fig. 2 Mean concentration-time profiles of six phenolic acids after oral administration of Qili Qiangxin Capsule(n=6) |
|
本实验建立HPLC-MS/MS方法同时测定大鼠灌胃芪苈强心胶囊后,血浆中丹参的6种酚酸类活性成分(丹酚酸A、丹酚酸B、丹参素、紫草酸、迷迭香酸、原儿茶酸)的血药浓度,经方法学考察符合生物样品测定的要求,可用于生物体内的药动学研究。实验初期对质谱条件进行优化,根据文献报道[10-11]酚酸类成分在负离子模式下响应良好,本实验对正、负离子两种扫描方式下待测物的响应强度进行了比较,结果显示在负离子模式下灵敏度更高,可以获得稳定的[M-H]-,因此选用负离子模式对待测物进行检测。在对色谱条件优化时,酚酸类成分检测的流动相多为加入酸的水-乙腈系统[12],因此实验选择0.1%甲酸水溶液(A)-含0.1%甲酸的乙腈溶液(B)为流动相,结果显示各待测物分离效果最佳,色谱峰峰形较好。
本实验大鼠体内丹酚酸A,丹酚酸B,丹参素,紫草酸,迷迭香酸,原儿茶酸均存在明显的双峰现象,表明芪苈强心胶囊中上述酚酸类成分在体内可能通过肝肠循环进行重吸收。据文献报道大鼠灌胃丹参提取物后,酚酸类成分吸收表现为单峰[13-14]或双峰[15-16],而复方中药芪苈强心胶囊成分复杂,且酚酸类成分存在同系物转化,丹酚酸B可通过水解掉一分子丹参素成为紫草酸,再脱羧转化成丹酚酸A,而丹酚酸A可进一步降解成为丹酚酸C和异丹酚酸C[17],另在生物体内大分子的丹酚酸A、丹酚酸B和迷迭香酸可转化成小分子丹参素[18],因此本实验药时曲线呈现双峰吸收现象。药动学结果显示:大鼠灌胃芪苈强心胶囊后,血浆中6种酚酸类成分的达峰时间(Tmax)在10~40 min内,半衰期(t1/2)在3.34~8.38 h,呈现吸收快、消除亦快的特点。药动学参数血药达峰浓度(Cmax)和血药浓度-时间曲线下面积(AUC0-∞)能够评价药物的吸收程度和体内暴露情况。大鼠灌胃芪苈强心胶囊后,血浆中酚酸类活性成分的Cmax和AUC0-∞从大到小排序依次为丹酚酸B>丹参素>紫草酸>迷迭香酸>原儿茶酸>丹酚酸A,其中丹酚酸B的Cmax(502 ng/mL)和AUC0-∞(980.47 h·ng/mL)最高,说明其吸收程度和体内暴露情况优于方中其他活性成分。既往研究报道丹酚酸B经大鼠口服后能够迅速吸收并转化成丹参素,因此丹参素在受试者体内具有较高的系统暴露水平[19-21]。但本研究中表明大鼠灌胃芪苈强心胶囊后,血浆中丹酚酸B的系统暴露水平明显高于其它成分,原因可能与芪苈强心胶囊中丹酚酸B的含量(3.987 mg/g)较高有关[9]。另一方面,丹酚酸B对心肌梗死具有保护作用,并能够明显改善心肌缺血再灌注损伤,对心血管系统具有显著的保护作用[22]。另外,课题组前期对芪苈强心胶囊含量测定结果显示酚酸类成分的含量从大到小排序依次为[9]:丹酚酸B >丹参素>丹酚酸A >迷迭香酸>紫草酸>原儿茶酸,而本研究中丹酚酸A的Cmax(8.96 ng/mL)和AUC0-∞(21.40 h·ng/mL)最低,其原因可能为丹酚酸A在正常机体内的吸收情况较差,或通过甲基化和葡萄糖醛酸化快速生成小分子代谢产物有关[23]。综上,本实验对芪苈强心胶囊中臣药丹参的6种酚酸类活性成分的药动学特征进行研究,阐述药物的体内过程,为进一步确定药效物质基础提供实验依据。
| [1] |
Beggs Simon AS., McDonaghRoy Theresa A., Gardner S.. Chronic heart failure:epidemiology, investigation and management[J]. Medicine, 2018, 46(10): 594-600. DOI:10.1016/j.mpmed.2018.07.006 |
| [2] |
Wang XL, Hou YZ, Mao JY, et al. Western medication plus Traditional Chinese Medicine preparations in patients with chronic heart failure:a prospective, single-blind, randomized, controlled, and multicenter clinical trial[J]. J Tradit Chin Med, 2017, 37(6): 756-766. DOI:10.1016/S0254-6272(18)30038-4 |
| [3] |
Sun J, Zhang K, Xiong WJ, et al. Clinical effects of a standardized Chinese herbal remedy, QiliQiangxin, as an adjuvant treatment in heart failure:systematic review and meta-analysis[J]. BMC Complement Altern Med, 2016, 16(1): 201. DOI:10.1186/s12906-016-1174-1 |
| [4] |
梁文仪, 陈文静, 杨光辉, 等. 丹参酚酸类成分研究进展[J]. 中国中药杂志, 2016, 41(5): 806-812. |
| [5] |
夏杨, 张惠军, 聂亚莉. 丹酚酸B预处理对心肌缺血/再灌注损伤能量代谢的影响[J]. 药物评价研究, 2018, 41(12): 2210-2213. |
| [6] |
孙大伟, 冯丽莎, 高青, 等. 基于自噬基因Beclin-1与LC3探讨丹参素对H/R大鼠心肌细胞ATP5G1表达的影响[J]. 世界中西医结合杂志, 2018, 13(11): 1493-1497. |
| [7] |
Chien MY, Chuang CH, Chern CM, et al. Salvianolic acid A alleviates ischemic brain injury through the inhibition of inflammation and apoptosis and the promotion of neurogenesis in mice[J]. Free radical biology and medicine, 2016(99): 508-519. |
| [8] |
朱小琴, 华晓芳, 李磊, 等. 紫草酸通过抑制凋亡及磷酸化P65改善脂多糖对H9c2细胞的损伤[J]. 医学研究杂志, 2016, 45(1): 143-146. |
| [9] |
Zhang FG, Zhang Y, Li XF, et al. Research on Q-markers of Qiliqiangxincapsule for chronic heart failure treatment based on pharmacokinetics and pharmacodynamics association[J]. Phytomedicine, 2018(44): 220-230. |
| [10] |
孙宁宁, 张可佳, 耿婉丽, 等. 基于UPLC-Q-TOF-MS的加参片提取物化学成分分析[J]. 中草药, 2018, 49(2): 293-304. |
| [11] |
范姣姣, 张路, 文红梅, 等. 液质联用技术快速鉴定白花蛇舌草中黄酮类化学成分[J]. 中国实验方剂学杂志, 2013, 19(23): 62-65. |
| [12] |
孙志, 周霖, 左莉华, 等. 血必净注射液超高效液相数字化指纹图谱及4种酚酸类化合物含量测定[J]. 中国医院药学杂志, 2017, 37(11): 1060-1064. |
| [13] |
梁艳芬, 黄鸿章, 许丽媛, 等. 丹参素钠、迷迭香酸和丹酚酸B在大鼠体内的药动学[J]. 沈阳药科大学学报, 2015, 32(11): 875-881. |
| [14] |
Zhang YJ, Wu L, Zhang QL, et al. Pharmacokinetics of phenolic compounds of Danshen extract in rat blood and brain by microdialysis sampling[J]. J Ethnopharmacol, 2011, 136(1): 129-136. DOI:10.1016/j.jep.2011.04.023 |
| [15] |
Lai XJ, Zhang L, Li JS, et al. Comparative pharmacokinetic and bioavailability studies of three salvianolic acids after the administration of Salviae miltiorrhizae alone or with synthetical borneol in rats[J]. Fitoterapia, 2011, 82(6): 883-888. DOI:10.1016/j.fitote.2011.04.015 |
| [16] |
Liu YQ, Cai Q, Liu CS, et al. Simultaneous determination and pharmacokinetic comparisons of multi-ingredients after oral administration of Radix salviae miltiorrhizae extract, hawthorn extract, and a combination of both extracts to rats[J]. J Anal Methods Chem, 2014(2014): 617367. |
| [17] |
李伟, 李淑明, 李挺洋, 等. 复方丹参滴丸中君药丹参的质量标志物研究[J]. 中草药, 2018, 49(9): 2000-2006. |
| [18] |
Liu Z, Zheng X, Guo Y, et al. Quantitatively metabolic profiles of salvianolic acids in rats after gastric-administration of Salvia miltiorrhiza extract[J]. Fitoterapia, 2016(113): 27-34. |
| [19] |
Li M, Wang F, Huang Y, et al. Systemic exposure to and disposition of catechols derived from Salvia miltiorrhiza roots(Danshen) after intravenous dosing Dan Hong injection in human subjects, rats, and dogs[J]. Drug Metab Dispos, 2015, 43(5): 679-690. DOI:10.1124/dmd.114.061473 |
| [20] |
Lu T, Yang JL, Gao XM, et al. Plasma and urinary tanshinol from Salvia miltiorrhiza(Danshen), can be used as pharmacokinetic markers for cardiotonic pills, a cardiovascular herbal medicine[J]. Drug Metab Dispos, 2008, 36(8): 1578. DOI:10.1124/dmd.108.021592 |
| [21] |
万仁忠, 许妍妍, 谷元, 等. 丹酚酸B及其活性代谢产物在大鼠体内药动学研究[J]. 中草药, 2011, 42(2): 335-339. |
| [22] |
Zhang JM, Liao W, He YX, et al. Study on intestinal absorption and pharmacokinetic characterization of diester diterpenoid alkaloids in precipitation derived from fuzi-gancao herb-pair decoction for its potential interaction mechanism investigation[J]. J Ethnopharmacol, 2013, 147(1): 128-135. DOI:10.1016/j.jep.2013.02.019 |
| [23] |
Shen Y, Wang X, Xu L, et al. Characterization of metabolites in rat plasma after intravenous administration of salvianolic acid A by liquid chromatography/time of flight mass spectrometry and liquid chromatography/ion trap mass spectrometry[J]. Rapid Commun Mass Spectrom, 2009, 23(12): 1810-1816. DOI:10.1002/rcm.4078 |
2. Tianjin Huanhu Hospital, Tianjin 300350, China;
3. Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300150, China
 2019, Vol. 36
2019, Vol. 36