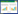文章信息
- 莫雨佳, 薛宇涛, 谭丽, 喻刚艳, 董姊怡, 张琦, 陆洋, 杜守颖
- MO Yujia, XUE Yutao, TAN Li, YU Gangyan, DONG Ziyi, ZHANG Qi, LU Yang, DU Shouying
- 不同剂量人参茎叶总皂苷对阿司匹林大鼠体内药动学的影响
- Effects of different doses of total ginsenoside of ginseng stems and leaves on the pharmacokinetics of aspirin in rats
- 天津中医药, 2019, 36(8): 814-818
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(8): 814-818
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.08.20
-
文章历史
- 收稿日期: 2019-05-04
心脑血管疾病是中老年人发病率和病死率最高的疾病之一。近年来,随着口老龄化以及心脑血管疾病年轻化的发展趋势,社会越来越关注心脑血管疾病的防治。阿司匹林已被证明在心脑血管疾病的一级预防和二级预防中是有效的,长期服用低剂量的阿司匹林(75~150 mg)可以有效的防治多种心脑血管疾病[1-2]。临床建议年龄在40~69岁的中老年人应该长期服用阿司匹林以预防和治疗心脑血管疾病[3-4]。中药人参具有大补元气,复脉固脱,补脾益肺,生津养血,安神益智的功效,被普遍应用在中老年人的日常养生保健中。人参茎叶总皂苷(TGSL)是人参干燥茎叶经加工制成的总皂苷,临床上多用于心阴亏虚、气虚血瘀所导致的失眠、神经衰弱、缺血性中风、冠心病等疾病的辅助治疗,常见制剂有益心宁神片、血栓心脉宁、参芍胶囊、麝香通心滴丸。人参与阿司匹林均为中老年人日常生活中保健预防的常用药,然而关于二者联用药物相互作用的研究较少,临床上通过人参茎叶总皂苷制剂与阿司匹林联用已达到改善阿司匹林抵抗或增强阿司匹林疗效的目的[5-6]。本实验室前期已证明三七总皂苷、红参水煎液等会提高阿司匹林在体内的生物利用度[7-8],证明两种药物联用会起到一定的药物相互作用,然而由于不同人参保健食品含量的差异以及人们用药量、用药次数的差异,导致二者联用的影响并不清楚。
由于阿司匹林在体内会快速水解代谢为水杨酸,不易检测,相关研究往往选择其代谢产物水杨酸为指标成分进行分析,本实验以人参茎叶总皂苷与阿司匹林的联用为研究对象,通过对比单次服用不同剂量以及多次服用人参茎叶总皂苷对阿司匹林代谢产物水杨酸在大鼠体内的药动学影响,研究人参与阿司匹林联用的剂量相关性,为中老年人日常用药提供参考。
1 仪器与材料 1.1 仪器日本岛津高效液相色谱仪(LC-20AD泵,SIL-20A自动进样系统,SPD-M20A二极管阵列检测器,DGU-20A在线脱气系统,LC solution色谱工作站);赛多利斯BSA 224S电子分析天平(赛多利斯科学仪器(北京)有限公司);G20型医用离心机(北京白洋医疗器械有限公司)。
1.2 试剂阿司匹林(批号:A201610786,购买于华阴市锦前程药业有限公司);人参茎叶总皂苷(批号:FY1531S0906,购买于南通飞宇生物科技有限公司);水杨酸对照品(批号:100106-201605,含量以99.3%计,购买于中国食品药品检定研究院);羧甲基纤维素钠(批号:20131022,购买于国药集团化学试剂有限公司);乙腈(色谱级);磷酸(色谱级);水(购买于杭州娃哈哈集团有限公司)。
1.3 实验动物SD大鼠30只,SPF级,雄性,体质量(200±20)g,购买于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。
2 方法与结果 2.1 色谱条件Kromasil C18色谱柱(4.6 mm×150 mm,5 μm),以乙腈-0.1%磷酸水(40:60)为流动相,柱温为30 ℃,流速为1.0 mL/min,检测波长为303 nm,进样量10 μL/20 μL。
2.2 对照品溶液的制备精密称取水杨酸对照品4.93 mg于10 mL容量瓶中,加乙腈溶解并定容至刻度线,配制成浓度为493.00 μg/mL的水杨酸对照品溶液,分别用乙腈将其稀释为浓度为4.93、9.86、19.72、49.30、98.60、197.20 μg/mL的水杨酸对照品溶液。
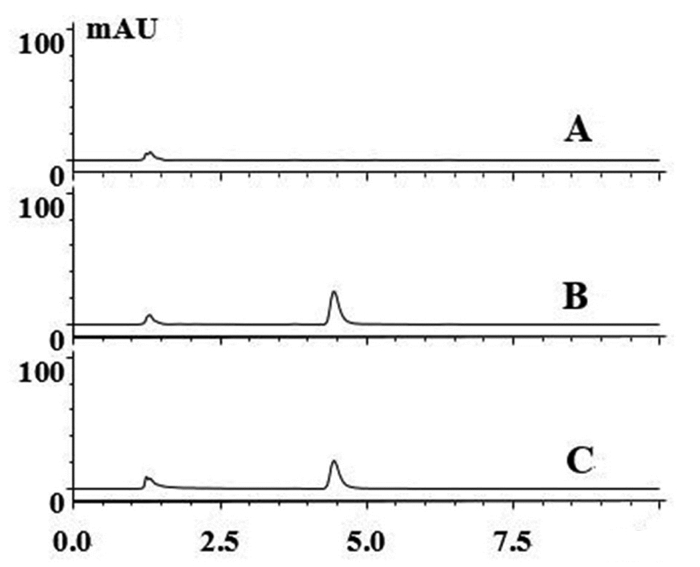
2.3 方法学考察 2.3.1 专属性考察分别取空白血浆、给药后动物血浆100 μL,加200 μL乙腈涡旋混匀,6 000 r/min离心10 min,取上清液进样,并与水杨酸对照品溶液对比进行专属性考察,实验结果如图 1所示,大鼠血浆中水杨酸的保留时间为4.5 min,且空白血浆中内源性物质及其他成分对其无干扰,色谱条件专属性强。
|
| A:空白血浆;B:水杨酸对照品;C:给药后血浆样品 图 1 大鼠血浆中水杨酸的色谱图专属性 Fig. 1 Chromatogram specificity of salicylic acid in rat plasma |
精密移取不同浓度的水杨酸对照品溶液10 μL于0.5 mL离心管中,加100 μL空白血浆涡旋混匀,得到血药浓度为0.49、0.99、1.97、4.93、9,86、19.72、49.30 μg/mL的血浆标准溶液,加190 μL乙腈涡旋混匀,6 000 r/min离心10 min,取上清液进样;以水杨酸的峰面积(Y)为纵坐标,以水杨酸的血药浓度(X)为横坐标进行线性回归,结果表明,水杨酸血药浓度在0.49~98.60 μg/mL内线性关系良好,其方程为Y=10.68X+2.58,r2=0.999 9,其最低定量限和最低检测限分别为0.49 μg/mL和0.20 μg/mL。
2.3.3 准确度考察分别精密移取9.86(低)、49.30(中)、197.20(高)μg/mL 3种不同浓度的水杨酸对照品溶液各10 μL于0.5 mL离心管中,加100 μL空白血浆涡旋混匀,加190 μL乙腈涡旋混匀,6 000 r/min离心10 min,取上清液进样,每组平行6份;根据标准曲线分别计算低、中、高3组不同浓度的水杨酸血浆质控样品的实测浓度,并与其理论浓度进行比较,计算出方法的准确度以及相对误差(RE),具体结果如表 1所示,其相对误差均在±15%之内,表示方法的准确度良好。
按2.3.3项下方法制备低、中、高3种不同浓度的血浆质控样品,连续实验3 d,考察方法的日间精密度和日内精密度;根据标准曲线分别计算低、中、高3组不同浓度的水杨酸血浆质控样品的实测浓度,并计算其相对标准偏差(RSD),具体结果如表 1所示,其日间精密度和日内精密度均在±15%之内,表示方法的精密度良好。
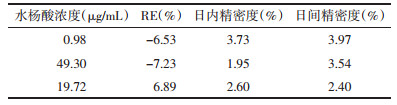
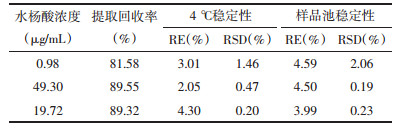
2.3.5 提取回收率考察按2.3.3项下方法制备低、中、高3种不同浓度的血浆质控样品,另外,分别精密移取低、中、高3种不同浓度的水杨酸对照品溶液各10 μL于0.5 mL离心管中,加入乙腈处理过后的血浆,制得相应浓度的对照样品,每组6份;以水杨酸血浆质控样品与对照样品的峰面积之比计算提取回收率,结果如表 2所示,3种浓度的平均提取回收率均>70%,表示方法的提取回收率良好。
|
按2.3.3项下方法制备低、中、高3种不同浓度的血浆质控样品,每组平行6份,进样;将各组均分为2份,分别在4 ℃冰箱和样品池放置24 h,考察样品在不同温度下放置的稳定性;通过对比放置前后血浆质控样品的浓度变化,分别计算其RE与RSD值,结果如表 2所示,样品放置在不同温度下的稳定性RE和RSD均在5%以内,表示样品的稳定性良好。
2.4 药代动力学研究方法雄性SD大鼠随机均分为阿司匹林单用组(Aspirin)、低剂量联用组(LTGSL+Aspirin)、中剂量联用组(MTGSL+Aspirin)、高剂量联用组(HTGSL+Aspirin)以及长期用药联用组(Long-term Group),每组6只。实验前禁食不禁水12 h,Aspirin组灌胃给予阿司匹林(12.5 mg/kg),LTGSL+Aspirin组灌胃给予阿司匹林(12.5 mg/kg)和人参茎叶总皂苷(20 mg/kg),MTGSL+Aspirin组灌胃给予阿司匹林(12.5 mg/kg)和人参茎叶总皂苷(40 mg/kg),HTGSL+Aspirin组灌胃给予阿司匹林(12.5 mg/kg)和人参茎叶总皂苷(80 mg/kg),Long-term Group组连续7 d灌胃给予人参茎叶总皂苷(40 mg/kg)后,第8天灌胃给予阿司匹林(12.5 mg/kg)和人参茎叶总皂苷(40 mg/kg)。所有实验组灌胃给药后,分别于给药后0.083、0.25、0.5、1、2、4、6、8、10 h经眼眶取血0.5 mL于0.5 mL肝素钠离心管中,6 000 r/min离心10 min,取血浆100 μL,加200 μL乙腈涡旋混匀,6 000 r/min离心10 min,取上清液进样。
2.5 统计学处理水杨酸的血药浓度数据运用DAS 3.0(Drug And Statistics of Windows 3.0)统计软件处理,采用非房室模型计算药动学参数。运用SAS 8.0软件对药动学参数进行统计分析,实验数据用均数±标准差(x±s)表示,结果采用单因素方差分析,以P < 0.05视为有统计学意义。
2.6 药代动力学结果Aspirin、LTGSL+Aspirin、MTGSL+Aspirin、HTGSL+Aspirin四组的水杨酸药-时曲线如图 2所示,Aspirin、MTGSL+Aspirin、Long-term Group 3组的水杨酸药-时曲线如图 3所示;所有实验组的药动学参数如表 3所示。从图表可知,与Aspirin组相比,低剂量(20 mg/kg)和中剂量(40 mg/kg)的人参茎叶总皂苷对阿司匹林在大鼠体内药动学无显著影响,但高剂量(80 mg/kg)的人参茎叶总皂苷与阿司匹林联用后,水杨酸在体内的Cmax以及AUC(0-t)显著增加,V与CL显著降低(P < 0.05);此外,虽然单次服用中剂量(40 mg/kg)的人参茎叶总皂苷对阿司匹林的药动学无显著性影响,但通过长期给药1周后,中剂量(40 mg/kg)的人参茎叶总皂苷与阿司匹林联用后,会使水杨酸在体内的Cmax以及AUC(0-t)显著增加(P < 0.05);其余组间参数并无显著性影响。
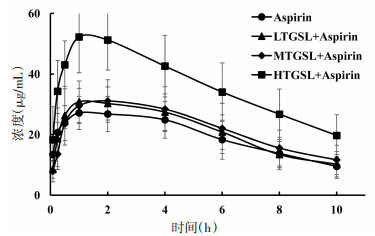
|
| 图 2 不同剂量人参茎叶总皂苷与阿司匹林联用的药-时曲线图(n=6) Fig. 2 Drug-time curve of different doses of ginseng stem and leaf total saponin combined with aspirin(n=6) |
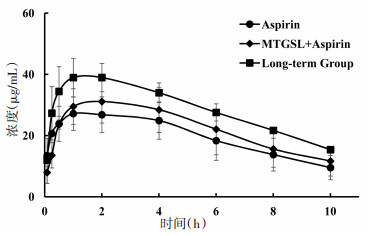
|
| 图 3 长期服用人参茎叶总皂苷后与阿司匹林联用的药-时曲线图(n=6) Fig. 3 Drug-time curve for long-term use of ginseng stem and leaf total saponin combined with aspirin(n=6) |

|
临床上,阿司匹林已经被广泛用于治疗缺血性中风、心肌梗死等多种心脑血管疾病,阿司匹林属于环氧化酶抑制剂类,其治疗心脑血管疾病的机制主要是基于对环氧化酶的不可逆性抑制,使血小板内花生四烯酸无法转化为环内过氧化物,最终抑制血小板的血栓素A2生成[9],在临床治疗期间,为了起到更好的治疗效果,阿司匹林也常与其他药物联合使用,如氯吡格雷等,近年来,研究人员也发现疏血通注射液、川芎嗪注射液[10]、三七总皂苷片[11]、复方丹参滴丸[12]等中成药类亦可以加强阿司匹林抗血栓的功效。
虽然阿司匹林与中药或者中成药类制剂的合用越来越多,但其合用的机制机理研究却相对较少,本实验在前期研究的基础上,进一步考察了不同剂量的人参总皂苷与阿司匹林在大鼠体内的相互作用。实验参考市售人参茎叶总皂苷片的含量以及日服用量,设计了低(150 mg)、中(300 mg)、高(600 mg)3个不同剂量,通过剂量折算给药后,结果表明,相比于单用阿司匹林,低、中剂量的人参茎叶总皂苷对阿司匹林体内吸收、代谢等无显著影响,但高剂量的人参茎叶总皂苷可以增加阿司匹林代谢物水杨酸在大鼠体内的血药浓度,其AUC(0-t)、Cmax显著增加,V显著降低,CL显著增加,其相对生物利用度是单用阿司匹林组的1.85倍,这表明人参茎叶总皂苷在一定的剂量下,可以增加阿司匹林在体内的血药浓度,同时可以提高其在血浆中的分布,并降低机体对其的总消除速率,进而增加在其血药浓度;同时,实验结果也表明,虽然单次中剂量人参茎叶总皂苷对阿司匹林在大鼠体内的吸收代谢无显著影响,但是长期服用人参茎叶总皂苷,亦可以促进阿司匹林在机体内的吸收,使其血药浓度和相对生物利用度增加,这可能与人参茎叶总皂苷在体内的半衰期较长,长期服用人参茎叶总皂苷导致其在机体内血药浓度维持在一定水平有关,也可能与人参茎叶总皂苷健脾益气的功效有关。
实验结果证实,人参茎叶总皂苷在一定的剂量下或在长期服用下,可以增加阿司匹林体内的生物利用度,其作用的机制可能表现为:1)在吸收方面Jacob等[13]提出皂苷类成分具有细胞膜渗透性,具体表现为通过溶解细胞膜表面的胆固醇进而影响细胞的转运和渗透特性,实验室前期也发现三七总皂苷可以促进阿司匹林和水杨酸的跨膜转运,因此,在本实验中,人参茎叶总皂苷可能是通过作为药物的吸收增强剂,增加阿司匹林在体内的吸收。2)在代谢消除方面,有研究表明,细胞色素p450酶系(CYP2C9)应与阿司匹林的代谢有关[14],而人参皂苷可以抑制CYP2C9的活性[15],进而延缓水杨酸在机体内部代谢消除。此外,实验室前期通过体外酶促实验证明,三七总皂苷类成分可以抑制羧酸酯酶2的水解活性,而羧酸酯酶2是机体内参与阿司匹林水解代谢的I相药物代谢酶[16],本实验中,人参茎叶总皂苷亦可能通过抑制羧酸酯酶2的活性,进一步延缓阿司匹林的水解及水杨酸的代谢消除。
本实验通过考察不同剂量的人参茎叶总皂苷对阿司匹林在大鼠体内的药动学影响,发现人参茎叶总皂苷可以促进阿司匹林在机体内的生物利用度,且存在一定的剂量相关性,临床上阿司匹林的每日最佳服用剂量范围为75~150 mg,在预防治疗心脑血管疾病的同时会带来一定的不良反应[17],研究表明,长期或者大剂量的服用阿司匹林会损伤人们的胃黏膜细胞,严重时可导致胃肠道出血等[18-20],结合本实验结果提示在中老年的日常生活用药中,需要注意人参等皂苷类药物与阿司匹林共同服用的相互作用,避免不必要的不良反应。
| [1] |
Collaborators MCOD. Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013:a systematic analysis for the Global Burden of Disease Study[J]. Lancet, 2013, 385(9963): 117-171. |
| [2] |
Blackwell L. Aspirin in the primary and secondary prevention of vascular disease:collaborative meta-analysis of individual participant data from randomised trials[J]. Lancet, 2010, 373(9678): 1849-1860. |
| [3] |
Bulugahapitiya U, Siyambalapitiya S, Sithole J, et al. Age threshold for vascular prophylaxis by aspirin in patients without diabetes[J]. Heart, 2008, 94(11): 1429-1432. DOI:10.1136/hrt.2008.150698 |
| [4] |
Dehmer SP, Maciosek MV, Flottemesch TJ, et al. Aspirin for the primary prevention of cardiovascular disease and colorectal cancer:a decision analysis for the U.S. preventive services task force[J]. Ann Intern Med, 2016, 164(12): 777-786. DOI:10.7326/M15-2129 |
| [5] |
程功, 闵宁斌, 吕晓莉, 等. 血栓心脉宁对阿司匹林抵抗患者血小板聚集率的影响[J]. 陕西医学杂志, 2013, 42(10): 1388-1389. DOI:10.3969/j.issn.1000-7377.2013.10.056 |
| [6] |
张静, 徐新民, 王未沫. 麝香通心滴丸联合阿司匹林治疗不稳定心绞痛[J]. 中西医结合心脑血管病杂志, 2011, 9(8): 917-918. DOI:10.3969/j.issn.1672-1349.2011.08.014 |
| [7] |
Tian ZH, Pang HH, Du SY, et al. Effect of panaxnotoginsen-gsaponins on the pharmacokinetics of aspirin in rats[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2017, 1040: 136-143. DOI:10.1016/j.jchromb.2016.12.007 |
| [8] |
薛宇涛, 谭宁, 喻刚艳, 等. 红参水提液对大鼠体内阿司匹林代谢物的药代动力学影响(英文)[J]. Chinese Medical Sciences Journal, 2018, 33(2): 107-113, 137-138. |
| [9] |
马晓兵. 抗血栓药物的研究进展[J]. 临床合理用药杂志, 2017, 10(30): 178-179. |
| [10] |
曾妙麟.活血化瘀注射剂联合阿司匹林对缺血性中风患者血小板功能影响的研究[D].武汉: 湖北中医药大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10507-1013208411.htm
|
| [11] |
王鹏飞, 王宏伟. 联用三七总甙片与阿司匹林治疗脑梗死的效果探析[J]. 当代医药论丛, 2016, 14(8): 151-152. |
| [12] |
李永明. 复方丹参滴丸联合阿司匹林治疗冠心病的疗效观察[J]. 中西医结合心血管病电子杂志, 2016(23). |
| [13] |
Jacob MC, Favre M, Bensa JC. Membrane cell permeabilization with saponin and multiparametric analysis by flow cytometry[J]. Cytometry A, 1991, 12(6): 550-558. DOI:10.1002/cyto.990120612 |
| [14] |
Agúndez JA, Garcíamartín E, Martínez C. Genetically based impairment in cyp2c8-and cyp2c9-dependent nsaid metabolism as a risk factor for gastrointestinal bleeding:is a combination of pharmacogenomics and metabolomics required to improve personalized medicine[J]. Expert Opin Drug Metab Toxicol, 2009, 5(6): 607-620. DOI:10.1517/17425250902970998 |
| [15] |
He N, Edeki T. The inhibitory effects of herbal components on CYP2C9 and CYP3A4 catalytic activities in human liver microsomes[J]. Am J Ther, 2004, 11(3): 206-212. DOI:10.1097/00045391-200405000-00009 |
| [16] |
王蕊, 姜剑伟, 李燕. 哺乳动物羧酸酯酶在药物代谢中的作用[J]. 药学学报, 2018, 53(2): 186-191. |
| [17] |
国家卫生计生委合理用药专家委员会, 中国药师协会. 冠心病合理用药指南[J]. 中国医学前沿杂志:电子版, 2016, 8(6): 19-108. |
| [18] |
Derry S, Loke YK. Risk of gastrointestinal haemorrhagewith long term use of aspirin:meta-analysis[J]. BMJ, 2000, 321(7270): 1183-1187. DOI:10.1136/bmj.321.7270.1183 |
| [19] |
Sorensen HT, Mellemkjaer L, Blot WJ, et al. Risk of upper gastrointestinal bleeding associated with use of low-dose aspirin[J]. Am J Gastroenterol, 2000, 95(9): 2218-2224. DOI:10.1016/S0002-9270(00)01040-6 |
| [20] |
Huang ES, Strate LL, Ho WW, et al. Long-term useof aspirin and the risk of gastrointestinal bleeding[J]. Am J Med, 2011, 124(5): 426-433. DOI:10.1016/j.amjmed.2010.12.022 |
 2019, Vol. 36
2019, Vol. 36