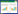文章信息
- 朱家平, 朱李茹
- ZHU Jiaping, ZHU Liru
- 氧化型低密度脂蛋白与急性冠状动脉综合征患者CD4+T细胞Notch1、Notch2表达的相关性研究
- Association among oxidized low density lipoprotein and the expression of Notch1, Notch2 in CD4+ T cells in patients with acute coronary syndrome
- 天津中医药, 2019, 36(9): 865-868
- Tianjin Journal of Traditional Chinese Medicine, 2019, 36(9): 865-868
- http://dx.doi.org/10.11656/j.issn.1672-1519.2019.09.08
-
文章历史
- 收稿日期: 2019-04-17
冠心病是指由于冠状动脉粥样硬化使血管腔狭窄甚至堵塞,导致心肌缺血、缺氧而引起的心脏病,在中医学中属于“胸痹”“心痛”“真心痛”等范畴[1]。中医学对冠心病的治疗积累了丰富的临床经验。目前益气养阴、活血化瘀治疗冠心病的疗效已被包括西医在内的医学界所确认。目前,中药在临床上的应用越来越广泛,其中茶色素治疗冠心病患者能够抑制体内低密度脂蛋白的氧化,降低了患者血浆中氧化型低密度脂蛋白(ox-LDL)的水平[2]。近期研究发现,冠心病患者或动物模型均出现辅助性T细胞(Th)的异常活化,主要是促炎的Th1升高及抗炎的Th2降低,然而出现这种现象的机制尚未阐明[3-5]。ox-LDL是冠心病发生的主要风险因素,ox-LDL在血管内膜上的堆积会诱导内皮细胞炎性反应,导致其分泌炎性因子和趋化因子,进一步引起炎症因子释放和免疫激活[6-7]。有研究报道,ox-LDL可诱导Th1细胞分化[8],而Notch信号传导介导T细胞的分化过程[9]。因此,笔者探讨了ox-LDL与急性冠状动脉综合征(ACS)患者CD4+T细胞Notch1、Notch2表达的相关性。
1 资料及方法 1.1 主要试剂人源ox-LDL(北京协生生物科技有限公司,批号:SY0441);APC标记小鼠抗人Notch1、PE标记小鼠抗人Notch2单抗(Sigma公司);白细胞介素4(IL-4)-PE、干扰素γ(TNF-γ)-PE(Sigma公司);人源ox-LDL ELISA试剂盒(武汉华美生物有限公司,批号:ab14526-65)。
1.2 研究对象收集2016年3月-2017年10月本院确诊的冠心病患者88例,男49例,女39例,平均年龄为(53.64±11.43)岁,其中[ACS患者56例,急性心肌梗死(AMI)患者26例,不稳定型心绞痛(UA)患者30例],稳定型心绞痛(SA)患者32例,另外纳入同期健康体检者30例,男17例,女13例,平均年龄为(54.64±12.63)岁。患者组与对照组之间年龄和性别无统计学差异(P>0.05),具有可比性。同时排除出现感染性疾病、癌症、血液系统疾病、自身免疫性疾病、近期服用非甾体抗炎药或免疫抑制剂的人群。并且每位纳入对象均签署知情同意书。
1.3 血浆ox-LDL水平分析将血浆标本放置室温平衡,按照ELISA试剂盒说明书进行试验。
1.4 流式细胞术分选CD4+ T细胞采用葡聚糖-泛影葡胺密度梯度离心法分离外周单个核细胞[10]。将分离的外周血单个核细胞培养5 h,弃去贴壁细胞,便得到淋巴细胞。调整细胞密度为1×107,加入Percp/cy 5.5标记小鼠抗人CD3、FITC标记小鼠抗人CD4抗体,室温避光孵育0.5 h,PBS清洗2遍,重悬后流式细胞仪分选CD4+T细胞。并采用流式细胞术对Th1、Th2细胞进行计数。
1.5 流式细胞术检测CD4+T细胞Notch表达从健康人群中分离得到CD4+T细胞接种于6孔板,随机将细胞分为4组,及对照组、低、中、高剂量ox-LDL组(40、80、160 mg/L),每组设置3个复孔。共孵育72 h后,磷酸盐缓冲溶液(PBS)清洗2遍,每组细胞再分为两组,分别加入浓度为0.2 g/L的APC标记小鼠抗人Notch1、PE标记小鼠抗人Notch2单抗,室温避光反应0.5 h,PBS清洗后离心、重悬,进行流式细胞术检测Notch1、Notch2表达。
1.6 数据分析计量资料采用SPSS 20.0软件进行分析,计量资料采用均数±标准差(x±s)表示,组间比较采用单因素方差分析,计数资料采用构成比表示,组间比较采用卡方检验,相关性采用Pearson分析,P < 0.05为差异有统计学意义。
2 结果 2.1 各组一般临床资料比较4组研究对象在年龄、性别、高血压、糖尿病、吸烟及HDL-C水平等方面均无统计学差异(P>0.05)。与对照组相比,UA组和AMI组患者TC、TG及LDL-C水平显著升高(P < 0.05),而SA组与对照组相比无统计学差异,UA组与AMI组相比也无统计学差异(P>0.05)。见表 1。
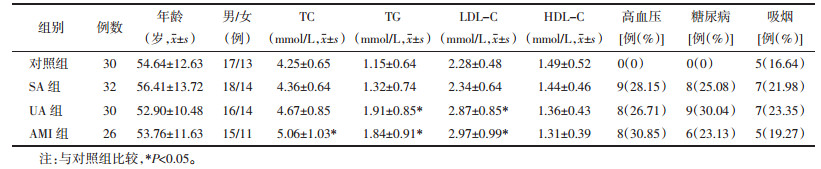
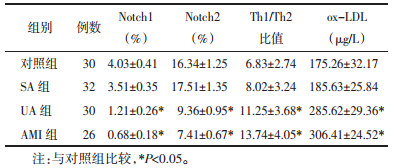
UA组、AMI组CD4+T细胞Notch1、Notch2表达相对于对照组显著降低(P < 0.05),而Th1/Th2比值及ox-LDL水平相对于对照组显著升高(P < 0.05)。CD4+T细胞Notch1和Notch2表达、Th1/Th2比值及ox-LDL水平在SA组和对照组之间相比无明显差异,UA组与AMI组相比也无统计学差异(P>0.05),见表 2。经Pearson相关性分析发现,ACS患者(UA组、AMI组)外周血ox-LDL与Notch1(r=-0.653,P < 0.01)、Notch2(r=-0.468,P < 0.01)表达呈明显负相关,与Th1/Th2比值呈明显正相关(r=0.582,P < 0.01)。见图 1。
|
|
| 图 1 各指标相关性分析 Fig. 1 Correlation analyses of each indicator |
采用ox-LDL刺激流式分选的人外周血CD4+细胞72 h,对照组、低、中、高剂量ox-LDL组中Notch1表达分别为(1.05±0.25)%、(0.84±0.23)%、(0.62±0.17)%及(0.31±0.14)%,与对照组相比,低、中、高剂量ox-LDL组均显著降低(P < 0.05)。除此之外,对照组、低、中、高剂量ox-LDL组中Notch2表达分别为(8.26±1.43)%、(5.34±1.30)%、(3.27±0.85)%及(1.39±0.64)%,与对照组相比,低、中、高剂量ox-LDL组均显著降低(P < 0.05)。见图 2。
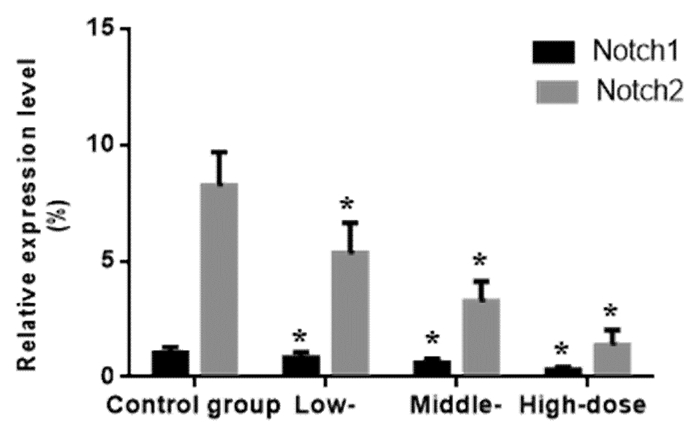
|
| 与对照组比较,*P < 0.05 图 2 ox-LDL对CD4+ T细胞Notch表达的影响(x±s) Fig. 2 Effects of ox-LDL on the expression of Notch in CD4+ cells (x±s) |
冠心病属于多因素的大动脉炎性病变,而炎症反应和免疫应答起着关键性作用。CD4+T细胞依据分泌的细胞因子和功能不同分为Th1和Th2亚群,Th1主要生理作用是诱导细胞免疫和免疫调节。Th2的主要生理作用是促使体液免疫和免疫调节,并且Th1/Th2比例失衡会诱导自身免疫性疾病的发生[11]。本研究用白细胞介素4(IL-4)-PE、干扰素γ(TNF-γ)-PE分别作为Th1和Th2细胞的标志,结果提示ACS患者Th1/Th2比值相对于对照组显著升高。说明ACS患者存在Th1/Th2比例失衡,机体内环境的稳态受到破坏,这可能与ACS患者细胞免疫功能紊乱和细胞介导的免疫病理过程相关。
ox-LDL是导致冠心病发生发展的一个重要因素,由于ox-LDL的过度表达会导致内皮细胞、巨噬细胞及CD4+T淋巴细胞凋亡的发生[12]。ox-LDL在引起动脉粥硬化过程中,会导致斑块不稳定,提出冠心病患者血浆中ox-LDL水平的升高,代表着ACS的出现,并且ox-LDL水平与ACS病情有着密切联系。本研究发现ACS患者ox-LDL水平相对于健康对照组显著升高,早期研究表明ox-LDL能明显诱导巨噬细胞Notch1受体的表达,提示Notch信号通路参与冠心病的发生[13]。ox-LDL作用机制主要通过TLR2/4受体活化巨噬细胞,诱导Notch配体Jagged1上调,产生大量促炎因子。研究发现UA组、SA组CD4+T细胞Notch1、Notch2表达相对于健康对照组显著降低;相关性分析发现ACS患者外周血ox-LDL与Notch1、Notch2表达呈明显负相关,与Th1/Th2比值呈明显正相关。
接着在体外研究了ox-LDL刺激对分离出的CD4+T细胞Notch1、Notch2表达的影响,结果表明低、中、高剂量的ox-LDL均能明显抑制Notch1、Notch2的表达。动物实验发现,Notch2信号可诱导Th2的分化,Notch1/Notch2信号通路可诱导GATA-3和IL-4的上调来促使Th2的分化,而不是作用于IL-4/STAT6信号通路[14]。早期研究也发现中药参参康心能诱导Notch信号通路活化,进而对冠心病气虚血疲证小鼠具有保护作用[15]。由此可推测,参参康心可能是通过促使Notch信号传导,诱导辅助性T细胞向抗炎的Th2细胞分化,机体起着免疫调节作用,进而缓解了冠心病气虚血疲证小鼠的症状。综上所述,ox-LD可抑制Notch1/Notch2的表达来降低Th2的分化,并且Th2与Th1在体内相互作用,抑制Th2分化,便是促使Th1的分化。总之,ox-LDL能明显抑制人外周血CD4+T细胞Notch1、Notch2分子表达,可能与ox-LDL抑制Th2分化而促进Th1异常分化有关,参与冠心病的发生发展。
| [1] |
Poredo P, Jeovnik MK. Markers of preclinical atherosclerosis and their clinical relevance[J]. Vasa, 2015, 44(4): 247-56. DOI:10.1024/0301-1526/a000439 |
| [2] |
杜荣增, 任雨笙, 王咏梅, 等. 茶色素对冠心病患者血浆总抗氧化能力和氧化型低密度脂蛋白水平的影响[J]. 中国动脉硬化杂志, 2003, 11(4): 369-370. DOI:10.3969/j.issn.1007-3949.2003.04.027 |
| [3] |
Wu S, Wang LL, Cai HH, et al. Effects of mild moxibustion on imbalance of Th1/Th2 in rabbits with atherosclerosis and its regulating rules[J]. Zhongguo Zhen Jiu, 2014, 34(2): 163-167. |
| [4] |
Colin S, Chinetti-Gbaguidi G, Staels B. Macrophage phenotypes in atherosclerosis[J]. Immunol Rev, 2014, 262(1): 153-166. |
| [5] |
Vinson A, Curran JE, Johnson MP, et al. Genetical genomics of Th1 and Th2 immune response in a baboon model of atherosclerosis risk factors[J]. Atherosclerosis, 2011, 217(2): 387-394. DOI:10.1016/j.atherosclerosis.2011.06.015 |
| [6] |
Bekkering S, Quintin J, Joosten LA, et al. Oxidized low-density lipoprotein induces long-term proinflammatory cytokine production and foam cell formation via epigenetic reprogramming of monocytes[J]. Arterioscler Thromb Vasc Biol, 2014, 34(8): 1731-1738. DOI:10.1161/ATVBAHA.114.303887 |
| [7] |
Obradovic MM, Trpkovic A, Bajic V, et al. Interrelatedness between C-reactive protein and oxidized low-density lipoprotein[J]. Clin Chem Lab Med, 2015, 53(1): 29-34. |
| [8] |
Newton AH, Benedict SH. Low density lipoprotein promotes human naive T cell differentiation to Th1 cells[J]. Hum Immunol, 2014, 75(7): 621-628. DOI:10.1016/j.humimm.2014.04.017 |
| [9] |
Neumann K, Rudolph C, Neumann C, et al. Liver sinusoidal endothelial cells induce immunosuppressive IL-10-producing Th1 cells via the Notch pathway[J]. Eur J Immunol, 2015, 45(7): 2008-2016. DOI:10.1002/eji.201445346 |
| [10] |
杨敬宁, 郭阳, 陈俊, 等. 氧化低密度脂蛋白抑制人外周血CD4+ T细胞Notch1、Notch2的表达[J]. 湖北医药学院学报, 2016, 35(5): 431-435. |
| [11] |
Ekman B, Alstrand N, Bachrach-Lindström M, et al. Altered chemokine Th1/Th2 balance in Addison's disease:relationship with hydrocortisone dosing and quality of life[J]. Horm Metab Res, 2014, 46(1): 48-53. |
| [12] |
Meier P, Spertini F, Blanc E, et al. Oxidized low-density lipoproteins activate CD4+ T cell apoptosis in patients with end-stage renal disease through Fas engagement[J]. J Am Soc Nephrol, 2007, 18(1): 331-342. DOI:10.1681/ASN.2006050514 |
| [13] |
付文波, 李斌, 龚志刚, 等. 氧化低密度脂蛋白致损人单核细胞白血病细胞株源性巨噬细胞Notch信号的表达[J]. 中国心脏起搏与心电生理杂志, 2013, 27(5): 427-430. |
| [14] |
Sakata-Yanagimoto M, Chiba S. Notch2 and immune function[J]. Curr Top Microbiol Immunol, 2012(360): 151-161. |
| [15] |
金永兰, 刘喜平, 张炜, 等. 参参康心胶囊对冠心病气虚血疲证小鼠Notch1和Jagged1表达的影响[J]. 卫生职业教育, 2017, 35(1): 107-110. |
 2019, Vol. 36
2019, Vol. 36