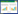文章信息
- 朱津丽, 张硕, 张莹, 李小江, 贾英杰
- ZHU Jinli, ZHANG Shuo, ZHANG Ying, LI Xiaojiang, JIA Yingjie
- 消岩汤联合化疗对晚期非小细胞肺癌患者外周血VEGF的影响及其临床疗效
- Effect and clinical efficacy of Xiaoyan Decoction combined with chemotherapy on peripheral blood vascular endothelial growth factor in patients with advanced non-small cell lung cancer
- 天津中医药, 2020, 37(1): 38-43
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(1): 38-43
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.01.09
-
文章历史
- 收稿日期: 2019-10-03
2. 天津中医药大学第二附属医院, 天津 300250
肺癌是全球最常见的恶性肿瘤之一,并且已成为多数国家肿瘤病死的主要原因,其中非小细胞肺癌(NSCLC)在肺癌中所占比例较高,多数患者在确诊时已是晚期,失去手术根治的机会[1-2],治疗以化疗、放疗、靶向治疗、免疫治疗等姑息性对症治疗为主,但因晚期患者体质状态较差、不能耐受毒副作用而终止治疗。中药在肿瘤治疗领域中发挥着独特的功效,随着对抗肿瘤新生血管形成机制的深入研究和肿瘤血管生成抑制剂的开发,许多研究者发现,部分中药或其有效成分能够在抑制肿瘤新生血管生成方面发挥其抗肿瘤的作用。并且中药配合放化疗治疗,可以起到减轻患者骨髓抑制及消化道功能紊乱等毒副反应的作用。
消岩汤为天津中医药大学第一附属医院肿瘤科贾英杰教授根据多年临床经验所拟的经验方,其具有扶正解毒祛瘀功效,前期研究证实该方对气虚毒瘀型NSCLC患者具有显著疗效,可以提高患者生存质量和化疗完成率,并缓解化疗所产生的不良反应,临床联合化疗应用疗效显著[3-7],同时,由于中药的多靶点作用,其可以提高患者的免疫功能、诱导肿瘤细胞多药耐药的发生,并且可以通过调控细胞凋亡、调控细胞自噬,并与化疗、靶向药物协同在抗击肿瘤中发挥了重要作用[8]。
1 临床资料 1.1 研究对象研究中观察病例共60例,均为2017年1-12月在天津中医药大学第一附属医院肿瘤科住院治疗的晚期NSCLC患者。其中男38例(63.3%),女22例(36.7%),患者年龄在39~73岁,平均年龄59.87岁。
1.2 晚期NSCLC诊断标准西医诊断参照《临床诊疗指南·肿瘤分册》中NSCLC的诊断标准,必须有明确的组织病理学或细胞病理学依据。西医分期标准:所有患者均为NSCLC临床Ⅲb、Ⅳ患者[参照国际抗癌联盟(UICC)2009版肺癌TNM分期]。
1.3 气虚毒瘀型肺癌中医辨证标准主要参考中医证候诊断(辨证)标准、中国中西医结合研究会老年病专业委员会制定的《虚证辨证标准》、中国中西医结合研究会血瘀证专业委员会制定的《血瘀证诊断标准》、国家中医药管理局发布的《中医病证诊断疗效标准》《中医证候辨证规范》。气虚证候:神疲懒言,倦怠乏力,语声低微,舌体胖大,脉虚无力。热毒证候:发热面赤,咳吐脓血,疮疡疔痈,舌红苔黄,脉数洪大。血瘀证候:舌质紫暗或舌体瘀斑、瘀点,脉络瘀血(诸如口唇、齿龈、爪甲紫暗,皮下瘀斑,或腹部青筋外露),病理性肿块,刺痛、痛有定处、拒按,肌肤甲错,肢体麻木,脉涩、无脉或沉弦、弦迟。以上每一证候需至少兼具备1项,气虚毒瘀证诊断方可确立。
1.4 病例选择标准 1.4.1 纳入病例标准1)符合NSCLC西医诊断标准与分期标准,经病理或细胞学诊断的Ⅲb、Ⅳ期NSCLC患者。2)有客观可测量的病灶。3)无手术适应症或不愿意行手术治疗者,不愿接受放疗者。4)一般状况Karnofsky评分在60分以上者,预计生存期3个月以上,年龄18~75岁。5)心、肝、肾、骨髓功能功能正常者。6)患者愿意接受本方案治疗、能按医嘱坚持服药、依从性好者。7)符合气虚毒瘀型肺癌中医辨证标准。8)均未接受过化疗或末次化疗结束≥6个月者。
1.4.2 排除病例标准1)妊娠或哺乳期妇女。2)仅有不可测量的病灶如胸水、癌性淋巴管炎、骨转移。3)未控制及无自知力的脑或脑膜转移。4)严重不可控制的感染。5)主要器官功能衰竭,如失代偿的心肺功能衰竭等。6)同时合并有未治愈的第2个原发肿瘤。
1.4.3 剔除病例标准1)发现合并使用影响疗效判定的其他治疗药物者。2)发现影响疗效观察的试验性治疗或其他疾病者。3)发现观察项目不完全,不能评价疗效者。4)入组后患者拒绝治疗或疗程未结束退出试验、失访或死亡的病例。
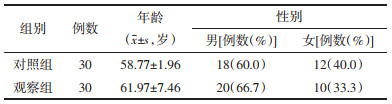
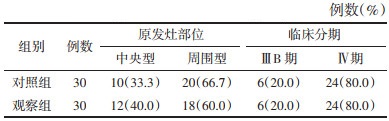
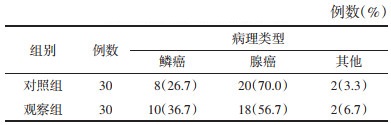
1.5 分组将符合纳入病例标准的患者采用完全随机化方法,通过SAS软件PROC PLAN过程得出随机数字,按1:1分为对照组(单纯化疗组)、观察组(消岩汤联合化疗组),每组30例,两组的性别、年龄、原发灶部位、病理类型、分期及卡式评分经统计学处理无统计学差异(P > 0.05),组间具有可比性。见表 1-4。
|
|
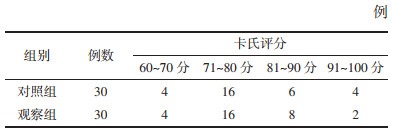
|
予以单纯化疗,化疗方案选择GP方案[吉西他滨1 000 mg/m2,30~60 mg,第1、8天,顺铂(DDP)25 mg/m2,第1~3天],每21天重复1次,直至2个化疗周期结束。
2.2 观察组化疗方案同化疗组,于化疗前7 d开始口服消岩汤,150 mL/次,每日2次(早晚8:00服用),伴随2个化疗周期。消岩汤药物组成:黄芪、太子参、夏枯草、生牡蛎、白花蛇舌草、姜黄、郁金、蜂房等。
2.3 疗程化疗期间两组均给予相同的水化、止吐等对症支持治疗。3~4周为1个治疗周期,每个治疗周期前检查血常规、肝肾功能和心电图,在正常范围则行下一周期化疗,否则延期化疗。两组均治疗2个周期以上,2个周期后进行全面评价。
3 观察指标及疗效判定标准 3.1 瘤体变化依据《实体瘤疗效评定最新指南》的疗效标准(2009年RECIST1.1版)。完全缓解(CR):所有可见病变完全消失并至少维持在4周以上。部分缓解(PR):肿瘤病灶的最大横径及其最大垂直径的乘积减少50%以上,并维持4周以上。稳定(SD):肿瘤病灶的两径乘积缩小 < 50%,或增大 < 25%,无新病灶出现。进展(PD):肿瘤病灶的两径乘积增大 > 25%,或出现新病灶。
总缓解率=CR+PR。
3.2 卡氏评分评价方法采用Karnofsky评分标准,于治疗周期前后综合评价1次。显效:治疗后比治疗前提高20分以上;有效:治疗后比治疗前提高10分以上;稳定:治疗后比治疗前提高不足10分或没有变化;无效:治疗后比治疗前下降。
3.3 临床症状积分评价采用肺癌临床症状分级表中医证的记分法,每一个症状由轻至重依次为1、2、3、4、5分,观察临床症状,根据积分法计算疗效指数,判定临床症状疗效。临床症状积分=(治疗前评分-治疗后评分)/治疗前评分×100%。显效:症状消失,或症状积分减少≥75%。有效:症状减轻,50%≤症状积分减少 < 75%。稳定:25%≤症状积分减少 < 50%。无效:症状无减轻或症状积分减少 < 25%。
3.4 血清血管内皮生长因子(VEGF)含量检测两组治疗前后血清VEGF水平。空腹抽静脉血5 mL,立即分离血清,置-20 ℃冰箱保存待用,采用酶联免疫吸附检测(ELISA)法测定,试剂由美国GB公司生产。
3.5 骨髓抑制、肝肾功能等毒副反应指标评价按世界卫生组织(WHO)制定的抗肿瘤药急性和亚急性毒副反应的表现和分级标准,记录于观察表中,自治疗首日,每周复查1次血常规、肝肾功能。治疗2个周期后综合评价1次。
4 统计学方法所有数据均采用SPSS 24.0统计软件进行统计学处理。计量资料以均数±标准差(x±s)表示,组内治疗前后比较采用配对t检验,组间比较采用两独立样本t检验;计数资料采用构成比或率表示,组间比较采用卡方检验;等级资料组间比较采用秩和检验,P < 0.05为差异具有统计学意义。
5 治疗结果 5.1 两组患者近期客观疗效比较治疗后两组患者均按时完成疗程,无病例脱落。结果见表 5。两组患者近期客观疗效比较根据RECIST实体瘤疗效评价体系进行评定,观察组和对照组患者经治疗后CR、PR、SD、PD病例分别为:2、12、10、6例和2、8、12、8例,疾病控制率(CR+PR+SD)分别为80%和73.3%,经统计学分析,两组在客观疗效上无统计学差异(P > 0.05)。
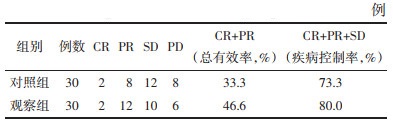
|
结果见表 6。两组患者治疗前卡式评分分布差异无统计学意义,具有可比性。观察组患者治疗后卡式评分较治疗前明显升高,差异具有统计学意义,治疗后观察组的卡式评分明显高于对照组,差异有统计学意义(P < 0.01)。

|
结果见表 7。两组在治疗前无统计学差异,具有可比性。治疗后两组患者主要临床症状均有好转,积分下降。两组临床症状积分改善率(显效+有效)分别为:93.3%、60.0%。治疗后观察组患者临床症状明显优于对照组,差异具有统计学意义(P < 0.05)。
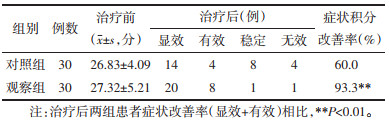
|
结果见表 8。两组患者治疗前血清VEGF比较差异无统计学意义,具有可比性。两组治疗后血清VEGF水平均低于治疗前,差异具有统计学意义;观察组治疗后VEGF水平低于对照组治疗后,差异有统计学意义(P < 0.01)。观察组VEGF治疗前后差值显著高于对照组,差异具有统计学意义(P < 0.05)。说明消岩汤具有抑制肺癌血清VEGF的作用,提示消岩汤可能具有抑制肺癌新生血管形成的作用。
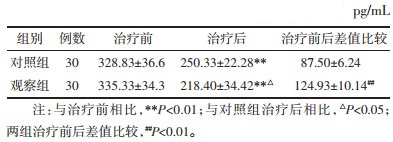
|
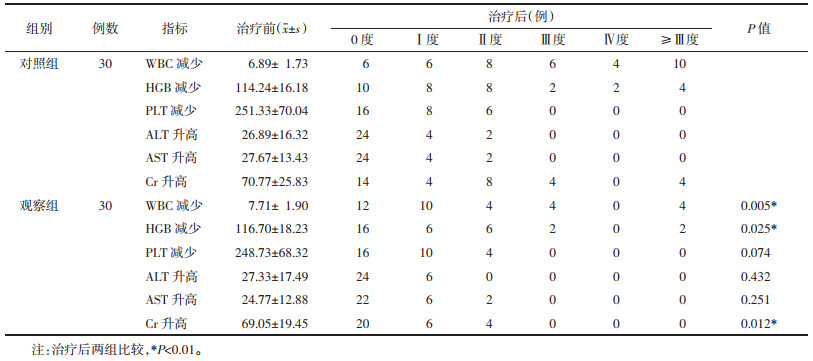
结果见表 9。根据WHO制定的《抗癌药物急性和亚急性反应分度标准》进行判定,分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ度。本研究显示所有入组患者主要毒性反应为白细胞(WBC)减少、血红蛋白(HGB)减少、血小板(PLT)减少、肝肾功能异常等,但均不严重,Ⅲ、Ⅳ度的毒性反应较少见。两组患者治疗后相比,在WBC减少、HGB减少、肾功能异常肌酐(Cr),3个方面的差异具有统计学意义,而在肝功能[丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)]及PLT减少方面,两组差异无统计学意义。说明消岩汤可缓解化疗后骨髓抑制的发生,减轻DDP所致的肾功能异常。
|
消岩汤为天津中医药大学第一附属医院肿瘤科贾英杰主任的经验方,本方主要用于治疗气虚毒瘀型NSCLC。该方主要由黄芪、太子参、姜黄、郁金、夏枯草、生牡蛎、白花蛇舌草、蜂房组成。消岩汤全方祛邪而不伤正,具有攻补兼施,全面调节身体内环境的平衡,重建机体抗肿瘤的能力。方中黄芪、太子滋阴益气祛邪共为君药;夏枯草、生牡蛎、白花蛇舌草相伍清热解毒、软坚散结,共为臣药;姜黄、郁金行气解郁、活血祛瘀,共为佐药;同时配伍蜂房以搜剔络脉中之瘀毒[9-10]。本研究选择消岩汤联合NP(长春瑞滨+DDP)或GP(吉西他滨+DDP)化疗方案治疗晚期NSCLC,与对照组单纯化疗相比,其在改善患者临床症状、抑制肿瘤血管生成、防止骨髓抑制的发生及肝肾毒副作用方面均具有显著优势。通过临床试验发现,两组患者疾病控率及总有效率相似,CR、PR、SD、PD比较,未见明显差异,说明治疗后两组患者在瘤体变化方面基本一致。治疗组患者在治疗后卡氏评分明显高于治疗前,而对照组患者治疗前后卡氏评分并未出现明显变化,提示消岩汤联合化疗可以显著提高患者的生活质量。治疗后,两组患者临床症状改善率均较治疗前有所改善,与治疗前相比,变化显著,差异具有统计学意义,而治疗后观察组患者临床症状改善情况明显优于对照组,说明中药消岩汤可显著缓解临床症状。观察两组患者治疗前后外周血VEGF含量变化,可见观察组患者治疗后外周血VEGF较治疗前明显减低,差异具有统计学意义;对照组治疗前后相比,差异不具有统计学意义,两组治疗前后外周血VEGF含量差值的比较具有统计学差异。说明观察组明显抑制了外周血VEGF的表达,抑制了肿瘤血管的生成,与对照组相比差异具有统计学意义。
此外,化疗药物主要是针对生长活跃的细胞,除恶性肿瘤外,骨髓造血干细胞、消化道黏膜、皮肤及其附属器官、子宫内膜和卵巢等器官或组织的细胞更新亦较快,这是化疗药物导致相应不良反应的组织学基础。临床上骨髓抑制的发生较为常见,也是导致许多患者不能耐受的一个重要因素。中医学认为放化疗导致的骨髓抑制是由于损伤脏腑功能,气血失调所致,属于“虚劳”“血虚”的范畴,常表现为气血两虚[11],加之肿瘤患者平素毒邪内蕴,毒瘀互结,致使气血损伤,脾胃失调,肝肾亏损等。故治疗上益气养血、活血化瘀、解毒清热。本试验化疗方案均为含铂双联方案,而铂类药物所产生的肾毒性是其主要的剂量限制性毒性[12]。DDP肾毒性其发生率及严重程度与顺铂的剂量呈正相关[13]。中医认为DDP之毒壅积于肾,留聚膀胱,治不及时或治未得法,则必耗伤肾气,“精气夺则虚”,肾气不固,肾精失藏,开合失司,乃至阴精外泄,浊邪内聚。DDP肾损害的本质是肾的精气不足,肾气不固。“久病者多肾虚”,肿瘤患者大多为正虚邪盛。在观察患者毒副反应方面,可以看出,两组患者治疗前后在WBC减少、HGB减少、肾功能异常,3个方面的差异具有统计学意义,而在肝功能方面,两组差异无统计学意义。说明中药消岩汤可以有效地防止骨髓抑制的发生,同时,保护肾脏功能,缓解了铂类药物所致的肾毒性,同时未造成肝功能的异常变化,提示消岩汤联合化疗的方法,安全有效。但是本试验也存在着许多不足之处,比如临床观察时间较短,未能进行长期的疗效及生存时间方面的随访研究。同时所观察的样本例数较小,可能对于临床疗效的预判存在一定的局限性。
本研究临床观察结果显示,消岩汤联合化疗能够稳定瘤体,提高患者的卡式评分,可以明显改善患者生活质量,并且可以显著降低外周血VEGF的含量,对肿瘤血管生成有一定程度的抑制作用。同时,消岩汤能够明显降低化疗药物的毒副作用,减轻DDP所导致的肾功能异常,尤其是在WBC减少、HGB减少等血液毒性的改善方面有良好的临床效果。
| [1] |
蔡勇, 白冲. 适形放疗联合吉非替尼同步治疗局部晚期老年非小细胞肺癌的疗效[J]. 中国老年学杂志, 2013, 33(10): 2445-2446. CAI Y, BAI C. The effect of conformal radiotherapy combined with gefitinib on local advanced non-small cell lung cancer[J]. Chinese Journal of Gerontology, 2013, 33(10): 2445-2446. DOI:10.3969/j.issn.1005-9202.2013.10.117 |
| [2] |
罗勤利, 李琴. 导致肺癌化疗患者发生静脉血栓栓塞症的相关因素及其治疗[J]. 实用癌症杂志, 2015, 8(2): 314-316. LUO Q L, LI Q. Study on the related factors and treatment of incidence of venous thromboembolism in lung cancer[J]. The Practical Journal of Cancer, 2015, 8(2): 314-316. DOI:10.3969/j.issn.1001-5930.2015.02.048 |
| [3] |
贾英杰, 李小江, 杨佩颖, 等. 消岩汤对减轻气虚毒瘀型非小细胞肺癌化疗毒副反应时效关系的临床研究[J]. 天津中医药大学学报, 2010, 29(4): 183-185. JIA Y J, LI X J, YANG P Y, et al. Research on time-effect relationship of adverse reaction of Xiao Yan Tang in treating patients with qi deficiency and toxic stasis[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2010, 29(4): 183-185. |
| [4] |
李小江, 姜珊, 郭姗琦, 等. 阿帕替尼联合消岩汤治疗晚期非鳞非小细胞肺癌临床疗效观察[J]. 中国肿瘤临床, 2017, 44(14): 701-705. LI X J, JIANG S, GUO S Q, et al. Clinical research on apatinib combined with Xiaoyan Decoction for the treatment of non-squamous non-squamous non-small cell lung cancer[J]. Chinese Journal of Clinical Oncology, 2017, 44(14): 701-705. DOI:10.3969/j.issn.1000-8179.2017.14.609 |
| [5] |
李小江, 张莹, 杨佩颖, 等. 消岩汤对肺癌A549细胞及肺癌干细胞迁移及侵袭的影响[J]. 中草药, 2018, 49(4): 870-873. LI X J, ZHANG Y, YANG P Y, et al. Effect of Xiaoyan Decoction on migration and invasion of A549 cells and SP cells in lung cancer[J]. Chinese Traditional and Herbal Drugs, 2018, 49(4): 870-873. |
| [6] |
张欣, 贾英杰, 杨佩颖, 等. 消岩汤含药血清介导下Survivin siRNA对人肺腺癌A549细胞增殖及凋亡的影响[J]. 天津中医药, 2017, 34(2): 113-116. ZHANG X, JIA Y J, YANG P Y, et al. Effect of Survivin siRNA on human lung adenocarcinoma A549 cell proliferation and apoptosis mediated by drug-containing serum of Xiaoyan decoction[J]. Tianjin Journal of Traditional Chinese Medicine, 2017, 34(2): 113-116. |
| [7] |
张欣, 贾英杰, 杨佩颖. 消岩汤对肺腺癌A549实体荷瘤小鼠肿瘤细胞凋亡干预机制的研究[J]. 中草药, 2017, 48(11): 2261-2265. ZHANG X, JIA Y J, YANG P Y. Research on intervention mechanism of Xiaoyan Decoction on apoptosis of lung adenocarcinoma A549 cells in tumor-burdened mice[J]. Chinese Traditional and Herbal Drugs, 2017, 48(11): 2261-2265. |
| [8] |
晏子, 陈音. 中医药抗肿瘤作用研究进展[J]. 世界最新医学信息文摘, 2019, 19(8): 97-98. YAN Z, CHEN Y. Progress in the study of traditional chinese medicine in the treatment of malignant tumors[J]. World Latest Medicine Information, 2019, 19(8): 97-98. |
| [9] |
朱津丽, 李小江, 贾英杰. 贾英杰教授运用"扶正解毒祛瘀法"在非小细胞肺癌维持期的治疗经验[J]. 天津中医药, 2019, 36(8): 739-742. ZHU J L, LI X J, JIA Y J. Professor JIA Yingjie's experience in treating non-small cell lung cancer during the maintenance period with the method of "strengthening the body, detoxifying toxin and removing blood stasis"[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(8): 739-742. |
| [10] |
朱津丽, 贾英杰, 张硕, 等. 消岩汤联合大株红景天注射液改善恶性肿瘤患者血液高凝状态的临床研究[J]. 天津中医药, 2018, 35(11): 813-815. ZHU J L, JIA Y J, ZHANG S, et al. Clinical study on Xiaoyan decoction combined with Sofren injection in improving hypercoagulability of malignant tumor patients[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(11): 813-815. DOI:10.11656/j.issn.1672-1519.2018.11.04 |
| [11] |
蔡雅丽, 王彩琴, 李波. 六君子汤加味治疗化疗致白细胞减少的疗效观察[J]. 四川中医, 2002, 20(11): 23-24. CAI Y L, WANG C Q, LI B. Observation on the effect of Liujunzi Decoction on leukopenia induced by chemotherapy[J]. Sichuan Journal of Traditional Chinese Medicine, 2002, 20(11): 23-24. DOI:10.3969/j.issn.1000-3649.2002.11.014 |
| [12] |
谢嵩.抗肿瘤药物不良反应调查与分析[D].济南: 山东大学, 2008: 42. XIE S. Investigation and analysis of adverse reactions to antitumor drugs[D]. Jinan: Shandong University, 2008: 42. |
| [13] |
孙家跃. 顺铂肾毒性机制及防护方法的研究进展[J]. 中国医院用药评价与分析, 2010, 10(5): 478-480. SUN J Y. Advances in the mechanism of renal toxicity of cisplatin and its protective methods[J]. Evaluation and Analysis of Drug-Use in Hospitals of China, 2010, 10(5): 478-480. |
2. The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China
 2020, Vol. 37
2020, Vol. 37