文章信息
- 李章青, 向楠, 周广文, 张麟, 张妍, 谭张奎, 黄诗怡
- LI Zhangqing, XIANG Nan, ZHOU Guangwen, ZHANG Lin, ZHANG Yan, TAN Zhangkui, HUANG Shiyi
- 补肾化痰方影响去势骨质疏松大鼠Leptin及β2-AR表达的实验研究
- Experimental study of Bushen Huatan Recipe on Leptin and β2-AR expression in castration osteoprosis rats
- 天津中医药, 2020, 37(1): 87-92
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(1): 87-92
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.01.19
-
文章历史
- 收稿日期: 2019-10-27
2. 武汉市中西医结合医院, 武汉市第一医院, 武汉 430022
绝经后骨质疏松症是一种由于女性绝经后雌激素水平急剧下降,导致骨重建动态平衡被打破,破骨细胞的骨吸收速度大于成骨细胞的骨形成速度,使得骨丢失加快的全身性代谢性疾病[1]。此外,研究显示雌激素减少与脂代谢异常存在密切关系[2]。学者们发现,瘦素(Leptin)具有广泛的生物学效应,参与脂代谢与骨代谢的过程,并起到至关重要的作用[3]。雌激素的水平也被证实对Leptin有影响[4]。因此,本实验以Leptin为切入点,在建立去势骨质疏松大鼠模型基础上,通过Leptin对交感神经系统β2肾上腺素能受体(β2-AR)的影响,进一步明确补肾化痰方防治绝经后骨质疏松症的作用机制。
1 材料与方法 1.1 实验材料 1.1.1 药物制备补肾化痰方(菟丝子30 g,淫羊藿10 g,补骨脂15 g,全瓜蒌15 g,红曲12 g,山楂20 g),并在本院制剂室煎煮浓缩,生药含量为0.94 g/mL[5],存于4 ℃冰箱备用。阳性对照药:替勃龙片(利维爱,H20051085),阿托伐他汀片(阿乐,H19990258)。
1.1.2 实验动物6月龄SPF级未孕雌性SD大鼠75只,体质量270~300 g,由湖北省赤壁市实验中心提供,动物许可证号(鄂)42000600017470。在湖北中医药大学动物实验中心饲养,所有动物饲养在恒温(22~24 ℃)、恒湿(50%~60%)、12/12 h循环光照条件下,自由饮水、进食。定期更换垫料,保持鼠笼清洁干净,排除环境等外界因素对实验结果的影响。
1.1.3 实验试剂酶联免疫吸附(ELISA)试剂盒购于武汉伊莱瑞特生物科技有限公司,大鼠Leptin试剂盒(E-EL-R0582c)、雌二醇(E2)试剂盒(E-EL-0065c);总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)测定均采用试剂盒,购于长春汇力生物技术有限公司;大鼠Leptin、β2-AR引物合成购于广州擎科生物科技有限公司。
1.1.4 实验仪器微计算机断层扫描技术(Micro-CT,skyscan 1176)、微型高速离心机(Labnet)、全自动生化分析仪(Rayto)、全自动酶标仪(Thermoscientific)、实时荧光定量聚合酶链反应(PCR)仪(ABI7900/illumina eco)、PCR仪(东胜创新生物科技有限公司)。
1.2 方法 1.2.1 建立模型与分组大鼠适应性喂养1周,随机分为假手术组、模型组、补肾化痰组、利维爱组、阿托伐他汀组,每组15只,假手术组保留卵巢,仅切除卵巢周围同等质量的脂肪组织,分层缝合伤口;其他各组行双侧卵巢切除术。经腹腔注射10%水合氯醛(30 mg/kg)麻醉,大鼠俯卧位备皮消毒,从背侧正中切口,找到卵巢,结扎摘除双侧卵巢组织后缝合。术后肌注青霉素4万U/(只·d)[6],连续3 d,观察大鼠伤口感染情况及精神状况,第5周开始灌胃给药。根据人类与动物同类药物等效剂量的换算,补肾化痰组0.94 g/kg,利维爱组0.23 mg/kg[7],阿托伐他汀组0.92 mg/kg灌胃给药,模型组和假手术组灌以2 mL生理盐水,每日1次,连续给药8周。定期喂食及更换垫料,保持环境清洁干净。
1.2.2 标本采集及生化检测最后1次灌胃后,禁食24 h,用水合氯醛腹腔麻醉处死,采集右心室新鲜血液。将收集的血液置于抗凝管中,于4 ℃冻存待用。分离大鼠股骨、胫骨周围软组织,将骨组织置于EP管中,存入-80 ℃冰箱中备用。全自动生化仪测定血清脂代谢指标,ELISA测定血清Leptin、E2浓度,在450 nm波长下用酶标仪测量各孔光密度(A值),绘制标准曲线,计算实际浓度。
1.2.3 Micro-CT检测骨密度取出冻存的新鲜标本右侧股骨,使用比利时产skyscan 1176型显微骨密度检测仪扫描右侧股骨远端测定骨量。
1.2.4 实时荧光定量PCR检测观察Leptin mRNA、β2-AR mRNA将新鲜冰冻骨组织加入1mL Trizol试剂,用匀浆器研磨成浆,经裂解、洗涤、沉淀后提取RNA,然后进行逆转录cDNA,逆转录反应体系为20 μL,反应条件为:25 ℃ 5 min,50 ℃ 15 min,85 ℃ 5 min,4 ℃ 10 min,循环1次,对cDNA模板进行扩增(扩增引物见表 1)。扩增后进行实时荧光定量PCR检测,反应体系(共20 μL)为:cDNA 4 μL,Forward Primer 0.4 μL,Reverse Primer 0.4 μL,SYBR Green Mix 10 μL,H2O 5.2 μL。PCR反应条件:95 ℃预变性10 min;95 ℃变性30 s,60 ℃退火30 s,循环40次。绘制溶解曲线,以β-actin的mRNA为参照,用2-ΔΔCT计算Leptin mRNA、β2-AR mRNA的相对表达量。
运用SPSS 23.0进行分析,实验结果以均数±标准差(x±s)表示,组间两两比较采用S-N-K检验,P < 0.05表示差异具有统计学意义。
2 结果 2.1 大鼠基本情况观察大鼠造模完成3 h后苏醒,可正常饮水进食。24 h后观察伤口无渗出红肿,能自由活动,72 h后伤口好转,无感染迹象。1周后大鼠伤口痊愈,缝线掉落。实验灌胃过程中,模型组有1只死亡,补肾化痰组有2只死亡,3只大鼠均因药液插入气管窒息死亡。
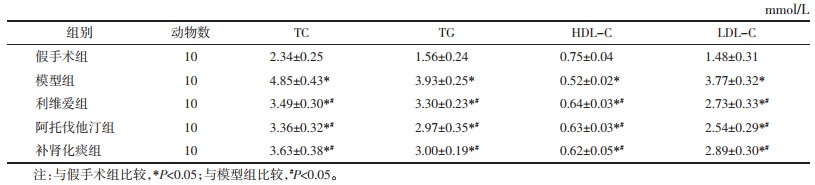
2.2 各组大鼠的骨密度(BMD)及血清指标与假手术组比较,模型组的BMD降低(P < 0.05),说明去势骨质疏松症模型建立成功。治疗8周后,与假手术组比较,利维爱组、阿托伐他汀组及补肾化痰组的BMD升高(P < 0.05),说明补肾化痰方、利维爱、阿托伐他汀均具有提高去势骨质疏松大鼠的BMD、减少骨流失的作用。与假手术组比较,模型组、利维爱组、阿托伐他汀组、补肾化痰组中血清Leptin、E2含量降低(P < 0.05);与模型组比较,利维爱组、阿托伐他汀组、补肾化痰组中血清Leptin、E2含量升高(P < 0.05),补肾化痰组升高E2浓度优于利维爱组,但补肾化痰组、利维爱组、阿托伐他汀组3组间比较无统计学差异(P > 0.05)。见表 2。
|
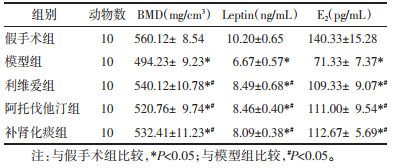
全自动生化仪检测结果显示,与假手术组比较,模型组、利维爱组、阿托伐他汀组、补肾化痰组TC、TG、LDL-C水平升高,HDL-C水平下降,差异具有统计学意义(P < 0.05);与模型组比较,利维爱组、阿托伐他汀组、补肾化痰组TC、TG、LDL-C水平下降,HDL-C水平升高,差异具有统计学意义(P < 0.05);与阿托伐他汀组比较,补肾化痰方调节脂代谢水平低于阿托伐他汀组,但差异无统学意义(P > 0.05)。见表 3。
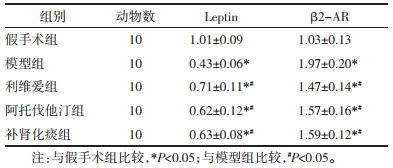
各组大鼠股骨中Leptin mRNA和β2-AR mRNA的表达见表 4。与假手术组比较,模型组、利维爱组、阿托伐他汀组、补肾化痰组大鼠Leptin mRNA相对表达量降低,β2-AR mRNA相对表达量增加,差异具有统计学意义(P < 0.05);与模型组比较,利维爱组、阿托伐他汀组、补肾化痰组大鼠Leptin mRNA相对表达量显著增加,β2-AR mRNA相对表达量显著降低,且差异具有统计学意义(P < 0.05);补肾化痰组Leptin mRNA相对表达量高于阿托伐他汀组,但差异无统计学意义(P > 0.05)。
|
绝经后骨质疏松症多与雌激素水平下降有关,中医将其归属于“骨痿”“骨痹”等范畴,其病机多责之于肾,故一直以来补肾作为中医防治绝经后骨质疏松症的主要研究方向[8-9]。脂代谢紊乱是中医“痰浊”的物质基础,研究者发现脂代谢紊乱与绝经后骨质疏松也存在密切的关系[10]。因此,笔者的导师向楠教授根据自己的临床观察,结合现代研究以及中医基础理论知识,提出了“痰浊也是导致绝经后骨质疏松症的重要致病因素”,制定了补肾化痰新治则,并融合《本草纲目》补骨脂丸与《丹溪心法》黄瓜蒌丸加减而成补肾化痰方,在补肾的基础上,从“痰”论治绝经后骨质疏松症[11]。
西医治疗绝经后骨质疏松症会予以补充雌激素,但长期使用会增加患肿瘤风险[12],限制了临床的推广应用,故探索中医药防治绝经后骨质疏松症成为新的热点。本课题组研究的补肾化痰方为向楠教授临床使用的基础处方,该方由6味中药组成,菟丝子为君药,滋补肝肾、固精壮骨,淫羊藿、补骨脂两药相合共助菟丝子补肾填精、强腰壮骨之功,全瓜蒌清热化痰,山楂善于消食化积,红曲长于健脾消食。全方共奏补肾化痰,强精壮骨之功。药理学研究发现,菟丝子、淫羊藿、补骨脂具有类雌激素样作用及抗骨质疏松作用[13-14]。全瓜蒌、山楂、红曲具有促进脂代谢、降糖降脂、调节免疫等药理作用[15-17]。前期研究中发现补肾化痰方可促进骨髓间充质干细胞成骨分化,抑制其成脂分化,影响钙磷代谢,促进骨矿化,防治骨质疏松症[18-20]。本次实验在前期研究基础上进一步探索补肾化痰方通过影响Leptin介导的交感神经系统β2-AR的表达水平来防治绝经后骨质疏松症的机制。
前期实验分组发现补肾化痰方低、高剂量组对BMD及相关检测指标差异无统计学意义[7],故本次研究中未按照浓度依赖性进行分组。利维爱可降低TC及TG,防止脂质沉积,同时补充雌激素,在防治绝经后骨质疏松症疗效显著[21-22]。临床研究发现阿托伐他汀在调节脂代谢的同时可以有效改善患者骨密度水平[23],且有实验表明他汀类药物对骨骼具有积极的生物学效应,能改善骨微结构,增加骨量,促进骨形成[24]。故本次实验以利维爱和阿托伐他汀为阳性对照组,探讨补肾化痰方在调节脂骨代谢方面的疗效。
Leptin是一种由白色脂肪组织分泌的蛋白质类激素,骨髓腔中的脂肪组织也可分泌产生[25],可诱导脂类水解。Leptin在调节骨代谢方面也发挥着日益重要的作用,它主要通过中枢下丘脑-交感神经-β受体途径和外周骨髓基质细胞两种途径进行调节[26]。研究发现,Leptin可增加骨密度并对骨组织具有保护作用,其作用机制与雌激素类似[27]。本次实验结果显示,补肾化痰方能够增加去势骨质疏松大鼠的骨密度,提高血清中Leptin、E2含量,调节脂代谢水平,增加骨组织中Leptin mRNA水平,可减少骨丢失,防治绝经后骨质疏松症。但本次实验中发现补肾化痰组与利维爱组、阿托伐他汀组差异无统计学意义,认为补肾化痰方可同时发挥补充雌激素,调节脂代谢水平的作用,有效治疗绝经后骨质疏松症。
交感神经系统广泛存在于人体的组织器官中,骨和骨膜分布较为丰富,发挥着生物学效应,对骨的调节主要是通过交感神经系统β2肾上腺素能受体来抑制骨形成[26]。Fateme等[28]通过对100多篇文章的回顾性分析总结出交感神经系统的肾上腺素能活性是骨量的负性调节因子。与此同时,交感神经系统也是Leptin中枢调控骨形成的下游媒介,Leptin通过作用于成骨细胞的β2-AR,抑制成骨细胞的增生,降低骨量,最终引起绝经后骨质疏松症的发生[29]。本次结果显示,补肾化痰方能够通过Leptin mRNA的表达水平,来抑制β2-AR mRNA的水平表达,抑制交感神经系统的活性,促进成骨细胞的增殖分化,增加骨量。
因此,通过本次实验研究可以推测出补肾化痰方通过激活Leptin及β2-AR途径,进而补充雌激素,调节脂代谢,促进成骨分化,抑制成脂分化,来防治绝经后骨质疏松症,这是可能的作用机制之一,但是目前只是从实验中得出的推断结论,对于补肾化痰方防治绝经后骨质疏松症的具体机制及临床研究还有待进一步深入探索。
| [1] |
智信, 陈晓, 苏佳灿. 绝经后骨质疏松症发病机制研究进展[J]. 中国骨质疏松杂志, 2018, 24(11): 1510-1513, 1534. ZHI X, CHEN X, SU J C. Advances in research on the mechanism of postmenopausal osteoporosis[J]. Chinese Journal of Osteoporosis, 2018, 24(11): 1510-1513, 1534. DOI:10.3969/j.issn.1006-7108.2018.11.025 |
| [2] |
GAUTVIK K, PREDIGER M, HSU Y H, et al. Disruption of energy metabolism in postmenopausal osteoporosis (PMO):altered fat metabolism and adipokines[J]. Journal of Bone and Mineral Research, 2017, 32(5): S157. |
| [3] |
柏茂盛, 赵建宁, 洪叶. 脂代谢与骨代谢信号通路及与骨代谢相关疾病的关系:理论进展与热点方向[J]. 中国组织工程研究, 2018, 22(20): 3269-3274. BO M S, ZHAO J N, HONG Y. Correlation of the signaling pathways of bone metabolism and lipid metabolism with bone metabolism related diseases:theoretical advance and research direction[J]. Chinese Journal of Tissue Engineering Research, 2018, 22(20): 3269-3274. DOI:10.3969/j.issn.2095-4344.0231 |
| [4] |
RUSSELL T, KENNETH A, AMIDA F, et al. Role of estrogen receptor signaling in skeletal response to leptin in female ob/ob mice[J]. Journal of Endocrinology, 2017, 233(3): 357-367. |
| [5] |
黄淑燕.补肾化痰方对去势骨质疏松大鼠OPG/RANKL/RANK通路影响的研究[D].武汉: 湖北中医药大学, 2017. HUANG S Y. Effect of Bushen Huatan Decoction on OPG/RANKL/RANK signaling pathway in ovariectomized rats with osteoporosis[D]. Wuhan: Hubei University of Chinese Medicine, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10507-1017093751.htm |
| [6] |
李桂锦, 姚新苗. 益骨汤对骨质疏松大鼠成骨细胞相关基因表达的实验研究[J]. 浙江中医杂志, 2018, 53(10): 727-729. LI G J, YAO X M. Experimental study on the expression of osteoblasts in rats with osteoporosis by Yigu Decoction[J]. Zhejiang Journal of Traditional Chinese Medicine, 2018, 53(10): 727-729. DOI:10.3969/j.issn.0411-8421.2018.10.011 |
| [7] |
胡娅, 唐曦, 向楠. 补肾化痰方对去卵巢大鼠骨组织TNF-α和IL-6的影响[J]. 中国实验方剂学杂志, 2014, 20(16): 173-176. HU Y, TANG X, XIANG N. Influence of Bushen Huatan Decoction on TNF-α and IL-6 in ovariectomized rats[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(16): 173-176. |
| [8] |
李建国, 谢兴文, 李宁, 等. 绝经后骨质疏松症的中医脏腑认识及治疗现状[J]. 中国中医基础医学杂志, 2019, 25(3): 410-412, 420. LI J G, XIE X W, LI N, et al. Postmenopausal osteoporosis visceral understanding of traditional Chinese medicine and the reatment status[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2019, 25(3): 410-412, 420. |
| [9] |
张沙, 李红霞, 胡秋生, 等. 中医疗法治疗骨质疏松症的研究概况[J]. 河北中医药学报, 2018, 33(5): 61-64. ZHANG S, LI H X, HU Q S, et al. Survey of research on treatment of osteoporosis with Chinese medicine[J]. Journal of Hebei Traditional Chinese Medicine and Pharmacology, 2018, 33(5): 61-64. |
| [10] |
NA Z, YANG Z, JING L, et al. Low-density lipoprotein receptor deficiency impaired mice osteoblastogenesis in vitro[J]. BioScience Trends, 2017, 11(6): 658. DOI:10.5582/bst.2017.01267 |
| [11] |
周亚娜, 向楠. 从"痰"论治骨质疏松症[J]. 湖北中医杂志, 2013, 35(12): 36-38. ZHOU Y N, XIANG N. Treating osteoporosis from "Tan"[J]. Hubei Journal of Traditional Chinese Medicine, 2013, 35(12): 36-38. |
| [12] |
SHI L F, WU Y, LI C Y. Hormone therapy and risk of ovarian cancer in postmenopausalwomen:asystematic review and meta-analysis[J]. Menopause the Journal of the North American Menopause Society, 2016, 23(4): 417-424. DOI:10.1097/GME.0000000000000550 |
| [13] |
林玉榕, 郑丽燕. 中药菟丝子药理研究[J]. 生物技术世界, 2014, 42(2): 84. LIN Y R, ZHENG L Y. Study on pharmacology of Chinese medicine Dodder[J]. Biotech World, 2014, 42(2): 84. |
| [14] |
石丹宁, 赵丕文. 中药治疗绝经后骨质疏松症及其作用机制的研究进展[J]. 环球中医药, 2018, 11(4): 600-604. SHI D N, ZHAO P W. Research developments on the use and mechanisms of action of traditional Chinese medicines in treating postmenopausal osteoporosis[J]. Global Traditional Chinese Medicine, 2018, 11(4): 600-604. DOI:10.3969/j.issn.1674-1749.2018.04.035 |
| [15] |
郭琳, 苗明三. 瓜蒌化学、药理及临床应用探讨[J]. 中医学报, 2014, 29(6): 865-868. GUO L, MIAO M S. Application exploration on chemistry, pharmacology and clinical application of mongolian snakegourd[J]. Acta Chinese Medicine, 2014, 29(6): 865-868. |
| [16] |
封若雨, 朱新宇, 张苗苗. 近五年山楂药理作用研究进展[J]. 中国中医基础医学杂志, 2019, 25(5): 715-718. FENG R Y, ZHU X Y, ZHANG M M. Research progress on pharmacological function of Hawthorn in the past five years[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2019, 25(5): 715-718. |
| [17] |
蔡洁云, 欧艺深, 刘丽莹, 等. 中药红曲降血脂药理作用及其处方制剂分析[J]. 中国医药导报, 2010, 7(15): 79-80. CAI J Y, OU Y S, LIU L Y, et al. Analysis of pharmacological effects and prescription preparations of traditional Chinese medicine Hongqu and blood fat[J]. China Medical Herald, 2010, 7(15): 79-80. DOI:10.3969/j.issn.1673-7210.2010.15.043 |
| [18] |
周亚娜, 向楠, 陈辉. 补肾化痰法影响骨髓间充质干细胞成骨分化的实验研究[J]. 中国中医基础医学杂志, 2015, 21(3): 275-277. ZHOU Y N, XIANG N, CHEN H. Experimental study of tonifying kidney and resolving phlegm methods on influencing the bone marrow mesenchymal stem cells osteogenic differentiation[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2015, 21(3): 275-277. |
| [19] |
周亚娜, 陈辉, 向楠. 补肾化痰法影响骨髓间充质干细胞成脂分化的实验研究[J]. 时珍国医国药, 2015, 26(10): 2325-2327. ZHOU Y N, CHEN H, XIANG N. The Experimental of the effect of adipogenic differentiation of BMSCs on Bushen Huatan therapy[J]. Lishizhen Medicine and Materia Medica Research, 2015, 26(10): 2325-2327. |
| [20] |
周广文, 向楠, 周亚娜, 等. 补肾化痰方对去势骨质疏松大鼠钙沉积的影响[J]. 中国骨质疏松杂志, 2018, 24(3): 366-370. ZHOU G W, XIANG N, ZHOU Y N, et al. Effect of Bushen Huatan Prescription on calcium deposition in ovariectomized rats with osteoporosis[J]. Chinese Journal of Osteoporosis, 2018, 24(3): 366-370. DOI:10.3969/j.issn.1006-7108.2018.03.019 |
| [21] |
于书敏.利维爱对去势雌兔动脉粥样硬化的防治作用[A].中国畜牧兽医学会.中国畜牧兽医学会兽医病理学分第12次暨中国动物病理生理学专业委员会第11次学术讨论会论文集[C].北京: 中国畜牧兽医学会, 2003. YU S M. Livial's prevention and treatment of atherosclerosis in castrated female rabbits[A]. The 12th veterinary pathology credit of the Chinese Society of Animal Husbandry and Veterinary Medicine and the 11th symposium of the Chinese Animal Pathophysiology Committee[C]. Beijing: Chinese Association of Animal Science and Veterinary Medicine, 2003. |
| [22] |
沈霖.利维爱及中药补肾法防治绝经后妇女骨质疏松症的临床对比研究[A].中国医师协会中西医结合医师分会、福建中医药大学. 2012中国医师协会中西医结合医师大会第三次会议论文集[C].福州: 中国医师协会中西医结合医师分会, 2012. SHEN L. Clinical comparative study of Livial and Chinese medicine Bushen in prevention and treatment of osteoporosis in postmenopausal women[A]. Chinese Medical Doctor Association Chinese Medicine and Western Medicine Physician Branch, Fujian University of Traditional Chinese Medicine[C]. 2012 Compilation of the third meeting of the Chinese Medical Doctor Association of Integrative Medicine. Fuzhou: Chinese Medical Doctor Association Chinese Medicine and Western Medicine Physician Branch, 2012. |
| [23] |
向凝, 马文, 刘树馨, 等. 阿托伐他汀治疗伴有动脉粥样硬化性心血管疾病的老年骨质疏松症患者的临床机制研究[J]. 中国处方药, 2018, 16(12): 69-70. XIANG N, MA W, LIU S X, et al. Clinical mechanism of atorvastatin in the treatment of elderly patients with osteoporosis with atherosclerotic cardiovascular disease[J]. Journal of China Prescription Drug, 2018, 16(12): 69-70. DOI:10.3969/j.issn.1671-945X.2018.12.042 |
| [24] |
龚海虹, 林志航, 林志强. 三种不同他汀类药物对去卵巢诱导骨质疏松大鼠骨密度的影响[J]. 中国骨质疏松杂志, 2019, 25(4): 518-522. GONG H H, LIN Z H, LIN Z Q. Effects of three different types of station on bone mineral density in ovariectomized rats with osteoporosis[J]. Chinese Journal of Osteoporosis, 2019, 25(4): 518-522. DOI:10.3969/j.issn.1006-7108.2019.04.019 |
| [25] |
YUE R, ZHOU B O, SHIMADA I S, et al. Leptin receptor promotes adipogenesis and reduces osteogenesis by regulating mesenchymal stromal cells in adult bone marrow(article)[J]. Cell Stem Cell, 2016, 18(6): 782-796. DOI:10.1016/j.stem.2016.02.015 |
| [26] |
石少辉, 张智海, 吴国平, 等. 神经调控与骨重建[J]. 中国骨质疏松杂志, 2015, 21(12): 1517-1521. SHI S H, ZHANG Z H, WU G P, et al. Neural regulation and bone reconstruction[J]. Chinese Journal of Osteoporosis, 2015, 21(12): 1517-1521. DOI:10.3969/j.issn.1006-7108.2015.12.023 |
| [27] |
BAYHAN I, DOGAN NU, OZAKSIT G, et al. Effect of strontium ranelate on serum leptin and bone turnover markers in women with established postmenopausal osteoporosis[J]. Journal of Reproductive Medicine, 2013, 58(7): 319-323. |
| [28] |
MOHAMMADALI F, ABROUN S, ATASHI A, et al. Regulation of bone formation and resorption by Beta Adrenergic system[J]. Iranian South Medical Journal, 2016, 19(1): 119-140. |
| [29] |
CORR A, SMITH J, BALDOCK P. Neuronal control of bone remodeling[J]. Toxicologic Pathology, 2017, 45(7): 894-903. DOI:10.1177/0192623317738708 |
2. Wuhan Hospital of Traditional Chinese and Western Medicine, Wuhan No.1 Hospital, Wuhan 430022, China
 2020, Vol. 37
2020, Vol. 37