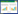文章信息
- 张瀛, 皮佳鑫, 李雯, 刘志东
- ZHANG Ying, PI Jiaxin, LI Wen, LIU Zhidong
- 黄芩素-茶碱共晶的溶剂体系筛选及体外溶出度评价
- Solvent optimization and in vitro dissolution evaluation of baicalein-theophylline cocrystal
- 天津中医药, 2020, 37(1): 93-98
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(1): 93-98
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.01.20
-
文章历史
- 收稿日期: 2019-10-20
2. 天津中医药大学, 天津市现代中药重点实验室-省部共建国家重点实验室培育基地, 天津 301617
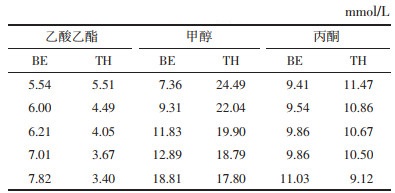
黄芩素(Baicalein,BE,图 1)是一种具有活性的黄酮类化合物,主要存在于黄芩的干燥根中[1]。BE具有抗氧化、抗自由基、抗癌、抗硬化、抗菌、抗炎以及心肺和神经保护等多种药理作用[2-4]。但是BE在水中溶解度低,溶出速率慢、口服吸收差严重限制了它的临床应用。
|
| 图 1 黄芩素的化学结构式 Fig. 1 Chemical structure of baicalein |
共晶技术在改善活性药物成分的溶解度和溶出度及提高其生物利用度等方面具有良好的应用前景[5-6]。共晶是一种结晶复合物,由两个及以上成分按照固定的化学计量比,通过非共价键连接在一起[7-8]。由于共晶可以在不影响分子结构和生物活性的前提下,改变药物的溶解度、溶出度、吸湿性、稳定性等性质,近年来在药物研发领域引起了广泛关注[9]。
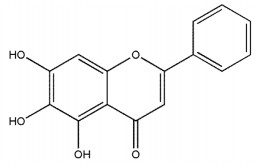
BE分子中具有3个羟基和1个羧基,容易与嘌呤类[10]、酰胺类[11]等化合物形成共晶。Zhu等[12]制备了BE-咖啡因共晶,结果显示BE-咖啡因共晶促进了BE的溶解度和生物利用度,BE-烟酰胺共晶的制备同样提高了其体外溶出度与口服生物利用度[13-15]。本课题组在前期工作中以BE为活性成分,茶碱(Theophylline,TH,图 2)为配体,成功制备了BE-TH共晶,对其进行了表征和评价。大鼠体内药代动力学表明BE-TH共晶可以提高BE的口服生物利用度[16]。
|
| 图 2 茶碱的分子结构 Fig. 2 Chemical structure of theophylline |
然而,在BE-TH共晶体系当中,配体TH具有明确药理活性。TH作为临床常用药物,能够显著缓解支气管炎和心脏性呼吸困难等症状,且常以缓释制剂应用于临床,以缓解普通制剂的胃肠黏膜刺激性。另外,TH常被当作活性成分来制备共晶,以改善溶解性[17],提高稳定性[18]。临床上,由茶碱钠与甘氨酸制备而成的甘氨酸茶碱钠,在水中溶解度较好,可以起到改善吸收并减轻胃肠道刺激的作用[19]。因此,在BE-TH共晶体系中,应进一步研究BE-TH共晶体系对两种活性成分各自的影响,并从两种成分共用的角度思考BE-TH共晶的临床应用潜在价值。
研究旨在以前期工作为基础,尝试从二元体系出发,将BE和TH作为共晶形成物,通过绘制BE-TH-溶剂体系的三元相图,对制备BE-TH共晶的溶剂体系进行优选。并通过体外溶出实验,初步考察形成共晶对BE与TH各自溶出度的影响,为共晶二元系统的进一步深入研究提供参考。
1 试药与仪器BE(纯度≥98%,上海源叶生物科技有限公司);TH(纯度≥98%,北京百灵威科技有限公司);BE对照品(含量≥98%,上海源叶生物科技有限公司);TH对照品(含量≥98%,上海源叶生物科技有限公司);丙酮(分析纯,天津市江天化工技术有限公司);乙酸乙酯(分析纯,天津康科德科技有限公司);甲醇(色谱纯,美国Thermo Fisher公司);乙腈(色谱纯,美国Thermo Fisher公司);甲酸[色谱纯,赛默飞世尔科技(中国)有限公司];实验用水为采用Milli-Q水纯化系统(美国Millipore公司)制得。
十万分之一天平(XP205,瑞士Mettler-Toledo公司);高效液相色谱仪(SPD-10A plus,日本岛津公司,包括SPD-20A紫外检测器、LC-20AT泵、LC Solution色谱工作站);全自动溶出取样系统(DT-820,德国ERWEKA公司);差示扫描量热仪(Jade DSC,美国Perkin Elmer公司);透皮扩散试验仪(TK-20B型,上海锴凯科技贸易有限公司)。
2 方法 2.1 HPLC分析方法溶液中BE和TH浓度的测定采用高效液相色谱法。色谱柱为Inertsil®ODS C18柱(150 mm×4.6 mm,5 μm);流动相为0.05%甲酸水溶液(A)-乙腈(B),浓度梯度为0~3 min,B:5%;3~6 min,B:5%~80%;6~14 min,B:80%;14~15 min,B:80%~5%;15~18 min,B:5%;流速为1.0 mL/min;检测波长为276 nm,柱温为30 ℃,进样量为20 μL。
2.2 3种溶剂中BE、TH及BE-TH共晶的饱和溶解度测定精密量取乙酸乙酯、甲醇和丙酮各2 mL置洁净的西林瓶中,分别加入过量的BE、TH或BE-TH共晶,密封后置25℃条件下恒温搅拌24 h使之达到溶解平衡,混悬液经0.22 μm微孔滤膜滤过,以甲醇适度稀释续滤液,按照“2.1”项方法测定续滤液中BE和TH的浓度。所有样品平行实验3份。
2.3 相图的测定根据TH在乙酸乙酯、甲醇和丙酮中的溶解度,配制一系列浓度的TH乙酸乙酯、甲醇和丙酮溶液,在其溶解度范围内设定TH的浓度,分别为0.4、0.2、0.1、0.05和0.025 mg/mL,经有机滤膜滤过后,分别加入过量的BE-TH共晶,密封后置于25 ℃条件下恒温搅拌24 h,达到溶解平衡后,混悬液经0.22 μm微孔滤膜滤过,以甲醇适度稀释续滤液,按照“2.1”项方法测定续滤液中BE和TH的浓度。所有样品平行实验3份。
2.4 BE-TH共晶的制备BE与TH以摩尔比为1:1的比例制备共晶。量取一定量的丙酮置于200 mL烧杯中,加入0.36 g的TH,搅拌、超声至全部溶解,另称取0.54 g的BE加入50 mL西林瓶中,往此西林瓶中少量加入含TH的丙酮溶液,放入转子于磁力搅拌器上以200 r/min的转速搅拌,至溶剂挥干后,继续少量加入上述TH丙酮溶液直至全部挥发,干燥,得到BE-TH共晶固体。
2.5 体外溶出度的测定 2.5.1 溶出介质的配制人工肠液:精密称取牛胆酸钠约9.66 g、氯化钠约24.02 g、卵磷脂约0.54 g、马来酸约13.32 g、氢氧化钠约8.35 g于6 L去离子水中,搅拌至溶解。人工胃液:精密称取牛磺胆酸钠约0.26 g、胃蛋白酶约0.60 g、卵磷脂约0.055 g、氯化钠约12.00 g于6 L去离子水中,搅拌至溶解后,以0.1 mol/L盐酸(HCL)调节pH至1.6。
2.5.2 体外溶出度考察精密称取BE原料药约18 mg、TH原料药约12.82 mg、BE-TH物理混合约30.82 mg、BE-TH共晶约31.55 mg(折合BE约18 mg)至硬壳胶囊中。溶出介质分别为人工肠液和人工胃液。参照《中华人民共和国药典》溶出度实验方法,将胶囊置于转篮中,浸没于溶出介质900 mL中,设定转速为100 r/min,控制温度为(37.0±0.5)℃,于5、10、15、30、45、60、90、120、180、240、300和360 min取样2 mL,并立即补充等量等温溶出介质。溶出样品经0.45 μm微孔滤膜过滤,注入液相色谱仪,按照2.1项下的色谱条件分析计算累积溶出度。
3 结果与讨论 3.1 分析方法的建立BE峰面积(A)在1~100 μg/mL内与质量浓度(C)呈良好线性关系(回归方程为:A=1.08×105C-49 693,R2=0.999 95);TH的峰面积(A)在1~100 μg/mL内与质量浓度(C)呈良好线性关系(回归方程为:A=6.94×104C+16 486,R2=0.999 82);BE含量测定的精密度在1%之内,TH含量测定的精密度在0.8%以内,均符合要求,待测样品在进样室放置12 h含量稳定。
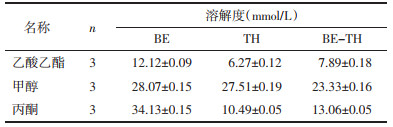
3.2 3种溶剂中BE、TH及BE-TH共晶的饱和溶解度测定25 ℃下,BE、TH以及BE-TH共晶在乙酸乙酯、甲醇和丙酮中的饱和溶解度结果见表 1。由结果可知,随溶剂的改变,3者的溶解度趋势呈一定规律,BE在3种溶剂中的溶解度均高于TH和BE-TH共晶,其在丙酮中的溶解度最高,甲醇其次,乙酸乙酯中最低;TH和BE-TH共晶均在甲醇溶液中溶解度最高,丙酮次之,乙酸乙酯中最低。
|
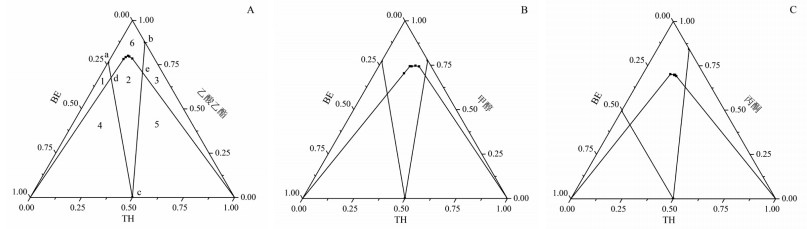
根据BE-TH共晶在TH乙酸乙酯、TH甲醇以及TH丙酮溶液中的溶解度,具体结果见表 2,得到三相平衡点,绘制了25 ℃时BE-TH-溶剂体系的三元相图。由于BE和TH的物质的量分数相对于溶剂的物质的量分数来说很小,使数据全部聚集在三元相图的顶部,不利于分析,因此在绘制三元相图的过程中,将BE和TH的物质的量分数均乘以200。图 3为绘制的BE-TH-溶剂体系的三元相图,笔者以BE-TH-乙酸乙酯体系(图 3-A)为例,将划分的6个区域及5个重要节点归纳为:区域a和b分别表示BE和TH的饱和溶液,d点和e点为三相点,d点为被BE和BE-TH共晶饱和的溶液体系,e点为被TH和BE-TH共晶饱和的溶液体系,c点是BE-TH共晶的临界点。de曲线表示共晶在乙酸乙酯中的溶解度曲线,区域1、2、3分别表示固态BE、共晶和TH与其乙酸乙酯饱和溶液的两项平衡区,区域4表示固态共晶、固态BE与其乙酸乙酯饱和溶液的三相平衡区,区域5表示固态共晶、固态TH与其乙酸乙酯饱和溶液的三相平衡区,区域6是不饱和溶液的单相区。
|
| 图 3 25℃下BE-TH-溶剂体系在乙酸乙酯(A)、甲醇(B)、丙酮(C)中的三元相图 Fig. 3 Ternary phase diagrams of BE-TH-solvent system in ethyl acetate (A), methanol (B) and acetone (C) at 25℃ |
从三元相图可以看出,在3种溶剂中,BE-TH-溶剂体系中化学计量比均明显穿越共晶稳定形成区。比较3种溶剂中共晶形成区域的面积大小,结果为丙酮 > 甲醇 > 乙酸乙酯,丙酮更容易形成共晶,因此笔者选择丙酮作为溶剂,以BE和TH物质的量1:1的比例通过溶剂挥发法制备得到单一共晶。
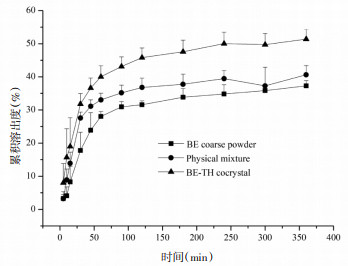
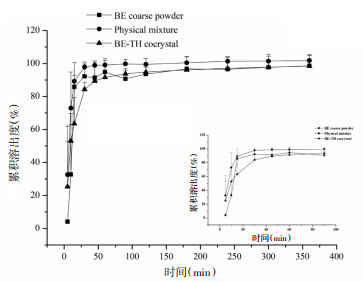
3.4 体外溶出度评价BE原料药、TH原料药、BE-TH物理混合以及BE-TH共晶在人工肠液和人工胃液中的溶出结果,以时间为横坐标,累积溶出百分率为纵坐标作图,结果见图 4-7。
|
| 图 4 BE、BE-TH物理混合以及BE-TH共晶在人工肠液中BE的累积溶出度(x±s,n=3) Fig. 4 Cumulative dissolution of BE of BE, BE-TH physical mixing and BE-TH eutectic in simulated intestinal fluid (x±s, n=3) |
|
| 图 5 TH、BE-TH物理混合以及BE-TH共晶在人工肠液中TH的累积溶出度 Fig. 5 Cumulative dissolution of TH of BE, BE-TH physical mixing and BE-TH eutectic in simulated intestinal fluid (x±s, n=3) |
|
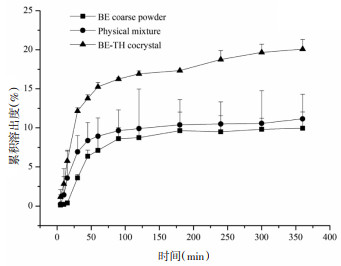
| 图 6 BE、BE-TH物理混合以及BE-TH共晶在人工胃液中BE的累积溶出度(x±s,n=3) Fig. 6 Cumulative dissolution of BE of BE, BE-TH physical mixing and BE-TH eutectic in simulated gastric fluid (x±s, n=3) |
|
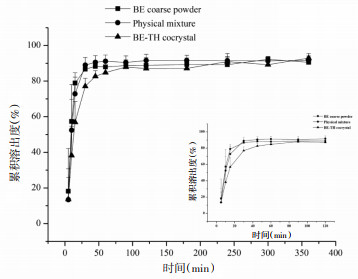
| 图 7 TH、BE-TH物理混合以及BE-TH共晶在人工胃液中TH的累积溶出度(x±s,n=3) Fig. 7 Cumulative dissolution of TH of BE, BE-TH physical mixing and BE-TH eutectic in simulated gastric fluid (x±s, n=3) |
计算人工肠液中360 min内的累积溶出度,结果显示原料药组BE的溶出度为37.29%±1.56%,BE-TH物理混合中BE的溶出度是40.62%±2.78%,而BE-TH共晶体系中BE的溶出度增加至51.39%±2.98%,分别是原料药和物理混合的1.38和1.27倍,均存在统计学差异(P < 0.01)。TH在360 min内的累积溶出度结果显示,BE-TH共晶与TH原料药及BE-TH物理混合物无统计学差异。以30 min内的累积溶出量为纵坐标,时间为横坐标,计算30 min内BE的溶出速率,结果显示BE原料药(0.11 mg/min) < BE-TH共晶(0.16 mg/min) < BE-TH物理混合(0.17 mg/min),表明BE-TH共晶能够促进BE的溶解。计算TH在30 min内溶出速率,结果显示BE-TH共晶(0.28 mg/min) < BE-TH物理混合(0.29 mg/min) < TH原料药(0.44 mg/min),表明BE-TH共晶对TH起到了缓释作用。
计算人工胃液中360 min内的累积溶出度,结果显示原料药组BE的溶出度为9.94%±2.10%,BE-TH物理混合中BE的溶出度是11.15%±3.15%,BE-TH共晶体系中BE的溶出度增加到了20.08%±1.25%,分别是原料药和物理混合物的2.02和1.80倍,均存在统计学差异(P < 0.01)。TH在360 min内的累积溶出度结果显示,BE-TH共晶与TH原料药及BE-TH物理混合物无统计学差异。以30 min内的累积溶出量为纵坐标,时间为横坐标,计算BE在30 min内的溶出速率,结果显示BE原料药(0.03 mg/min) < BE-TH物理混合(0.05 mg/min) < BE-TH共晶(0.08 mg/min),表明BE-TH共晶能够促进BE的溶解。计算TH在30 min内的溶出速率,结果显示BE-TH共晶(0.30 mg/min) < TH原料药(0.31 mg/min) < BE-TH物理混合(0.35 mg/min),表明BE-TH共晶同样对TH起到了缓释作用。
4 讨论中药活性成分研究是中药现代化的重要组成部分,而溶解度低的难溶性药物常常会影响药物的溶出速率,造成其口服生物利用度低,严重限制了临床应用。因此通过适宜的制剂手段,改善中药难溶性成分的溶出度和口服吸收,提高其生物利用度,已经成为中药现代化研究中的关键环节。其中,共晶技术是改善中药难溶性成分溶出度和口服吸收的重要制剂手段[20]。分子间的氢键作用是共晶形成中最重要的1种分子作用力[21],药物活性分子在形成共晶后,由于空间堆积方式的变化,某些理化性质也会发生相应的改变[22],为提高难溶性药物的生物利用度提供可能性。
溶剂挥发法制备共晶时,对于溶剂的选择至关重要,合适的溶剂才能制备出纯净的共晶产物,而不良溶剂将导致单组分的析出。如果药物活性成分在溶剂中的溶解度与配体的溶解度相差很大,比较容易形成非对称三元相图,那将不利于纯共晶的制备[23]。所以常常会选择API和CCF在该溶剂中溶解度相近的溶剂,且共晶溶解度应低于活性成分的溶解度,通过搅拌使分子间充分作用,以制备出单一共晶。在本研究中,笔者选择制备共晶的常用溶剂甲醇、乙酸乙酯和丙酮,是鉴于黄芩素与茶碱能够溶于此3种溶剂中,且在3种溶剂中的溶解度相差不大。然后通过绘制共晶成分与溶剂体系的三元相图的方法筛选溶剂,为共晶制备工艺的确定提供理论支持[24],进而可以制备出高纯度的共晶产物。
文章以BE和TH为原料药,根据BE-TH共晶在TH乙酸乙酯、TH甲醇以及TH丙酮溶液中的溶解度,得到三相平衡点,绘制BE-TH-溶剂体系的三元相图,筛选出丙酮作为制备BE-TH共晶的最佳溶剂,为BE-TH共晶的扩大生产及共晶的热力学研究提供参考。体外溶出实验结果表明共晶的形成能够促进难溶性成分BE的体外释放,并且对TH的释放度起到一定缓释作用,这一现象可能是由晶型的排列以及共结晶过程导致的两者性质的改变[25]。而共晶对TH的缓释效果,可以归因于难溶性成分对药物释放的阻碍作用[26],从而减少了TH对胃肠道的刺激和服药次数,为BE-TH共晶的进一步研究和临床应用提供了借鉴。
| [1] |
GAO Z H, HUANG K X, YANG X L, et al. Free radical scavenging and antioxidant activities of flavonoids extracted from the radix of Scutellaria baicalensis Georgi[J]. Biochim Biophys Acta, 1999, 1472(3): 643-650. DOI:10.1016/S0304-4165(99)00152-X |
| [2] |
GAO Y, SNYDER S A, SMITH J N, et al. Anticancer properties of baicalein:a review[J]. Medicinal Chemistry Research, 2016, 25(8): 1515-1523. DOI:10.1007/s00044-016-1607-x |
| [3] |
SHAO Z H, VANDEN HOEK T L, QIN Y M, et al. Baicalein attenuates oxidant stress in cardiomyocytes[J]. American Journal of Physiology Heart and Circulatory Physiology, 2002, 282(3): 999-1006. DOI:10.1152/ajpheart.00163.2001 |
| [4] |
WEI N, WEI Y H, LI B R, et al. Baicalein promotes neuronal and behavioral recovery after intracerebral hemorrhage via suppressing apoptosis, oxidative stress and neuroinflammation[J]. Neurochemical Research, 2017, 42(5): 1-9. |
| [5] |
GAO Y, ZU H, ZHANG J J. Enhanced dissolution and stability of adefovir dipivoxil by cocrystal formation[J]. Journal of Pharmacy and Pharmacology, 2011, 63(4): 483-490. DOI:10.1111/j.2042-7158.2010.01246.x |
| [6] |
BOLTON O, MATZGER A J. Improved stability and smart-Material functionality realized in an energetic cocrystal[J]. Angewandte Chemie, 2011, 123(38): 9122-9125. DOI:10.1002/ange.201104164 |
| [7] |
SHAN N, ZAWOROTKO M J. The role of cocrystals in pharmaceutical science[J]. Drug Discovery Today, 2008, 13(9-10): 440-446. DOI:10.1016/j.drudis.2008.03.004 |
| [8] |
VISHWESHWAR P, MCMAHON J A, BIS J A, et al. Pharmaceutical co-crystals[J]. Journal of Pharmaceutical Sciences, 2006, 95(3): 499-516. DOI:10.1002/jps.20578 |
| [9] |
JENNIFFER I. ArenasGarcía, Herreraruiz D, Karina MondragónVásquez, et al. Co-Crystals of active pharmaceutical ingredients-acetazolamide[J]. Crystal Growth and Design, 2010, 10(8): 3732-3742. DOI:10.1021/cg1005693 |
| [10] |
周生研, 张博文, 魏元锋, 等. 共晶技术提高黄芩素溶出度及生物利用度的研究[J]. 中国药科大学学报, 2018, 49(6): 682-688. ZHOU S Y, ZHANG B W, WEI Y F, et al. Enhanced dissolution and oral bioavailability of baicalein by cocrystallization[J]. Journal of China Pharmaceutical University, 2018, 49(6): 682-688. |
| [11] |
张亚琪, 黄燕婷, 高缘, 等. 黄芩素-烟酰胺共晶结晶过程的热力学研究[J]. 中国药科大学学报, 2015, 46(5): 568-574. ZHANG Y Q, HANG Y T, GAO Y, et al. Thermodynamics of baicalein-nicotinamide co-crystallization process[J]. Journal of China Pharmaceutical University, 2015, 46(5): 568-574. |
| [12] |
ZHU B, ZHANG Q, WANG J R, et al. Cocrystals of baicalein with higher solubility and enhanced bioavailability[J]. Crystal Growth and Design, 2017, 17(4): 1893-1901. DOI:10.1021/acs.cgd.6b01863 |
| [13] |
HUANG Y T, ZHANG B, GAO Y, et al. Baicalein-nicotinamide cocrystal with enhanced solubility, dissolution, and oral bioavailability[J]. Journal of Pharmaceutical Sciences, 2014, 103(8): 2330-2337. DOI:10.1002/jps.24048 |
| [14] |
PI J X, WANG S Y, LI W, et al. A nano-cocrystal strategy to improve the dissolution rate and oral bioavailability of baicalein[J]. Asian Journal of Pharmaceutical Sciences, 2018, 4: 9. |
| [15] |
SOWA M, ŚLEOPKURA K, MATCZAK-JON E. A 1:1 cocrystal of baicalein with nicotinamide[J]. Acta Crystallographica, 2012, 68(7): 262-265. |
| [16] |
LI W, PI J X, ZHANG Y, et al. A strategy to improve the oral availability of baicalein:The baicalein-theophylline cocrystal[J]. Fitoterapia, 2018, 129: 85-93. DOI:10.1016/j.fitote.2018.06.018 |
| [17] |
LU J, ROHANI S. Preparation and characterization of theophylline-nicotinamide cocrystal[J]. Asian Journal of Pharmaceutical and Clinical Research, 2014, 7(Suppl 1): 62-65. |
| [18] |
TRASK A V, MOTHERWELL W D S, JONES W. Physical stability enhancement of theophylline via cocrystallization[J]. International Journal of Pharmaceutics, 2006, 320(1/2): 114-123. |
| [19] |
陈桂荣, 王利杰, 杨继芳, 等. 甘氨酸茶碱钠缓释片体外释放与体内吸收的相关性研究[J]. 中国临床药理学杂志, 2000, 16(3): 217-219. CHEN G R, WANG L J, YANG J F, et al. Study on the relationship between in vitro release and in vivo absorption of glycine theophylline sodium sustained release tablets[J]. The Chinese Journal of Clinical Pharmacology, 2000, 16(3): 217-219. DOI:10.3969/j.issn.1001-6821.2000.03.015 |
| [20] |
周新波, 吴素香, 孙梦莹, 等. 中药难溶性有效成分共晶的研究进展[J]. 中草药, 2016, 47(2): 336-343. ZHOU X B, WU S X, SUN M Y, et al. Research progress on co-crystal of insoluble active ingredients of Chinese materia medica[J]. Chinese Traditional and Herbal Drugs, 2016, 47(2): 336-343. |
| [21] |
STEINER T. The hydrogen bond in the solid state[J]. Angewandte Chemie International Edition, 2010, 41(1): 48-76. |
| [22] |
王小兵, 黄世铭, 廖静怡, 等. 氢氯噻嗪药物共晶的制备、表征及量化计算[J]. 江西师范大学学报(自然科学版), 2015, 39(3): 240-245. WANG X B, HUANG S M, LIAO J Y, et al. The synthesis, characterization and quantum calculations of cocrystals based on hydrochlorothiazide[J]. Journal of Jiangxi Normal University(Natural Science Edition), 2015, 39(3): 240-245. |
| [23] |
郭晶晶.茶碱-烟酰胺共晶热力学研究及溶液络合机理的探索[D].天津: 天津大学, 2013. GUO J J. Study on the thermodynamics of theophylline-nicotinamide eutectic and the mechanism of solution complexation[D]. Tianjin: Tianjin University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10056-1014036651.htm |
| [24] |
范玉洁, 宋逸婷, 张亚琪, 等. 溶剂对黄芩素-烟酰胺共晶形成热力学的影响[J]. 中国药科大学学报, 2016, 47(4): 437-441. FAN Y J, SONG Y T, ZHANG Y Q, et al. Effect of solvents on the formation thermodynamics of baicaleinnicotinamide cocrystals[J]. Journal of China Pharmaceutical University, 2016, 47(4): 437-441. |
| [25] |
BABU N J, NANGIA A. Solubility advantage of amorphous drugs and pharmaceutical cocrystals[J]. Crystal Growth and Design, 2011, 11(7): 2662-2679. DOI:10.1021/cg200492w |
| [26] |
赵科, 刘源, 赖可, 等. Box-Behnken响应面法优化去氧氟尿苷缓释片处方及其体外释放机制研究[J]. 中国抗生素杂志, 2018, 43(1): 64-68. ZHAO K, LIU Y, LAI K, et al. Optimization of the sustained-release tablets of doxifluridine using the Box-Behnken design and the study on the mechanism of in vitro drug release[J]. Chinese Journal of Antibiotics, 2018, 43(1): 64-68. DOI:10.3969/j.issn.1001-8689.2018.01.010 |
2. Tianjin State Key Laboratory of Modern Chinese Medicine-Province and Ministry Co-Established State Key Laboratory Cultivation Base, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2020, Vol. 37
2020, Vol. 37