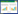文章信息
- 钟芳芳, 严鸣光, 杨芳, 朱格, 殷卫兵
- ZHONG Fangfang, YAN Mingguang, YANG Fang, ZHU Ge, YIN Weibing
- 桑辛素对D-半乳糖致小鼠老年性痴呆模型的保护作用及机制研究
- Protective effect and mechanism of morusin on D-galactose induced alzheimer disease in mice
- 天津中医药, 2020, 37(1): 104-108
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(1): 104-108
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.01.22
-
文章历史
- 收稿日期: 2019-10-27
老年性痴呆(阿尔茨海默病,AD)是一种常发生于老年期,以记忆缺失,进行性认知功能障碍为主要临床特征的神经退行性疾病[1]。目前认为AD主要的病理学改变为神经原纤维缠结、老年斑和大量的神经元丢失[2]。近年来,随着人均寿命的逐渐增加和人口老龄化日益严重,AD已成为继心血管疾病、肿瘤和中风之后的第4大死亡原因[3]。AD的发病机制尚不明确,近年来研究显示AD与胆碱能神经系统、炎症和氧化应激等密切相关[4]。目前医学界对AD的防治尚无理想药物。桑辛素是桑叶中的一种分子量为420.461的黄酮类化合物,研究表明其具有抗炎、抗衰老、抗菌、抗病毒和降血糖等广泛的药理作用[5]。它的抗炎机制可能与调节NF-κB信号转导通路有关,而抗衰老机制则与其可清除氧自由基作用有关。目前桑辛素对老年性痴呆的研究尚未见相关文献报道,本研究旨在探讨桑辛素对老年性痴呆的保护作用及其作用机制,为桑辛素的进一步开发和利用提供实验依据。
1 材料与方法 1.1 药物与试剂桑辛素:含量≥98%,上海士锋生物科技有限公司,批号:62596-29-6;D-半乳糖:国药集团化学试剂有限公司,批号:20160714;吡拉西坦片:规格:0.4 g/片,湖北华中药业有限公司,批号:20160830。乙酰胆碱(ACH)、乙酰胆碱转移酶(ChAT)测定试剂盒:南京建成生物工程研究所,批号:20170620、20170511。白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)酶联免疫吸附(ELISA)检测试剂盒:博士德生物技术有限公司,批号:20170221、20170421;苏木精-伊红(HE)染液,南京建成科技有限公司,批号:20170412。p53鼠多克隆抗体:北京中杉金桥生物技术有限公司,批号:20170405。
1.2 动物SPF级Balb/c小鼠60只,雌雄各半,体质量为20~24 g,购买于广东省医学实验动物中心,动物合格证号为SCXK(粤)2016-0003。饲养条件:相对湿度为50%~70%,温度为21~23 ℃,明暗各12 h。
1.3 方法 1.3.1 动物分组与给药小鼠按体质量随机分为空白对照组、模型组、吡拉西坦组(PRT)、桑辛素低剂量组(MRS-L组)、桑辛素中剂量组(MRS-M组)、桑辛素高剂量组(MRS-H组),每组10只。连续8周皮下注射D-半乳糖100 mg/(kg·d)造模,造模当天开始连续给药8周,其中PRT组灌胃给药0.75 g/(kg·d),桑辛素低、中、高剂量组分别灌胃给药10、20、40 mg/(kg·d),空白对照组和模型组灌胃给予等量生理盐水。
1.3.2 Morris水迷宫实验方法主要参照文献[6],具体实验分为定位航行实验和空间探索实验两部分,定位航行实验:每次实验将小鼠分别从1、3、4象限中点放入水池,记录小鼠找到平台的时间,即为潜伏期,假如小鼠在1 min内仍未找到平台,需引导小鼠到平台上停留25 s,并记录其潜伏期按1 min,连续4 d。第5天撤掉平台,进行空间探索实验,记录小鼠60 s内通过平台的次数以及分析小鼠寻找平台的策略。
1.3.3 脑组织海马齿状回结构病理学变化4%多聚甲醛固定脑组织,自来水流水冲洗24 h,75%、80%、90%、100%乙醇梯度脱水,二甲苯透明,石蜡包埋切片和常规HE染色,片厚为5 μm,观察脑组织海马齿状回结构病理学变化。
1.3.4 生化指标检测采用ELISA检测方法检测血清TNF-α和IL-1β的含量。取脑组织,制成10%匀浆,测定ChAT活性和ACH含量。实验操作均严格按照试剂盒说明书操作步骤进行。
1.3.5 p53蛋白表达的检测采用蛋白免疫印迹(Western blot)法,首先采用二喹啉甲酸(BCA)法定量检测脑组织匀浆蛋白浓度,10% SDS-PAGE分离目的蛋白,湿法转膜,5%脱脂牛奶封闭4 h,分别加入一抗(1:900)和内参β-action(1:4 000),4 ℃过夜,加入辣根过氧化物酶(HRP)标记的二抗(1:4 000),ECL试剂盒显色检测蛋白条带。以β-action灰度值作为内参照,采用quantity one Image J软件进行图像灰度值分析。
1.3.6 统计学方法采用SPSS 23.0软件进行统计学分析。计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验,各组不同时点比较采用重复测量方差分析表示,以P < 0.05为差异有统计学意义。
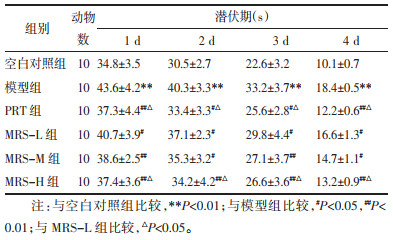
2 结果 2.1 桑辛素对D-半乳糖致老年性痴呆小鼠学习记忆能力的影响本实验采用Morris水迷宫实验方法,分别通过定位航行实验和空间探索实验两部分,检测各组小鼠的空间学习能力和空间探索能力。结果显示,与空白对照组比较,模型组小鼠寻找到平台的潜伏期显著延长(P < 0.05或P < 0.01),穿越平台所在位置的次数显著减少(P < 0.05或P < 0.01),探索策略也多采用趋向式。与模型组比较,PRT组和桑辛素给药组小鼠找到平台的潜伏期均显著降低(P < 0.05或P < 0.01),穿越平台所在位置的次数显著增多(P < 0.05或P < 0.01),探索策略也多采用直线式。与MRS-L组比较,MRS-H组和PRT组小鼠找到平台的潜伏期均显著降低(P < 0.05),穿越平台所在位置的次数显著增多(P < 0.05),探索策略采用直线式较多。见表 1-2。
|
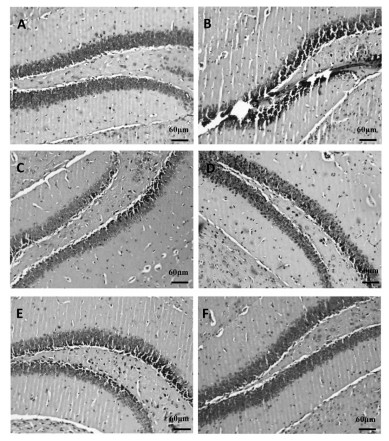
本实验通过石蜡切片、HE染色方法观察各组小鼠脑组织海马齿状回病理学变化。结果显示,空白对照组海马齿状回神经细胞结构完整,饱满,细胞核大而圆,核仁清晰。模型组海马齿状回神经细胞排列散乱,胞浆浓缩,核固缩,而PRT组和MRT给药组神经细胞排列较整齐,神经细胞形态结构较完整,神经细胞凋亡情况明显改善。见图 1。
|
| A:空白对照组,B:模型组,CPRT组,D:MRS-L组,E:MRS-M组,F:MRS-H组 图 1 各组小鼠脑组织海马齿状回结构观察(HE,×20) Fig. 1 Observation of hippocampal dentate gyrus structure of mice in each group (HE, ×20) |
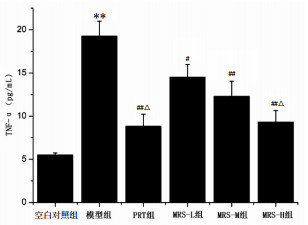
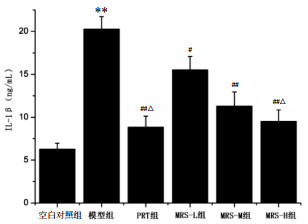
本实验采用ELISA检测方法,分别检测各组小鼠血清TNF-α和IL-1β含量。结果显示,与空白对照组比较,模型组小鼠血清TNF-α和IL-1β含量明显升高(P < 0.01)。与模型组比较,PRT组和MRS给药组小鼠血清TNF-α和IL-1β含量明显降低(P < 0.05或P < 0.01)。与MRS-L组比较,MRS-H组和PTR组小鼠血清TNF-α和IL-1β含量明显降低(P < 0.05)。见图 2-3。
|
| 与空白对照组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与MRS-L组比较,△P < 0.05 图 2 各组小鼠血清TNF-α含量(x±s) Fig. 2 Content of TNF-α in serum of mice ineach group (x±s) |
|
| 与空白对照组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与MRS-L组比较,△P < 0.05 图 3 各组小鼠血清IL-1β含量(x±s) Fig. 3 Content of IL-1β in serum of mice in each group (x±s) |
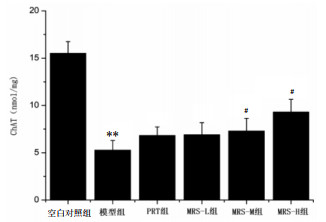
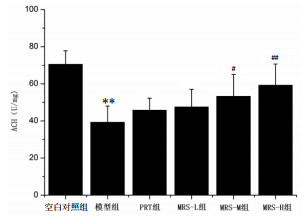
本实验采用ELISA检测方法,分别检测各组小鼠脑组织ChAT活性和ACH含量。结果显示,与空白对照组比较,模型组小鼠脑匀浆ChAT活性和ACH含量明显降低(P < 0.01)。与模型组比较,MRS-M组和MRS-H组小鼠脑匀浆ChAT活性和ACH含量明显升高(P < 0.05或P < 0.01)。见图 4-5。
|
| 与空白对照组比较,**P < 0.01;与模型组比较,#P < 0.05 图 4 各组小鼠脑组织ChAT活性(x±s) Fig. 4 Activity of ChAT in brain of mice in each group (x±s) |
|
| 与空白对照组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01 图 5 各组小鼠脑组织ACH含量(x±s) Fig. 5 Content of ACH in brain of mice in each group (x±s) |
本实验采用Western blot检测方法,检测脑组织中p53蛋白的表达水平。结果显示,与空白对照组比较,模型组小鼠脑组织p53表达量显著升高(P < 0.01)。与模型组比较,PRT组和MRS给药组小鼠脑组织p53表达量明显降低(P < 0.05或P < 0.01)。与MRS-L组比较,MPS-H组和PRT组小鼠脑组织p53表达量明显降低(P < 0.01)。见图 6-7。
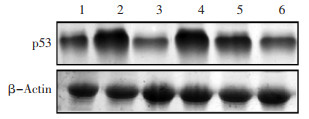
|
| 1:空白对照组,2:模型组,3:PRT组,4:MRS-L组,5:MRS-M组,6:MRS-H组 图 6 各组小鼠脑组织p53表达 Fig. 6 Expression of p53 in brain of mice in each group |
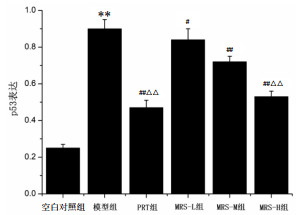
|
| 与空白对照组比较,**P < 0.01;与模型组比较,#P < 0.05;##P < 0.01,与MRS-L组比较,△△P < 0.01 图 7 各组小鼠脑组织p53表达(x±s) Fig. 7 Expression of p53 in brain of mice in each group (x±s) |
AD是一种常发生于老年期,以记忆缺失进行性认知功能障碍为主要临床特征的神经退行性疾病。AD发病机制异常复杂,迄今尚无完全阐明,而且药物治疗效果有限,不良反应较多。故针对AD的防治已成为当今医学研究中的重要内容之一。目前针对AD的临床治疗主要采用乙酰胆碱酯酶抑制剂石杉碱甲、大脑神经细胞类保护剂吡拉西坦和抗氧化剂维生素E等药物。吡拉西坦广泛应用于临床AD防治,也多用于AD动物模型的实验研究[7],故本实验选用吡拉西坦作为阳性药物进行研究。
Morris水迷宫的定位航行实验和空间探索实验是分别评价学习能力和记忆能力的经典方法[6]。本研究发现模型组小鼠Morris水迷宫定位航行实验的潜伏期明显延长,穿越平台的次数减少,多采用趋向式的探索策略,提示模型组小鼠的学习能力和记忆能力均受到损害,也表明了D-半乳糖致老年性痴呆小鼠造模成功,而桑辛素给药组小鼠上述指标较模型组明显改善,呈剂量依赖性,提示桑辛素可明显改善AD小鼠的学习能力和记忆能力。而模型组小鼠海马齿状回神经细胞损伤严重,桑辛素给药组小鼠海马齿状回神经细胞损伤明显改善,间接提示AD模型的成功和桑辛素明显改善脑海马齿状回的神经损伤。炎症是AD重要的发病机制之一,TNF-α和IL-1β是两个重要促炎因子,参与AD的发生发展过程。AD开始阶段,TNF-α可激活星形胶质细胞和小胶质细胞,诱导分泌大量IL-1β,引起一系列的炎症级联反应[8]。本研究发现桑辛素给药组可明显抑制AD的炎症反应,从而减轻AD的炎症损伤。胆碱能神经功能低下是AD另一重要的发病机制,乙酰辅酶A在ChAT的催化下结合胆碱生成ACH,作用于脑组织中的胆碱受体,引起机体一系列的生理功能变化[9-10]。通常AD患者脑内ChAT活力下降,ACH合成不足。本研究发现桑辛素可明显提高脑内ChAT活力和ACH的含量,加强胆碱能神经功能。p53是机体内的一种抑癌基因,Aβ可直接激活p53,激活的p53被磷酸化生成p-p53,进而参与细胞凋亡的调节[11-12]。本研究发现桑辛素可明显抑制脑内p53的表达,抑制神经细胞的凋亡。
综上所述,桑辛素对D-半乳糖致AD小鼠具有较好的保护作用,其作用机制可能与减轻炎症、抑制神经细胞的凋亡和增加神经突触间的ACH含量和ChAT活性有关。
| [1] |
REBECCA G C, JAY P, TSAI L H. The road to restoring neural circuits for the treatment of Alzheimer's disease[J]. Nature, 2016(539): 187-196. |
| [2] |
WEI Q, YAU W M, LU J X, et al. Structural variation in amyloid-β fibrils from Alzheimer's disease clinical subtypes[J]. Nature, 2017, 541: 217-221. DOI:10.1038/nature20814 |
| [3] |
HODSON R. Alzheimer's disease[J]. Nature, 2018, 559: S1. DOI:10.1038/d41586-018-05717-6 |
| [4] |
Mark P M. Pathways towards and away from Alzheimer's disease[J]. Nature, 2004(430): 631-639. |
| [5] |
王婷婷, 马天宇, 李琪, 等. 桑叶化学成分及生物活性研究进展[J]. 食品与药品, 2018, 20(5): 390-393. WANG T T, MA T Y, LI Q, et al. Research progress in Mori Folium[J]. Food and Medicine, 2018, 20(5): 390-393. DOI:10.3969/j.issn.1672-979X.2018.05.019 |
| [6] |
WEITZNER DS, ENGLER-CHIURAZZI EB, KOTILINEK LA, et al. Morris water maze test:optimization for mouse strain and testing environment[J]. Journal of Visualized Experiments, 2015(100): e52706. |
| [7] |
KURZ C, UNGERER I, LIPKA U, et al. The metabolic enhancer piracetam ameliorates the impairment of mitochondrial function and neurite outgrowth induced by β-amyloid peptide[J]. British Journal of Pharmacology, 2010, 160(2): 246-257. DOI:10.1111/j.1476-5381.2010.00656.x |
| [8] |
MCALPINE F E, LEE J K, HARMS A S, et al. Inhibition of soluble TNF signaling in a mouse model of Alzheimer's disease prevents pre-plaque amyloid-associated neuropathology[J]. Neurobiol of Disease, 2009, 34(1): 163-177. DOI:10.1016/j.nbd.2009.01.006 |
| [9] |
GAO L L, ZHANG Y, DENG J H, et al. Polymorphisms of CHAT but not TFAM or VR22 are associated with Alzheimer disease risk[J]. Medical Science Monitor, 2016(22): 1924-1935. |
| [10] |
杨辉, 贾桃, 况时祥, 等. BMSCs移植对AD大鼠海马组织SOD、AchE活性与MDA、Ach含量的影响及补脑Ⅰ号的干预作用[J]. 贵阳中医学院学报, 2019, 41(1): 17-20. YANG H, JIA T, KUANG S X, et al. To study the effect of BMSCs on the activity of SOD and AchE and the content of MDA and Ach in the hippocampus of AD rats and the intervention effect of Bu Nao Ⅰ Hao[J]. Journal of Guiyang College of Traditional Chinese Medicine, 2019, 41(1): 17-20. |
| [11] |
AUBREY B J, KELLY G L, JANIC A, et al. How does p53 induce apoptosis and how does this relate to p53-mediated tumour suppression?[J]. Cell Death and Differentiaton, 2018, 25(1): 104-113. DOI:10.1038/cdd.2017.169 |
| [12] |
DYSHLOVOY S A, MADANCHI R, HAUSCHILD J, et al. The marine triterpene glycoside frondoside A induces p53-independent apoptosis and inhibits autophagy in urothelial carcinoma cells[J]. Bmc Cancer, 2017, 17(1): 93. DOI:10.1186/s12885-017-3085-z |
 2020, Vol. 37
2020, Vol. 37