文章信息
- 金鑫瑶, 庞博, 王辉, 王可仪, 庞稳泰, 郑文科, 刘春香, 杨丰文, 张永刚, 于春泉, 张俊华
- JIN Xinyao, PANG Bo, WANG Hui, WANG Keyi, PANG Wentai, ZHENG Wenke, LIU Chunxiang, YANG Fengwen, ZHANG Yonggang, YU Chunquan, ZHANG Junhua
- 新型冠状病毒肺炎临床试验评价指标及相关问题
- Outcomes and related issues of clinical trials for COVID-19
- 天津中医药, 2020, 37(10): 1109-1113
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(10): 1109-1113
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.10.08
-
文章历史
- 收稿日期: 2020-03-05
2. 四川大学华西医院中国循证医学中心, 成都 610041;
3. 天津中医药大学, 天津 301617
2019年12月,中国武汉爆发新型冠状病毒肺炎(COVID-19),疫情防治形势严峻[1]。目前尚无针对新型冠状病毒的药物,临床主要采取对症治疗和支持治疗[2];一些抗病毒药物被经验性使用,但疗效缺乏研究数据。为了发现临床有价值的药物或干预方案,多个临床研究已经启动[3]。
评价指标的选择是临床试验方案的重要内容,选择恰当的评价指标才能科学地评价干预的疗效和安全性。以往的研究显示,临床试验的评价指标存在诸多问题[4-5],引起了临床研究方法学界的广泛重视。当前,已注册的药物(包括中药)防治COVID-19的临床研究方案爆发式增加。本研究对已注册相关的临床试验方案进行汇总分析,对所采用的疗效评价指标的科学性、合理性进行评估,为当前研究方案的优化及后续研究方案的设计提供参考,也为构建COVID-19临床研究核心指标集(COS)[6]提供基础。
1 资料与方法 1.1 检索方法计算机检索中国临床试验注册中心(http://www.chictr.org.cn)与美国临床试验注册中心(https://clinicaltrials.gov)。以冠状病毒、新型冠状病毒肺炎、Novel coronavirus pneumonia、Coronavirus Disease、2019-nCoV、COVID-19等为检索词进行检索,检索时间截至2020年2月12日24时。
1.2 纳入与排除标准纳入标准:1)研究类型为临床研究,包括临床试验、观察性研究或真实世界研究。2)研究对象为新型冠状病毒感染确诊的患者。3)干预措施为化学药、中药、生物药或器械等。对照措施及评价指标不做限制。排除标准:1)基础研究。2)诊断性试验。3)中医证候学分析。
1.3 数据提取由2名研究者按照纳入排除标准独立进行筛选,交叉核对,确定纳入的研究后,提取资料,并再次交叉核对。如遇分歧,经讨论解决。资料提取采用预先设计的Excel表格,提取信息包括:注册号、注册题目、注册单位、研究类型、注册时间、评价指标、测量方法、测量时点等。
2 结果 2.1 研究筛选流程检索共获得COVID-19临床试验注册方案107项,根据纳入排除标准,经筛选后最终纳入78项,其中ChiCTR注册平台61项,Clinicaltrials注册平台17项。筛选流程见图 1。
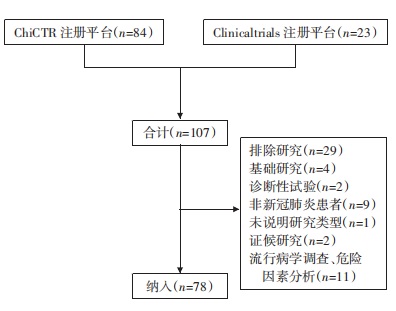
|
| 图 1 筛选流程 Fig. 1 Screening flow diagram |
78项研究中,干预性研究75项,其中随机平行对照研究61项,非随机对照研究14项,观察性研究3项。
2.2.2 疾病类型1项研究明确纳入轻型患者,5项研究纳入普通型患者,10项研究纳入重型患者,2项研究纳入危重型患者,6项研究纳入轻型/普通型患者,8项研究纳入普通型/重型患者,9项研究纳入轻型/普通型/重型患者,5项研究纳入重型/危重型患者,4项研究纳入康复期患者,其余28个研究未明确纳入患者的分期。
2.2.3 干预措施化学药、生物药等相关研究52项,干预措施包括Remdesivir、磷酸氯喹、法匹拉韦片、巴洛沙韦酯片等;中医药、中西结合临床研究26项,干预措施包括双黄连口服液、热毒宁注射液、血必净注射液、连花清瘟胶囊、中药汤剂、太极拳等。
2.3 评价指标情况 2.3.1 指标频次纳入的78项研究共报告259个评价指标,指标合计使用596次。其中主要评价指标104个,共计使用184次;次要评价指标205个,共计使用412次。单个研究评价指标数量最少为1个,最多达15个,采用≥10个评价指标的研究有28个(35.90%)。
主要评价指标方面,单个研究中最少使用1个,最多达12个,其中使用≥10个的研究有2个,使用4~9个的研究有13个,≤3个的研究有63个(80.77%)。次要评价指标方面,单个研究使用个数为0~14,其中使用≥10个的研究有7个,13个研究未选择次要评价指标(16.7%)。
2.3.2 指标域及归类将提取的指标名称进行规范化、统一化处理,具体包括:1)在保证原意不变的情况下进行规范表述,如将胸部炎症吸收情况、肺炎胸片吸收情况和肺部影像改善频率统一规范为“肺部影像学改变”。2)对同一指标不同表达方式进行合并,如将发热持续时间、体温异常时间、体温恢复正常时间、退热时间、退热率、无发热的比例等发热相关指标统一归为“体温”。3)将带有时间点的指标名称去掉时间,如将入组后第14天患者呼吸道标本新型冠状病毒核酸转阴率、第1周病毒转阴率统一归为“核酸检测”。
按照上述的规范方法,将259个指标最终规范为132个指标。以指标的功能属性为依据,按照临床症状、理化检查、病原学检测、重大事件、生活质量、疾病转归、中医证候、安全性指标共8个域进行归类统计,见表 1。具体指标归类情况,见图 2。
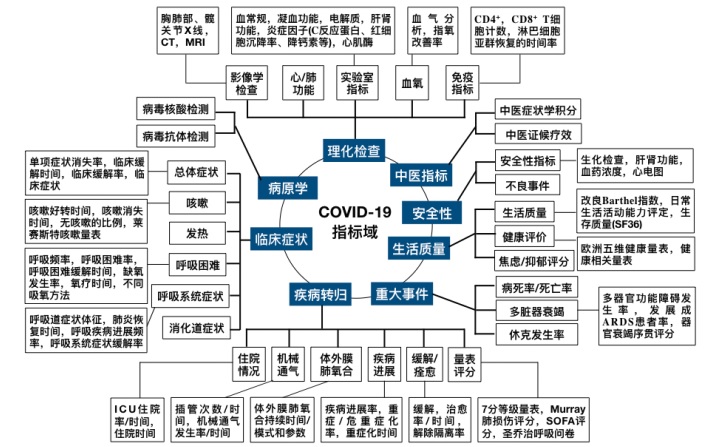
|
| 图 2 COVID-19评价指标域及指标归类 Fig. 2 Clinical outcomes category of COVID-19 |
22个研究报告了指标的测量时点,Clinicaltrials平台的17项纳入研究均报告了指标的测量时点,而ChiCTR平台的61项纳入研究中仅5项明确指出了指标的测量时点。研究周期最短为1次,最长为20 d(1个),选择频次最多的疗程为14 d(7项研究)。测量时点多为基线和疗程结束,7个研究在研究周期内设置了多个测量时点,其中1个研究在第1周内设置了4个测量时点(第1、3、5、7天)。
3 讨论本研究通过系统检索中国临床试验注册中心和美国临床试验注册平台,对已注册COVID-19研究方案中所有评价指标进行统计分析,发现研究间采用的指标差异较大,且存在表述不规范、选择指标数量不合理、指标测量时点不清、指标不实用等问题,有待进一步完善。
3.1 评价指标表述的规范性问题1)指标的表达不准确,如“疾病治愈”指标存在疾病痊愈时间、治愈率、治愈时间等多个表达方式。2)报告指标类别时未明确具体指标名称,如仅概述为“安全性相关指标”或“实验室相关检测指标”。3)连续变量被转化为百分率或分类变量形式,如将“体温”“临床症状”等指标转化为“体温复常率”“临床症状缓解率”等指标,此种做法抹除了原始数据,将影响数据再利用及研究价值。以上规范性问题均不利于临床研究的实施和统计分析。此外,评价指标不规范也不利于多项同类研究的合并分析,不利于二次研究的开展。因此,临床指标的描述应参考相应的术语标准。
3.2 评价指标数量问题本研究纳入的78项研究方案中评价指标的数量存在较大差异,单个研究采用的指标少则1个,多则15个。此外,有13个(16.7%)研究未选择次要评价指标,其中一项观察性研究的评价指标为“所有可获得的检查指标”;6项研究设定了3~7个主要结局指标,不排除研究者对主要指标和次要指标概念不明的可能。过少的评价指标不利于全面反映疗效;而评价指标过多则将增加研究的成本和工作量,同时存在多重分析问题。在随机对照试验中,主要评价指标通常为试验样本量的计算依据,若选择不当,对研究的结果会造成非常大的影响,产生假阴性或假阳性结果。因此,建议在方案注册前要明确主要指标,合理选择次要指标。一般主要评价指标通常设立1~2个,次要评价指标可以稍多一些[7-8]。
3.3 指标测量时点问题本研究纳入的研究方案对于指标测量时点的报告不全面,仅有22个(28.6%)研究报告了测量时点,多为基线和疗程结束时,部分研究在疗程内设置多个测量时点,或根据结局指标或疾病分期的不同设置不同的测量时点。对于COVID-19,为了更全面认识疾病转归和治疗效果,可以适当多些测量时点,但需要考虑指标变化的规律和临床测量的难度,综合评估科学性和可行性,确定测量时点。
3.4 安全性指标问题本研究纳入的78个方案中仅有33个研究报告了安全性相关指标,且部分研究未明确说明安全性相关指标的具体内容,仅描述为“安全性”或“安全性观测指标”。此外,对同一概念的安全性监测指标存在表达不规范的现象。建议针对不同药物的既往研究情况,有重点的观察药物对COVID-19患者的安全性,特别是对死亡、休克等重大事件,需要明确是否作为安全性评价指标。
3.5 临床价值问题临床研究结果应可回答临床最关切的或有争议的问题,而评价指标则应充分体现研究目的[9]。对于本病而言,针对COVID-19不同分期或不同病程的患者在选择评价指标时应有所侧重。如对于轻型COVID-19患者,临床干预的目的可能为缓解发热、咳嗽症状,促进病毒转阴,因此有效性评价指标可选择发热、咳嗽缓解率、病毒核酸转阴率等;对于危重型COVID-19患者,临床干预的目的可能为减少病死率,维持血氧饱和度等,因此可选择病死率、血气分析、机械通气时间等指标。本研究中纳入的28个研究(36%)未明确纳入患者的分期,不利于选择临床有价值的指标。对于中医药相关临床研究,需要重视选择符合中医药特点的指标,如症状积分、证候评价等。此外,指标的选择还应考虑依从性和医学伦理方面内容,尽量选择无创或损伤较小的评价指标。如评价轻型或普通型患者缺氧情况可使用末梢血氧饱和度而不选用有创的动脉血气分析。
4 小结采用科学、合理、可行的评价指标,对临床研究的实施和结果的临床价值至关重要。当前COVID-19临床研究的主、次评价指标均存在一些问题。建议相关研究根据实际情况,在研究中进行完善,并更新注册和方案内容。为了能够为后续相关研究选择合理指标提供参考,建议研制新型冠状病毒肺炎临床试验核心指标集(COS-COVID)[10],不仅有利于提高临床试验的质量,缩短研究设计时间,也有利于不同研究结果的比较和合并分析,减少研究浪费[11]。
| [1] |
中华人民共和国卫生健康委员会卫生应急办公室.截至2月12日24时新型冠状病毒肺炎疫情最新情况[EB/OL](2020-02-13)[2020-02-13]. http://www.nhc.gov.cn/xcs/yqtb/202002/26fb16805f024382bff1de80c918368f.shtml. National Health Commission of the People's Republic of China. Update on the epidemic situation of new coronavirus pneumonia as of 24: 00 on February 12[EB/OL]. (2020-02-13)[2020-02-13]. http://www.nhc.gov.cn/xcs/yqtb/202002/26fb16805f024382bff1de80c918368f.shtml. |
| [2] |
ZUMLA A, HUI D S, AZHAT E I, et al. Reducing mortality from 2019-nCoV:host-directed therapies should be an option[J]. Lancet, 2020, 395(10224): e35-e36. DOI:10.1016/S0140-6736(20)30305-6 |
| [3] |
王辉, 金鑫瑶, 庞博, 等. 中医药干预新型冠状病毒肺炎临床研究方案分析[J]. 中国中药杂志, 2020, 45(6): 1232-1241. WANG H, JIN X Y, PANG B, et al. Analysis on clinical study protocols of traditional Chinese medicine for coronavirus disease 2019[J]. China Journal of Chinese Materia Medica, 2020, 45(6): 1232-1241. |
| [4] |
张明妍, 张俊华, 张伯礼. 2015年中药治疗稳定性心绞痛临床试验结局指标文献研究[J]. 中国中西医结合杂志, 2018, 38(2): 191-197. ZHANG M Y, ZHANG J H, ZHANG B L. Outcome measures of clinical trials of stable angina pectoris treated by Chinese medicine in 2005:literature research[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2018, 38(2): 191-197. |
| [5] |
张明妍, 张俊华, 杜亮, 等. 核心指标集研制规范(COS-STAD)介绍及其在中医药领域应用的思考[J]. 中国循证医学杂志, 2018, 18(4): 392-396. ZHANG M Y, ZHANG J H, DU L, et al. Introduction of COS-STAD recommendations and its application of TCM[J]. Chinese Journal of Evidence-Based Medicine, 2018, 18(4): 392-396. |
| [6] |
KIRKHAM J J, GORST S, ALTMAN D G, et al. Core outcome set-standards for reporting:the COS-STAR statement[J]. PLoS Med, 2016, 13(10): e1002148. DOI:10.1371/journal.pmed.1002148 |
| [7] |
卓宏. 临床试验方案设计中主要疗效指标及试验时间的考虑要素[J]. 中国临床药理学杂志, 2008, 24(3): 270-272. ZHUO H. Consideration elements on design of primary endpoint and trial duration in protocol[J]. The Chinese Journal of Clinical Pharmacology, 2008, 24(3): 270-272. |
| [8] |
刘育函, 戴国华, 高武霖, 等. 基于复方丹参滴丸美国FDA Ⅲ期临床试验探讨中医临床疗效评价指标的选取[J]. 中西医结合心脑血管病杂志, 2019, 17(5): 720-722. LIU Y H, DAI G H, GAO W L, et al. The selection of evaluation index of clinical efficacy of traditional Chinese medicine based on the three phase FDA clinical trials of compound Danshen Dripping Pills[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2019, 17(5): 720-722. |
| [9] |
曾于珍, 陈世耀. 临床研究结局指标选择与样本量估计[J]. 协和医学杂志, 2018, 9(1): 87-92. ZENG Y Z, CHEN S Y. Outcome measure selection and sample size estimation for clinical research[J]. Medical Journal of Peking Union Medical College Hospital, 2018, 9(1): 87-92. |
| [10] |
邢冬梅, 张俊华, 张伯礼. 中医临床研究核心结局指标集形成路径[J]. 中华中医药杂志, 2014, 29(5): 1352-1355. XING D M, ZHANG J H, ZHANG B L. Approach to developing core outcome sets for clinical trials of traditional Chinese medicine[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2014, 29(5): 1352-1355. |
| [11] |
杨丰文, 季昭臣, 张明妍, 等. 中医药临床研究浪费原因及对策[J]. 中国循证医学杂志, 2018, 18(11): 1212-1215. YANG F W, JI Z C, ZHANG M Y, et al. Causes and countermeasures of waste in clinical research of Chinese medicine[J]. Chinese Journal of Evidence-Based Medicine, 2018, 18(11): 1212-1215. |
2. Chinese Evidence-based Medicine Center, West China Hospital of Sichuan University, Chengdu 610041, China;
3. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2020, Vol. 37
2020, Vol. 37