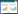文章信息
- 刘蓉, 王耀光
- LIU Rong, WANG Yaoguang
- 培元固肾方含药血清对已转染HBV质粒的HK-2细胞中TGF-β1、α-SMA、E-cadherin蛋白的影响
- Effects of Peiyuan Gushen Fang serum on TGF-beta 1, alpha-SMA and E-cadherin proteins in HBV-transfected HK-2 cells
- 天津中医药, 2020, 37(10): 1164-1169
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(10): 1164-1169
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.10.20
-
文章历史
- 收稿日期: 2020-04-27
2. 天津中医药大学第一附属医院, 天津 300381
乙型肝炎病毒(HBV)相关性肾炎(HBV-GN),是指HBV侵袭人体后,由HBV直接或间接诱发的肾小球肾炎,经血清免疫学及肾活检免疫荧光所证实,并排除其他继发性肾小球肾炎的一种肾炎综合征[1]。
HBV-GN于20世纪70年代由Combes等首次报道[2]。该病具有迁延性、多样性、不典型性等特点,是中国较常见的继发性肾脏病。HBV-GN的病理类型多种多样,最常见的是乙型肝炎病毒相关性膜性肾病(HBV-MN)[3]。目前关于HBV-GN的研究,其发病原因仍不甚明确。经研究证实,肾间质纤维化几乎是所有慢性肾脏疾病发展至终末期肾脏病的共同病理过程[4-5],是导致肾功能进行性衰竭的关键因素[6]。中国是慢性乙型肝炎大国,近年来HBV-GN的检出率也逐年上升,进入终末期肾病患者也不断增长,因此,探讨HBV-GN肾间质纤维化的机制、寻求有效的预防及治疗方法,是延缓HBV-GN患者进入终末期肾脏病的重要措施。
“培元固肾方”是王耀光教授根据HBV-GN潜在病机及临床经验自拟的经验方,具有培补脾肾、祛风搜络、疏肝养血、活血祛瘀的作用。本实验通过培元固肾方含药血清对已转染HBV质粒的人肾皮质近曲小管上皮细胞(HK-2细胞)模型的干预,探讨其对延缓HBV-GN肾间质纤维化的作用机制。
1 实验材料 1.1 实验细胞本实验所用的HK-2细胞购于武汉普诺赛生命科技有限公司。
1.2 质粒本实验质粒为C基因型重组乙型肝炎病毒质粒(pHY106-HBV)及pHY106真核表达载体(不含重组HBV空载质粒),由北京地坛医院刘顺爱教授惠赠。
1.3 主要仪器及试剂生物安全柜(Haier HR40-ⅡA2);CO2培养箱(SANYO MCO-15AC);旋转蒸发仪(Seastar公司);倒置显微镜(UOP DSY2000);酶标仪(Thermo公司);4 ℃离心机(Eppendorf公司);磷酸盐缓冲液(PBS,北京中杉金桥公司);胎牛血清(CellGro);质粒提取试剂盒、Trans-5感受态大肠杆菌(购自天根);Lipofectamine 2000(Invitrogen);Opti-MEM、DMEM/F12培养基(Gibco);α-平滑肌肌动蛋白(α-SMA)、E-cadherin抗体(Abcam公司)。
2 实验方法 2.1 转染方法通过脂质体转染法建立HBV转染HK-2细胞的模型,将pHY106-HBV转染至体外培养的正常HK-2细胞,方法参考济南大学王义国教授团队的研究[7]。
2.2 实验药物制备培元固肾方:生黄芪30 g,炒白术20 g,地龙10 g,蝉蜕6 g,防风10 g,金樱子20 g,芡实10 g,鬼箭羽10 g,丹参15 g,覆盆子10 g,泽兰20 g,槐花15 g,购于天津中医药大学第一附属医院国药堂,批号为2018002。于天津药物研究院加工煎煮、过滤后,用旋转蒸发仪浓缩至生药含量为6.864 g/mL。装入离心管中密封,保存于4 ℃冰箱备用。盐酸贝那普利片(洛汀新)用制备为1 mg/mL的混悬液,保存于4 ℃冰箱备用。
2.3 分组标记实验使用成年雄性C57BL/6小鼠,共75只,体质量20~25 g之间,于中国科学院放射研究所屏障环境中适应性饲养7 d,观察实验小鼠一般生理状况,一般生理状况良好,随机分为5组:空白对照组、贝那普利组、培元固肾方低剂量组、培元固肾方中剂量组、培元固肾方高剂量组,每组15只。
2.4 给药剂量及方法1)小鼠的灌胃剂量为:0.02 mL/g,即每只0.4 mL。2)空白对照组:给予等剂量生理盐水。3)贝那普利组:盐酸贝那普利混悬液制成含生药浓度为0.065 mg/mL的药液。4)培元固肾方低剂量组:制备生药浓度为1.144 g/mL的药物。5)培元固肾方中剂量组:制备生药浓度为2.288 g/mL的药物。6)培元固肾方高剂量组:制备生药浓度为4.576 g/mL的药物。
2.5 含药血清制备于每日上午给药,以每只0.4 mL剂量灌胃,1次/日,连续灌胃7 d。于第6天晚上禁食,第7天给药后1~2 h内经摘眼球采血(动、静脉混合血),收集于离心管。室温静置1 h,3 000 r/min离心15 min,分离血清,56 ℃灭活处理,0.22 μm滤膜过滤除菌,最后于-20 ℃冰箱保存备用。
3 实验分组及给药方法实验共分为7组:1)Mock组:空白对照组,HK-2细胞完全培养基常规培养。2)Control组:转染空质粒PHY106的HK-2细胞,生理盐水含药血清干预。3)HBV组:转染PHY106-HBV质粒的HK-2细胞,生理盐水含药血清干预。4)HBV+ACEI组:转染HBV质粒的HK-2细胞,贝那普利含药血清干预。5)HBV+PYGS Low组:转染HBV质粒的HK-2细胞,培元固肾方低剂量含药血清干预。6)HBV+PYGS Middle组:转染HBV质粒的HK-2细胞,培元固肾方中剂量含药血清干预。7)HBV+PYGS High组:转染HBV质粒的HK-2细胞,培元固肾方高剂量含药血清干预。各组转染6 h后予以药物干预48 h,进行下一步实验。
4 统计方法应用SPSS 20.0及GraphPad Prism 5软件进行统计及作图。计量资料服从正态分布,用均数±标准差(x±s)表示,多组比较,采用单因素方差分析,组间两两比较进行LSD检验,P < 0.05表示差异有统计学意义。
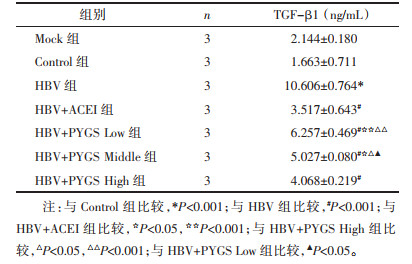
5 结果 5.1 各组HK-2细胞形态的变化药物干预HK-2细胞48 h后,将各组细胞置于倒置显微镜下,观察各组细胞的形态变化。Mock组、Control组细胞为上皮细胞形态,圆形或者椭圆形,铺路样生长,两组细胞形态无明显差异;HBV组细胞变大,变长,细胞大小形态不等,主要呈梭形,也可见多角形;西药组(贝那普利组)细胞形态为圆形或椭圆形,铺路样生长;中药低剂量和中剂量组细胞形态比HBV组细胞形态好转,但仍有不同程度的细胞变形,变长,变为梭形;中药高剂量组细胞为圆形或椭圆形,呈铺路样生长,细胞形态更接近上皮细胞,明显好转于HBV组,也好转于中药低剂量和中剂量组,但与西药组比较差异不明显。见图 1。
|
| 图 1 各组HK-2细胞形态的变化(标尺:192 μm) Fig. 1 The morphological changes of HK-2 cells in each group (bar: 192 μm) |
应用ELISA法检测各组细胞裂解液中HBsAg的表达浓度情况,与Mock组比较,Control组无明显变化,差异无统计学意义(P>0.05);与Control组比较,HBV组HBsAg表达明显上调,差异有统计学意义(P < 0.001);与HBV组比较,HBV+ACEI组、HBV+ PYGS High组HBsAg表达下调,差异有统计学意义(P < 0.05),HBV+ PYGS Low组和HBV+ PYGS Middle组HBsAg表达有所下调,但差异无统计学意义(P>0.05);与HBV+ACEI组比较,培元固肾方各组HBsAg表达无明显变化,差异无统计学意义(P>0.05);培元固肾方各组间比较,HBsAg表达无明显变化,差异无统计学意义(P>0.05)。见表 1。
 |
应用ELISA法检测各组HBeAg的表达浓度情况,与Mock组比较,Control组无明显变化,差异无统计学意义(P>0.05);与Control组比较,HBV组HBeAg表达明显上调,差异有统计学意义(P < 0.001);与HBV组比较,HBV+ACEI组HBeAg表达下调,但差异无统计学意义(P>0.05),HBV+ PYGS Low组、HBV+ PYGS Middle组、HBV+ PYGS High组HBeAg表达下调,差异有统计学意义(P < 0.05);与HBV+ACEI组比较,HBV+PYGS Low组、HBV+PYGS Middle组、HBV+ PYGS High组HBeAg表达相对较低,但差异无统计学意义(P>0.05);培元固肾方各组间比较,HBeAg表达无明显变化,差异无统计学意义(P>0.05)。见表 1。
5.2.2 ELISA法检测各组TGF-β1的表达应用ELISA法检测各组细胞裂解液中TGF-β1的表达浓情况,与Mock组比较,Control组TGF-β1表达相近,差异无统计学意义(P>0.05),与Control组比较,HBV组TGF-β1表达上调,差异有统计学意义(P < 0.01);与HBV组比较,HBV+ACEI组、HBV+ PYGS Low组、HBV+ PYGS Middle组、HBV+ PYGS High组TGF-β表达均有下调,差异有统计学意义(P < 0.001);与HBV+ACEI组比较,HBV+ PYGS Low组TGF-β1的表达相对较高,差异有统计学意义(P < 0.001),HBV+ PYGS Middle组TGF-β1的表达相对较高,差异有统计学意义(P < 0.05),HBV+ PYGS High组TGF-β1的下调程度相近,差异无统计学意义(P>0.05);培元固肾方各组组间比较,与HBV+ PYGS High组比较,HBV+ PYGS Low组TGF-β1表达相对较多,差异有统计学意义(P < 0.001),HBV+ PYGS Middle组TGF-β1的表达相对较多,差异有统计学意义(P < 0.05),HBV+ PYGS Low组与HBV+ PYGS Middle组比较,TGF-β1的表达相对较多,差异有统计学意义(P < 0.05)。见表 2。
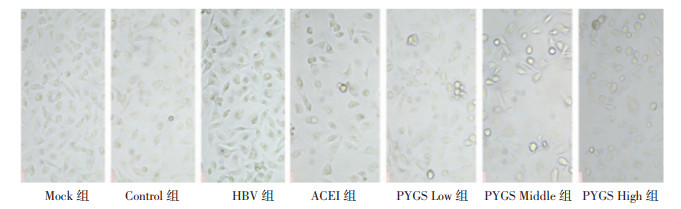
免疫细胞化学法检测α-SMA蛋白表达情况,与Mock组比较,Control组无明显变化,差异无统计学意义(P>0.05);与Control组比较,HBV组α-SMA蛋白表达明显上调,差异有统计学意义(P < 0.001);与HBV组比较,HBV+ACEI组、HBV+ PYGS Low组、HBV+ PYGS Middle组、HBV+ PYGS High组α-SMA蛋白表达明显下调,差异有统计学意义(P < 0.001);与HBV+ACEI组比较,培元固肾方低、中、高剂量组α-SMA蛋白表达均无明显变化,差异无统计学意义(P>0.05);培元固肾方各组组间比较,α-SMA蛋白表达无明显变化,差异无统计学意义(P>0.05),见表 3。HBV组较Mock组和Control组比较,细胞胞质呈棕黄色;与HBV组比较,各治疗组细胞胞质棕黄色颗粒均有不同程度的减少,且减少明显,见图 2。
 |
|
| 图 2 各组α-SMA表达结果(标尺:19 μm) Fig. 2 Expression of α-SMA in each group (bar: 19 μm) |
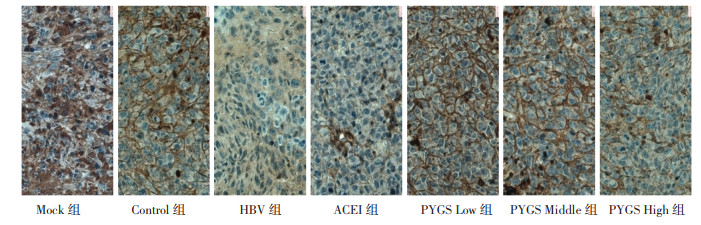
免疫细胞化学法检测E-cadherin蛋白的表达:与Mock组比较,Control组无明显变化,差异无统计学意义(P>0.05);与Control组比较,HBV组E-Cadherin蛋白表达明显下调,差异有统计学意义(P < 0.001);与HBV组比较,HBV+ACEI组E-Cadherin蛋白表达上调,差异有统计学意义(P < 0.05),HBV+ PYGS Low组、HBV+ PYGS Middle组和HBV+ PYGS High组E-Cadherin蛋白表达明显上调,差异有统计学意义(P < 0.001);与HBV+ACEI组比较,HBV+ PYGS Low组表达上调,差异有统计学意义(P < 0.05);培元固肾方各组组间比较,与HBV+ PYGS Low组比较,HBV+ PYGS Middle组和HBV+ PYGS High组E-Cadherin蛋白表达下调,差异有统计学意义(P < 0.05),见表 3。HBV组较Mock组和Control组比较,细胞胞浆内棕黄色颗粒减少,E-Cadherin蛋白表达明显降低,其余治疗组较HBV组比较,胞浆内棕黄色颗粒均有不同程度的增多,E-Cadherin蛋白表达明显增多,尤其是HBV+ PYGS Low组,见图 3。
|
| 图 3 各组E-cadherin表达结果(标尺:19 μm) Fig. 3 Expression of E-cadherin in each group(bar: 19 μm) |
HBV-GN根据其临床症状,可归属于中医的“尿浊”“水肿”“瘀血”“郁证”“肾风”“黄疸”“虚劳”等范畴。王耀光教授认为本病属本虚标实之证,本虚与标实共存,本为体虚,肝脾肾亏虚,标为邪实,湿热痰浊瘀血毒邪等。王耀光教授在治疗HBV-GN肾间质纤维化时,尤重视脾肾两脏,以其本虚为主要矛盾,吕仁和教授[8]亦认为肾间质纤维化的根本原因是正气亏虚,气血不足。故王耀光教授基于培补脾肾、祛风活血、肝肾同治的治疗原则,自拟“培元固肾方”,药物组成为:生黄芪、炒白术、地龙、蝉蜕、防风、金樱子、芡实、鬼箭羽、丹参、覆盆子、泽兰、槐花。培元固肾方中含有玉屏风散,此方也是王耀光主任治疗慢性肾炎的常用方、常用思路,补益肺脾,防止治疗过程出现不同程度的外感而加重病情,导致功亏一篑,扶正又兼祛邪,又可避免闭门留寇,故在针对性治疗时首先保证个体一个相对稳定的状态,则可提高治疗效果。诸药合用,标本兼治,共奏培补脾肾、祛风搜络、疏肝养血、活血祛瘀之功。
培元固肾方尤重视脾肾两脏,其中兼顾肾络微型癥瘕、从风论治、肝肾同源理论。1)尤重视脾肾:王耀光教授在治疗HBV-GN肾间质纤维化时,尤重视脾肾两脏。HBV-GN患者免疫功能低下在中医属脾肾两虚,脾肾为生命能量之源,两者相互依存,一荣俱荣,一损俱损。故在治疗HBV-GN的本虚时,必须先后天同补。王耀光教授认为肾间质纤维化的形成和抗纤维化的同时都是消耗正气的过程,故在治疗肾间质纤维化的同时,补益脾肾具有重要的作用,可明显提高其抗纤维化疗效。2)瘀血(肾络微型癥瘕理论):“肾络微型癥瘕”理论由著名中医专家吕仁和教授最早提出,是在治疗慢性肾病时结合络病学相关知识,提出的肾络微癥瘕的理论及益气养血法的治疗原则。肾间质纤维化与“肾络微型癥瘕”在一定程度上具有一致性,因此,肾纤维化形成的根本原因,也是气血不足。王耀光教授在治疗肾间质纤维化时,活血祛瘀的同时也重视益气养血。3)从风论治:风邪是肾病起病的重要因素,王耀光教授在治疗HBV-GN时,重视风邪在HBV-GN发生发展过程中的作用,认为风邪是促进HBV-GN蛋白尿患者病机重要原因,在肾病的纤维化及硬化过程中也有着重要作用。风邪挟HBV侵袭人体后,稽留不去,日久入里,入于肾络,可导致肾络拙急,又因风邪流动不居,善行数变,入于体内,常可变幻为其他邪气,加重HBV-GN病情并使其迁延难愈。故在治疗肾间质纤维化时加祛风药,可祛其久居体内之风邪又可治疗风邪侵袭肾络导致的肾络拙急,从而延缓HBV-GN肾间质纤维化的进展。4)肝肾同源:肝肾关系密切,有着“肝肾同源”之说,两者关系主要表现在藏泄互用、精血同源以及相互滋生制约。两者相互协调又相互影响,故肝肾之病常肝肾同治。
HBV-GN为乙肝病毒表面抗原及e抗原引发的炎症免疫机制[9],是中国常见的继发性肾病。HBV-GN可逐渐发展为肾功能不全,最终导致慢性肾功能衰竭,而肾间质纤维化几乎是所有慢性肾脏疾病发展至终末期肾脏病的共同病理过程[4-5],是导致肾功能进行性衰竭的关键因素[6]。HBV-GN肾间质纤维化的发生机制,可能涉及多种炎症因子、细胞因子及信号通路。其中,肾小管上皮细胞-间充质细胞转分化(EMT)是肾间质纤维化发生和发展的重要机制[10],HBV感染机体后可直接感染肾脏,在上皮细胞上成功表达HBsAg和HBeAg,在肾小管上皮细胞持续表达介导其免疫炎症反应,导致转化生长因子TGF-β1的表达增多,有研究显示,TGF-β1又是诱导EMT过程的核心因子,且TGF-β1的表达量与肾间质纤维化程度成正相关[11],提示TGF-β1可能通过诱导MET的过程进而参与HBV-GN肾间质纤维化的进展。本研究中,培元固肾方可抑制促纤维化核心因子TGF-β1的表达,从而抑制EMT过程,对α-SMA蛋白表达具有明显的抑制作用,对E-Cadherin蛋白表达有明显上调作用,进而延缓其肾间质纤维化进展。
综上,肾间质纤维化是各种慢性肾脏疾病进展到终末期肾脏病的必经过程,培元固肾方对HBsAg、HBeAg的表达具有一定的抑制作用,并可明显抑制促纤维化因子TGF-β1的表达,从而抑制EMT过程,最终延缓HBV-GN肾间质纤维化的进展,同时也为中医药在防治HBV-GN肾间质纤维化中提供了一定的理论依据。
| [1] |
梅长林, 余学清. 内科学·肾脏内科分册[M]. 北京: 人民卫生出版社, 2017: 149. MEI C L, YU X Q. Internal medicine-division of nephrology[M]. Beijing: People's Medical Publishing House, 2017: 149. |
| [2] |
BHIMMA R, COOVADIA H M. Hepatitis B virus-associated nephropathy[J]. American Journal of Nephrology, 2004, 24(2): 198-211. DOI:10.1159/000077065 |
| [3] |
COMBES B, SHOREY J, BARRERA A, et al. Glomerulonephritis with deposition of Australia antigen-antibody complexes in glomerular basement membrane[J]. The Lancet, 1971, 298(7718): 234-237. DOI:10.1016/S0140-6736(71)92572-4 |
| [4] |
KHWAIA A, El KOSSI M, FLOEGE J, et al. The management of CKD:a look into the future[J]. Kidney International, 2007, 72: 1316-1323. DOI:10.1038/sj.ki.5002489 |
| [5] |
ZHANG L, ZHANG P, WANG F Z, et al. Prevalence and factors associated with CKD:a population study from Beijing[J]. American Journal of Kidney Diseases, 2008, 51: 373-384. DOI:10.1053/j.ajkd.2007.11.009 |
| [6] |
HAGHIKIA A, HILFIKER K D. MiRNA-21:a key to controlling the cardiac fibroblast compartment[J]. Cardiovascular research, 2009, 82(1): 1-3. |
| [7] |
徐慧. HBV对人近端肾小管上皮细胞的转分化作用及其机制的研究[D].济南: 济南大学, 2013. XU H. Study on the transdifferentiation effect and mechanism of HBV on human renal tubular epithelial cells[D]. Jinan: Jinan University, 2013. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y2364582 |
| [8] |
刘乐. 吕仁和从益气养血论治"肾络微型癥瘕"[J]. 环球中医药, 2018, 11(12): 1938-1939. LIU L. LV Renhe's treatment of "kidney collateral Micro syndrome" from the perspective of benefiting qi and nourishing blood[J]. Global Traditional Chinese Medicine, 2018, 11(12): 1938-1939. |
| [9] |
TAKEKOSHI Y, TOCHIMARU H, NAGATA Y, et al. Immunopathogenetic mechanisms of hepatitis B virus-related glomerulopathy[J]. Kidney International Supplements, 1991, 35: S34-S39. |
| [10] |
LE B V S, TADURI G, O'CONNELL J, et al. Origin and function of myofibroblasts in kidney fibrosis[J]. Nature Medicine, 2013, 19(8): 1047-1053. DOI:10.1038/nm.3218 |
| [11] |
魏丽芳, 庄永泽, 余英豪, 等. CTGF和TGF-β1在乙肝病毒相关性肾炎中的表达及其意义[J]. 中国中西医结合肾病杂志, 2010, 11: 770-773, 851. WEI L F, ZHUANG Y Z, YU Y H, et al. Expression and significance of connective tissue growth factor and transforming growth factor-β1 in HBV-associated glomerulonephritis[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2010, 11(9): 770-773, 851. |
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300381, China
 2020, Vol. 37
2020, Vol. 37