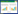文章信息
- 闫海峰, 王贤良, 王帅, 侯雅竹, 杨志华, 胡珍, 毛静远
- YAN Haifeng, WANG Xianliang, WANG Shuai, HOU Yazhu, YANG Zhihua, HU Zhen, MAO Jingyuan
- 优化新生脉散方治疗心力衰竭的网络药理学机制分析
- Analysis of network pharmacology mechanism of Optimized New Shengmai Powder in treating heart failure
- 天津中医药, 2020, 37(10): 1176-1182
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(10): 1176-1182
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.10.22
-
文章历史
- 收稿日期: 2020-05-20
2. 国家中医针灸临床医学研究中心, 天津 300381
优化新生脉散方是基于天津中医药大学第一附属医院治疗慢性心力衰竭(CHF)的验方研制而成的中药制剂,由生黄芪、党参、刺五加、丹参、鳖甲(醋制)、茯苓、葶苈子、麦门冬、枳壳9味中药组成,具有益气活血利水的功效。在“重大新药创制”科技重大专项(编号:2010ZX09102-202)的支持下完成了优化新生脉散方临床前研究。研究表明优化新生脉散方能改善心力衰竭患者生存质量、增加6 min步行距离及提高射血分数[1-3],研究显示优化新生脉散方具有抗炎、抗氧化、保护心肌损伤的作用[4],但尚未有研究从网络药理层面系统阐明其机制。网络药理学是以中药药理学、生物化学、结构生物学、基因组学与生物信息学等为一体的新兴领域[5],突出了“多成分、多靶点、多通路”的特点,为深入挖掘中药复方治疗疾病的作用机制提供新思路。笔者基于网络药理学的研究方法,初步系统挖掘及分析优化新生脉散方治疗CHF的可能作用机制,为优化新生脉散方的应用和实验验证提供参考依据。
1 材料与方法 1.1 候选活性成分及靶点的筛选基于中药系统药理数据库和分析平台(TCMSP)(http://tcmspw.com/tcmsp.php)[6]以“黄芪、党参、丹参、茯苓、葶苈子、枳壳”为关键词,OB≥30%及DL≥0.18作为限定条件,从中获取符合条件的活性成分,进而得到相应的靶蛋白,通过UniProt数据库(https://www.uniprot.org/)获得靶蛋白名称的人源靶点基因。余下中药“鳖甲、刺五加、麦门冬”通过BATMAN-TCM数据库取Score cutoff≥20的化合物,并提取化合物相应靶点以补充优化新生脉散方药物靶点。
1.2 CHF候选靶点的筛选GeneCards数据库(http://www.genecards.org/)是以基因、转录组、蛋白质组、遗传等信息的综合数据库[7],登录GeneCards主页面,输入关键词“Chronic Heart Failure”,得到CHF的相关基因,以相关性分值(Relevance score)大于20为筛选条件,获得符合条件的基因作为疾病候选靶点。
1.3 网络构建将优化新生脉散方药物筛选的主要活性成分靶点与CHF的候选靶点通过OmicShare网站相互映射得到两者重合基因,即潜在靶点。通过潜在靶点获得相应的潜在化合物及其所属中药名称,并利用Cytoscape-v3.6.0软件建立中药-潜在化合物-潜在靶点-疾病网络图。
1.4 GO功能及KEGG富集分析GO(Gene Ontology)是描述生物体中基因功能、基因及基因产物属性的一种基因功能分类体系,包括细胞组分(CC)、分子功能(MF)、生物过程(BP)3个部分,因不同基因在生物体内协同发挥相应的生物学功能,基于KEGG富集通路的分析更有助于了解基因的生物学功能。将89个潜在靶点导入DAVID6.8(http://david.abcc.ncifcrf.gov/)基因功能分析工具[8],Select identifier、List type分别设置为official gene symbol、gene list,物种限定为homo sapiens,点击Submit List进行GO功能及KEGG富集分析。同时。对潜在基因进行Gene ID Conversion,获得基因相对应的ENSG编码,以人类整个基因组为背景基因,将获取的ENSG编码导入OmicShare(www.omicshare.com/tools)网站进行KEGG通路注释数目分析。
2 结果 2.1 候选活性成分及靶点筛选结果以OB≥30%、DL≥0.18、Score cutoff≥20为限定条件,经TCMSP、BATMAN-TCM及UniProt数据库检索并剔除重复值得到候选活性成分187种及靶点520个。
2.2 CHF候选靶点筛选结果根据Relevance score>20的原则,通过GeneCards数据库检索CHF相关靶点1 107个,作为CHF候选靶点。
2.3 潜在化合物及靶点筛选结果通过OmicShare网站将优化新生脉散方候选靶点与CHF候选靶点相互映射得到潜在靶点89个及其对应的潜在化合物85种,并根据潜在靶点与化合物可知所属中药名称,见表 1。
 |
中药-潜在化合物-潜在靶点-疾病网络共有184个节点,721条边,见图 1。其中,蓝色节点代表中药及疾病名称,黄色节点代表潜在化合物,共85种,见表 1,红色节点代表潜在靶点,共有89个。网络分析中,节点自由度(边与边的数目)的大小表明节点在网络中的重要程度。根据网络拓扑分析显示,自由度较高的潜在化合物为槲皮素(quercetin)、木犀草素(luteolin)、山奈酚(kaempferol)等,潜在靶点为SCN5A、ADRB2、NOS2等。

|
| 图 1 中药-潜在化合物-潜在靶点-疾病网络图 Fig. 1 Traditional Chinese medicine-potential compound-potential target-disease network diagram |
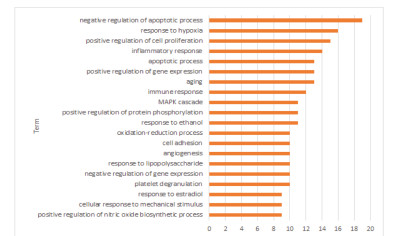
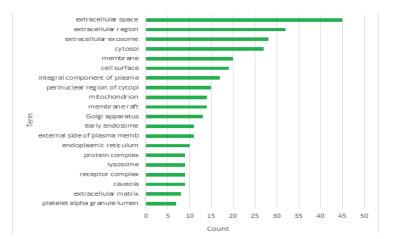
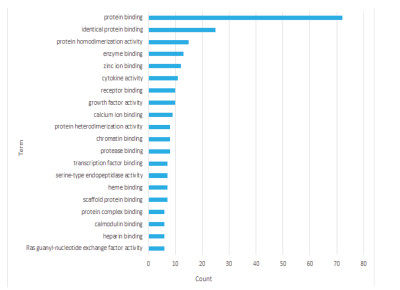
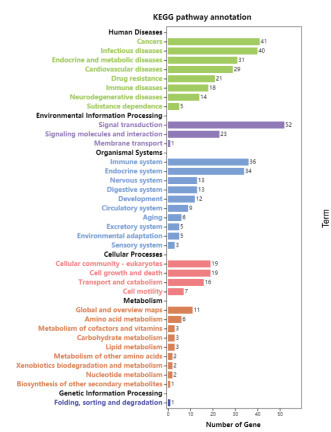
利用DAVID数据库得到潜在基因GO功能富集497条(P < 0.05),其中,生物过程(BP)382条,细胞组分(CC)50条,分子功能(MF)65条,根据基因富集数目多少分别取前20条(P < 0.05)信息绘制成图,见图 2、3、4。图中可知优化新生脉散方治疗CHF的潜在靶点富集的BP主要有细胞凋亡、增殖、缺氧反应等,CC主要与细胞外间隙、胞外区、胞外体有关,MF主要涉及蛋白结合、蛋白同源二聚体活性较多。KEGG通路富集筛选得出139条(P < 0.05),并通过OmicShare网站获得潜在基因相对背景基因的KEGG通路注释数目,见图 5。针对“信号转导”模块进一步分析并取排前20条(P < 0.05)富集信息绘制成图,见图 6。其中,Ratio指潜在基因与位于该pathway条目的基因总数的比值,Ratio值越大,表示富集程度越高。气泡大小代表基因数目的多少,气泡越大,富集到该pathway的基因数目越多;气泡颜色表示显著性的高低,颜色越红显著性越高。结果显示潜在基因主要富集在缺氧诱导因子-1(HIF-1)、磷脂酰肌醇3激酶/蛋白激酶B(PI3K-Akt)、肿瘤坏死因子(TNF)等信号通路。
|
| 图 2 GO功能富集生物过程(BP) Fig. 2 GO functional enrichment biological process (BP) |
|
| 图 3 GO功能富集生物过程(CC) Fig. 3 GO functional enrichment biological process (CC) |
|
| 图 4 GO功能富集生物过程(MF) Fig. 4 GO functional enrichment biological process (MF) |
|
| 图 5 KEGG通路注释数目图 Fig. 5 KEGG pathway annotation number diagram |

|
| 图 6 KEGG信号转导富集图 Fig. 6 Enrichment map of KEGG signal transduction |
心力衰竭是由多种因素造成心肌收缩/舒张功能障碍,导致心脏无法提供足够的血液满足周围组织代谢的需要,从而引起一组复杂的临床综合征。目前,心力衰竭的发病机制主要有炎症、氧化应激、线粒体功能障碍、心肌细胞凋亡及纤维化等[9-11],临床中对心力衰竭的治疗作用途径多比较单一,尽管有些药物在改善或治疗心力衰竭方面取得了进展,但心力衰竭的病死率、再住院率仍呈上升趋势[12-13],这为具有多成分、多靶点、多途径作用的中医药治疗心力衰竭提供了好的前景。
本研究利用网络药理学方法初步探讨了优化新生脉散方治疗CHF的活性成分、作用靶点及相关的信号通路。通过TCMSP平台及BATMAN-TCM、UniProt数据库检索发现,优化新生脉散方共有符合条件(OB≥30%、DL≥0.18、Scorecutoff≥20)的化合物187种,将其全部纳入本研究中,得到候选靶点520个,其中,与CHF相关的潜在靶点有89个,根据潜在靶点筛选出潜在化合物85种。对潜在靶点进行KEGG通路注释“信号转导模块”富集分析,结果显示主要涉及HIF-1、PI3K-Akt、TNF信号通路等,参与调控CHF发展过程的不同环节。
通过分析优化新生脉散方治疗CHF的化合物-靶点-信号通路预测优化新生脉散方发挥治疗CHF药效可能的化合物为槲皮素(quercetin)、木犀草素(luteolin)、山奈酚(kaempferol)等85种化学成分。研究表明槲皮素可抑制心肌纤维化及氧化应激反应保护心脏的作用,其机制可通过降低丙二醛(MDA)、升高超氧化物歧化酶(SOD)及抑制活性氧(ROS)介导的丝裂原活化蛋白激酶(MAPK)信号通路的激活[14-15];木犀草素可通过提高心力衰竭大鼠肌浆网Ca2+-ATP酶(SERCA2a)蛋白表达及激活PI3K/Akt信号通路,改善心肌细胞收缩功能障碍[16];山奈酚具有减轻炎症和氧化应激防止血管紧张素Ⅱ诱导的胶原积累引起心室重构的作用,其机制可能与调控核因子(NF)-κB/MAPK及AMPK/Nrf2通路有关[17]。
此项研究所预测出优化新生脉散方治疗CHF中85种潜在化合物与SCN5A、ADRB2及NOS2等89个潜在靶点有着密切联系,其中,SCN5A是电压门控钠离子通道的编码基因,在调控心脏动作电位的去极化及细胞间传导过程中起着重要作用[18],SCN5A蛋白表达水平的下调导致心脏钠电流的降低,进而增加心力衰竭猝死的风险[19-21]。实验表明ADRB2蛋白表达水平的升高可促进心力衰竭大鼠心肌细胞收缩功能[22-23],改善心力衰竭症状,而NOS2可产生足够数量的一氧化氮(NO)抑制心肌细胞的功能,从而降低衰竭心脏的肌力状态,加速心力衰竭的进展[24]。富集分析显示潜在靶点主要集中在HIF-1、PI3K-Akt、TNF等信号通路,研究表明在缺氧状态下,通过激活HIF-1通路维持机体氧稳态及心脏有效的收缩功能,HIF-1的缺乏可引起血管生成障碍和心肌纤维化,从而导致心力衰竭的发展[25]。PI3K-Akt信号通路的激活影响CHF大鼠相关凋亡蛋白的表达,发挥保护心肌的效应[26]。TNF分为TNFα与TNFβ两种,其激活引起肥大细胞分泌促炎细胞因子白介素(IL)-6,TNFα及IL-6可作为心力衰竭的潜在标记物,与心力衰竭的发展有着密切联系[27-31]。由此可见,优化新生脉散方通过多种化合物调节多个靶点及多条通路,从而起到改善CHF的作用。
综上所述,通过网络药理学的方法对优化新生脉散方治疗CHF进行综合分析,预测了优化新生脉散方治疗CHF的潜在靶点及信号通路,这为深入研究优化新生脉散方药效的作用机制提供参考。
| [1] |
吴志贵. 优化新生脉散方和新生脉散原方在治疗慢性心力衰竭气虚血瘀水饮证中的效果对比[J]. 现代诊断与治疗, 2017, 28(22): 4136-4137. WU Z G. The effect comparison of Optimized New Shengmai Powder and Xinshengmai San in treating chronic heart failure syndrome of qi deficiency and blood stasis[J]. Modern Diagnosis and Treatment, 2017, 28(22): 4136-4137. |
| [2] |
王贤良, 袁杨, 毛静远, 等. 优化新生脉散方联合西药治疗慢性心力衰竭单病例交叉随机对照研究[J]. 中医杂志, 2015, 56(21): 1849-1853. WANG X L, YUAN Y, MAO J Y, et al. Optimized New Shengmai Powder Combined with Western Medicine Treating Chronic Heart Failure:a N-of-1 Crossover Study[J]. Journal of Traditional Chinese Medicine, 2015, 56(21): 1849-1853. |
| [3] |
李中珂. 优化新生脉散方联合西药治疗慢性心力衰竭的临床效果观察[J]. 中医临床研究, 2016, 8(28): 20-22. LI Z K. Effective observation on treating CHF with Xin Shengmai San plus western medicine[J]. Clinical Journal of Chinese Medicine, 2016, 8(28): 20-22. |
| [4] |
庞磊, 毛静远, 万蝉俊, 等. 新生脉散优化方对阿霉素致小鼠心肌损伤保护作用的研究[J]. 吉林中医药, 2012, 32(7): 712-715. PANG L, MAO J Y, WAN C J, et al. Study on the protective effect of Optimized New Shengmai Powder on myocardial injury induced by adriamycin in mice[J]. Jilin Journal of Traditional Chinese Medicine, 2012, 32(7): 712-715. |
| [5] |
王永华, 杨凌. 基于系统药理学的现代中药研究体系[J]. 世界中医药, 2013, 8(7): 801-808. WANG Y H, YANG L. Systems pharmacology-based research framework of traditional Chinese medicine[J]. World Chinese Medicine, 2013, 8(7): 801-808. |
| [6] |
RU J, LI P, WANG J, et al. TCMSP:a database of systems pharmacology fordrug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6: 13. DOI:10.1186/1758-2946-6-13 |
| [7] |
REBHAN M, CHALIFA C V, PRILUSKY J, et al. GeneCards:a novel functional genomics compendium with automated data mining and query reformulation support[J]. Bioinformatics, 1998, 14(18): 656-664. |
| [8] |
HUANG D W, SHERMAN B T, LEMPICKI R A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J]. Nature Protocols, 2009, 4(1): 44-57. DOI:10.1038/nprot.2008.211 |
| [9] |
SHINDE A V, FRANGOGIANNIS N G. Fibroblasts in myocardial infarction:a role in inflammation and repair[J]. Journal of Molecular and Cellular Cardiology, 2014, 70: 74-82. DOI:10.1016/j.yjmcc.2013.11.015 |
| [10] |
MOOREoore M T, GUIMARAES C N, YUTZEY K E, et al. Cardiac fibroblasts:from development to heart failure[J]. Journal of molecular medicine (Berlin, Germany), 2015, 93(8): 823-830. DOI:10.1007/s00109-015-1314-y |
| [11] |
YU M, ZHENG Y, SUN H X, et al. Inhibitory effects of enalaprilat on rat cardiac fibroblast proliferation via ROS/P38MAPK/TGF-β1 signaling pathway[J]. Molecules, 2012, 17(3): 2738-2751. DOI:10.3390/molecules17032738 |
| [12] |
BENJAMIN E J, MUNTNER P, ALONSO A, et al. Heart disease and stroke statistics-2019 update:A report from the American Heart Association[J]. Circulation, 2019, 139(10): e56-e528. |
| [13] |
WRIGHT J S, WALL H K, RITCHEY M D. Million hearts 2022:small steps are needed for cardiovascular disease prevention[J]. JAMA, 2018, 320(18): 1857-1858. DOI:10.1001/jama.2018.13326 |
| [14] |
李敏.槲皮素及其糖苷衍生物芦丁对心肌纤维化的抑制作用及机制研究[D].长春: 吉林大学, 2014. LI M. Inhibition of isoproterenol-induced cardiac fibrosis in rat by quercetin and its glycoside derivative rutin[D]. Changchun: Jilin University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10183-1014266158.htm |
| [15] |
ZAKARIA N, KHALIL S R, AWAD A, et al. Quercetin reverses altered energy metabolism in the heart of rats receiving adriamycin chemotherapy[J]. Cardiovascular Toxicology, 2018, 18(2): 109-119. DOI:10.1007/s12012-017-9420-4 |
| [16] |
HU W, XU T, WU P, et al. Luteolin improves cardiac dysfunction in heart failure rats by regulating sarcoplasmic reticulum Ca2+-ATPase 2a[J]. Scientific Reports, 2017, 7: 41017. DOI:10.1038/srep41017 |
| [17] |
DU Y, HAN J, ZHANG H, et al. Kaempferol prevents against Ang Ⅱ-induced cardiac remodeling through attenuating Ang Ⅱ-induced inflammation and oxidative stress[J]. Journal of cardiovascular pharmacology, 2019, 74(4): 326-335. DOI:10.1097/FJC.0000000000000713 |
| [18] |
ZHANG X, YOON J Y, MORLEY M, et al. A common variant alters SCN5A-miR-24 interaction and associates with heart failure mortality[J]. Journal of Clinical Investigation, 2018, 128(3): 1154-1163. DOI:10.1172/JCI95710 |
| [19] |
GAO G, BRAHMANANDAM V, RAICU M, et al. Enhanced risk profiling of implanted defibrillator shocks with circulating SCN5A mRNA splicing variants:a pilot trial[J]. Journal of the American College of Cardiology, 2014, 63(21): 2261-2269. DOI:10.1016/j.jacc.2014.02.588 |
| [20] |
GAO G, XIE A, HUANG S C, et al. Role of RBM25/LUC7L3 in abnormal cardiac sodium channel splicing regulation in human heart failure[J]. Circulation, 2011, 124(10): 1124-1131. DOI:10.1161/CIRCULATIONAHA.111.044495 |
| [21] |
SHANG L L, PFAHNL A E, SANYAL S, et al. Human heart failure is associated with abnormal C-terminal splicing variants in the cardiac sodium channel[J]. Circulation Research, 2007, 101(11): 1146-1154. DOI:10.1161/CIRCRESAHA.107.152918 |
| [22] |
高子任, 隋殿军. 人参缩心饮通过β2肾上腺素受体对心衰大鼠心肌细胞收缩功能的影响[J]. 中华中医药杂志, 2015, 30(5): 1499-1503. GAO Z R, SUI D J. Myocardial contractile function of Ginseng Drink for shrink heart by affecting the β2-AR cells in heart failure rats[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2015, 30(5): 1499-1503. |
| [23] |
孙红, 常爱民, 张洋, 等. β2肾上腺素受体表达增加对心衰大鼠心肌细胞收缩功能的影响[J]. 中国应用生理学杂志, 2007, 23(4): 410-414. SUN H, CHANG A M, ZHANG Y, et al. Effects of overexpression of β2-adrenoceptor on contraction in cardiac myocytes isolated from failure hearts of rats[J]. Chinese Journal of Applied Physiology, 2007, 23(4): 410-414. |
| [24] |
LINKE A, RECCHIA F, ZHANG X, et al. Acute and chronic endothelial dysfunction:implications for the development of heart failure[J]. Heart Failure Reviews, 2003, 8(1): 87-97. DOI:10.1023/A:1022151106019 |
| [25] |
WEI H, BEDIA D, KOITABASHI N, et al. Endothelial expression of hypoxia-inducible factor 1 protects the murine heart and aorta from pressure overload by suppression of TGF-β signaling[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(14): E841-E850. DOI:10.1073/pnas.1202081109 |
| [26] |
杨嘉豪, 崔瑞琴, 周波, 等. 温阳消饮方对慢性心力衰竭大鼠PI3K-Akt信号通路表达及相关凋亡蛋白的影响[J]. 中华中医药杂志, 2020, 35(1): 145-149. YANG J H, CUI R Q, ZHOU B, et al. Effects of Wenyang Xiaoyin Formula on the expression of PI3K-Akt signal pathway and related apoptotic proteins in chronic heart failure rats[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2020, 35(1): 145-149. |
| [27] |
张慧云, 杨靖, 龙星男, 等. TNF刺激肥大细胞IL-6分泌的信号转导通路[J]. 细胞与分子免疫学杂志, 2011, 27(8): 829-831. ZHANG H Y, YANG J, LONG X N, et al. Signal transduction pathway for TNF-induced IL-6 release from mast cells[J]. Chinese Journal of Cellular and Molecular Immunology, 2011, 27(8): 829-831. |
| [28] |
MOHAN M L, VASUDEVAN N T, NAGA P S V. Proinflammatory cytokines Mediate GPCR dysfunction[J]. Journal of Cardiovascular Pharmacology, 2017, 70(2): 61-73. |
| [29] |
HARTUPEE J, MANN D L. Positioning of inflammatory biomarkers in the heart failure landscape[J]. Journal of Cardiovascular Translational Research, 2013, 6(4): 485-492. DOI:10.1007/s12265-013-9467-y |
| [30] |
UELAND T, GULLESTAD L, NYMO S H, et al. Inflammatory cytokines as biomarkers in heart failure[J]. Clinica Chimica Acta, 2015, 443: 71-77. DOI:10.1016/j.cca.2014.09.001 |
| [31] |
BIRKS E J, LATIF N, OWEN V, et al. Quantitative myocardial cytokine expression and activation of the apoptotic pathway in patients who require left ventricular assist devices[J]. Circulation, 2001, 104(12 Suppl 1): I233-I240. |
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China
 2020, Vol. 37
2020, Vol. 37