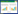文章信息
- 张露丹, 王金, 张美英, 刘丹
- ZHANG Ludan, WANG Jin, ZHANG Meiying, LIU Dan
- 补阳还五汤治疗糖尿病周围神经病变的网络药理学分子机制研究
- Study on the molecular mechanism of Buyang Huanwu Decoction in treating diabetic peripheral neuropathy by network pharmacology
- 天津中医药, 2020, 37(10): 1183-1189
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(10): 1183-1189
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.10.23
-
文章历史
- 收稿日期: 2020-07-10
2. 天津市武清区中医医院, 天津 301700
糖尿病周围神经病变(DPN)是糖尿病最常见的一种并发症[1]。其临床表现多种多样,四肢对称性疼痛、感觉异常、肢端麻木、针刺痛及灼热感等为其主要的症状[2-3]。晚期则可能会出现如肌无力、肌萎缩、平衡受损等运动功能障碍的表现[4]。DPN亦是致使糖尿病足部溃疡、坏疽及非创伤性下肢截肢的常见病因,并且持续性的慢性疼痛可使患者睡眠及生活质量严重下降。研究显示,随着糖尿病的进展,至少50%的患者会发展为DPN[5],且多达50%的DPN患者没有明显的临床症状[6],因此对DPN的早期筛查和及时治疗十分重要。
DPN的发生机制较为复杂,如氧化应激、葡萄糖代谢异常、神经营养改变等,现代医学的治疗方法包括控制血糖、改善微循环、抗氧化、营养及修复神经等对症治疗[7]。中医认为本病的基本病机是气阴两虚、脉络瘀阻,益气活血通络为其基本治法[8]。补阳还五汤出自清代王清任所著的《医林改错》,是目前针对气阴两虚夹瘀型DPN使用最多的方剂。近年来,补阳还五汤治疗DPN的研究也有较为全面的报道,临床研究证实该方对治疗DPN有确切疗效[9-11]。笔者拟运用网络药理学的方法,对补阳还五汤治疗DPN的分子机制进行探讨,为后期的深入研究提供方向。
1 方法 1.1 补阳还五汤活性成分的筛选及作用靶点的收集利用中药系统药理学分析平台[12](TCMSP)(http://tcmspw.com/tcmsp.php),查找补阳还五汤中的黄芪、赤芍、川芎、当归、桃仁、红花6味药的化学成分,TCMSP数据库未收录地龙的化学成分,通过化学专业数据库(http://www.organchem.csdb.cn/scdb/default.asp)进行补充检索。以OB≥30%,DL≥0.18为条件对化学成分进行筛选,得到中药的活性成分,再利用TCMSP数据库查找活性成分对应的靶点,通过UniProt数据库(https://www.uniprot.org/)[13]查找靶蛋白的基因名,将其转化为相对应的基因简称。
1.2 DPN疾病靶点的获取及补阳还五汤疗DPN潜在作用靶点的预测在Drugbank(https://www.drugbank.ca/)[14]、GeneCards数据库(https://www.genecards.org/)[15]输入疾病名称“diabetic peripheral neuropathy”进行检索,将筛选结果合并,保留唯一值后获得DPN疾病靶点集。并与上述补阳还五汤的作用靶点取交集,得到补阳还五汤治疗DPN的潜在靶点。
1.3 关键作用靶点的筛选及蛋白相互作用(PPI)网络的构建将补阳还五汤治疗DPN的潜在作用靶点导入STRING数据库(http://stringdb.org/),“Organism”选择“Homo sapiens”,将置信度得分设置为“highest confidence(≥0.9)”,剔除孤立于网络之外的靶点,得到核心靶点,将此作为补阳还五汤治疗DPN的关键作用靶点。将获取的蛋白相互作用关系,保存为TSV格式,保留文件中node1、node2及Combine score信息,并导入Cytoscape 3.7.2软件,构建PPI网络。再利用“Generate style from statistics”工具对网络样式进行设置,其中,节点(node)的大小和渐变颜色反映Degree值的大小,边(edge)的粗细反映蛋白之间相互作用的强弱。
1.4 “补阳还五汤-活性成分-关键作用靶点”网络的构建为了更直观地显示相互作用关系,将中药、活性成分和关键作用靶点信息整理为Excel表上传至Cytoscape3.7.2软件,并构建补阳还五汤-活性成分-关键作用靶点网络,使得中药、活性成分与靶点关系达到可视化,以探究补阳还五汤治疗DPN的分子作用机制,并用于评价补阳还五汤中的活性成分及治疗DPN的靶点的重要性。
1.5 GO富集分析和KEGG通路富集分析使用R软件对“1.3”得到的关键作用靶点进行GO富集分析和KEGG通路富集分析,设定阈值P < 0.05为筛选标准,将结果以柱状图与气泡图的形式输出。利用R软件将所有关键作用靶点映射到KEGG数据库的通路上,下载关键靶点所参与的通路图进行分析与研究。
1.6 “补阳还五汤-活性成分-靶点-KEGG通路”网络的构建将上述可能参与到DPN过程的前20条KEGG信号通路,与药物、活性成分及参与调控的靶点一起整理为Excel表,上传至Cytoscape 3.7.2软件,构建补阳还五汤-活性成分-靶点-KEGG通路网络,再利用“Generate style from statistics”工具对网络样式进行渲染,Degree值越高,相应节点越大,在网络中重要。
2 结果 2.1 补阳还五汤成分及作用靶点的收集通过TCMSP、化学专业数据库,查询补阳还五汤7味药的化学成分,去重后得到691个成分。其中,黄芪87个、赤芍75个、川芎189个、当归125个、桃仁66个、红花189个、地龙35个。以OB≥ 30%及DL≥ 0.18作为潜在的活性成分筛选条件,共得到81个符合条件的化合物,其中黄芪17个、赤芍17个、川芎6个、当归2个、桃仁19个、红花17个、地龙15个。将结果进行OB值排序,川芎中的川芎哚(Perlolyrine)、杨梅酮(Myricanone),赤芍中的芍药吉酮(paeoniflorgenone)、芍药苷(paeoniflorin),红花中的6-羟基山奈酚(6-Hydroxykaempferol)、醌式红花苷(qt_carthamone)、六羟黄酮(quercetagetin)、木酚素(lignan)、山柰酚(kaempferol),黄芪中的7-O-甲基异微凸剑叶莎醇(7-O-methylisomucronulatol)、刺芒柄花素(formononetin),桃仁中的赤霉素A44(Gibberelln A44)等成分的OB值较高,表明这些成分的活性较高。再利用TCMSP数据库依次查找81个活性成分的靶点,搜索的结果经过筛选去重后共得到238个相应作用靶点。
2.2 补阳还五汤疗DPN潜在作用靶点的预测通过Drugbank、GeneCards数据库分别获得DPN疾病靶点10个、4 333个,合并去重后共获得4 334个DPN疾病相关靶点。将补阳还五汤活性成分作用靶点与DPN疾病靶点相匹配,并通过Venny 2.1.0在线工具(https://bioinfogp.cnb.csic.es/tools/venny/)绘制韦恩图,得到补阳还五汤治疗DPN的潜在靶点154个,见图 1,其中,黄芪78个、当归34个、赤芍45个、川芎23个、桃仁33个、红花77个、地龙67个。再将以上7味药治疗疾病的靶点取交集,得到7味药的共同靶点8个:PRSS1、ADH1C、NOS2、NOS3、ADRB2、PTGS2、F2、PTGS1,提示补阳还五汤可能通过上述共同靶点起到协同治疗DPN的作用。

|
| 图 1 补阳还五汤与DPN疾病靶点相互匹配韦恩图 Fig. 1 Venn diagram of Buyang Huanwu Decoction and DPN disease targets matching each other |
将补阳还五汤治疗DPN的154个潜在作用靶点上传至STRING数据库,获得满足筛选条件的核心靶点124个,并将得到的蛋白相互作用信息输入Cytocape软件绘制PPI网络,见图 2。图中共有124个节点,329条边,节点平均Degree为5.350,其中靶点蛋白MAPK1、SRC、JUN、HSP90AA1、CTNNB1、VEGFA、TNF、TP53、ESR1、MAPK14、MAPK8、AGXT、APP、NR3C1、EGFR、IL6、F2的Degree值在平均Degree值的2倍以上,提示上述蛋白在PPI网络中有重要作用。
|
| 图 2 PPI网络 Fig. 2 Protein-protein interaction network |
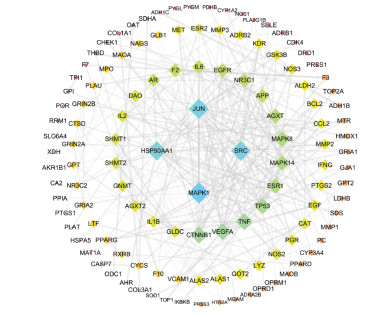
利用Cytoscape软件将7味中药、活性成分及124个关键作用靶点构建补阳还五汤-活性成分-关键作用靶点网络,见图 3。整个网络共204个节点,904条边,其中橙红色节点有7个,蓝色节点有73个,黄色节点有124个,分别代表构成补阳还五汤的药物、活性成分及其关键作用靶点。并对网络进行拓扑分析,节点的平均Degree为8.863,大于平均Degree的节点有63个,以平均Degree值的2倍进行核心节点的筛选,结果发现,满足条件的成分有:槲皮素、甘氨酸、山柰酚、木樨草素、β-谷甾醇、豆甾醇、异鼠李素、丙氨酸、7-O-甲基-异微凸剑叶莎醇、黄芩素、刺芒柄花素、常春藤皂苷元,故推测这12个成分是补阳还五汤治疗DPN的主要活性成分。对网络中的靶点根据Degree值进行排序,结果发现,靶点PTGS2、ESR1、AR、NOS2、F2、PRSS1、CA2、PTGS1与成分连接次数达30次以上,对补阳还五汤治疗DPN具有关键作用;而靶点NOS3、MAPK8、PPARG、HSP90AA1、GSK3B、MAPK14与成分的连接次数在20次以上,在网络中也可能起到重要作用。
|
| 图 3 补阳还五汤治疗DPN作用网络 Fig. 3 Network of Buyang Huanwu Decoction in treatment of DPN |
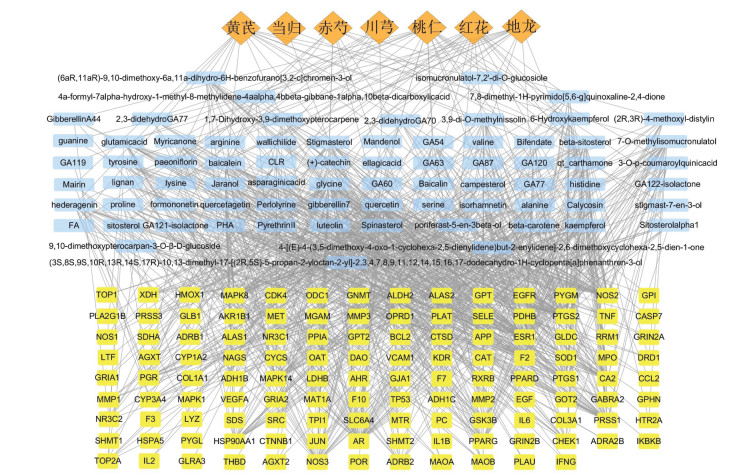
GO富集分析中得到包括神经递质代谢过程、对脂多糖的反应、神经递质水平的调节、对细菌源性分子的反应、活性氧代谢过程、氧化应激反应、细胞对药物的反应、α-氨基酸代谢过程等生物过程(BP)3 814条;辅酶结合、维生素结合、内肽酶活力、氨基酸结合、血红素结合、转录因子活性等分子功能(MF)419条;膜区、囊腔、线粒体基质、突触后膜、胞质囊腔、分泌颗粒内腔等细胞组成(CC)293条,见图 4。
|
| 图 4 GO富集分析 Fig. 4 GO enrichment analysis |
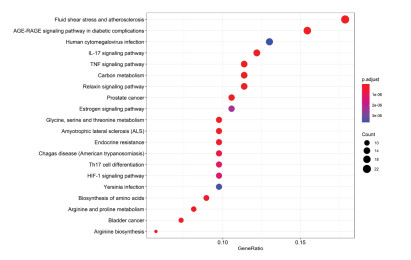
KEGG信号通路富集结果显示,补阳还五汤治疗DPN主要涉及的通路如下:AGE-RAGE信号通路、白细胞介素(IL)-17信号通路、肿瘤坏死因子(TNF)信号通路、松弛素信号通路、缺氧诱导因子(HIF)-1信号通路、前列腺癌、内分泌抵抗等143条通路,见图 5。说明补阳还五汤活性成分的作用靶点散布在不同的通路途径上,通过多途径在DPN治疗中发挥作用。
|
| 图 5 KEGG通路富集分析 Fig. 5 KEGG pathway enrichment analysis |
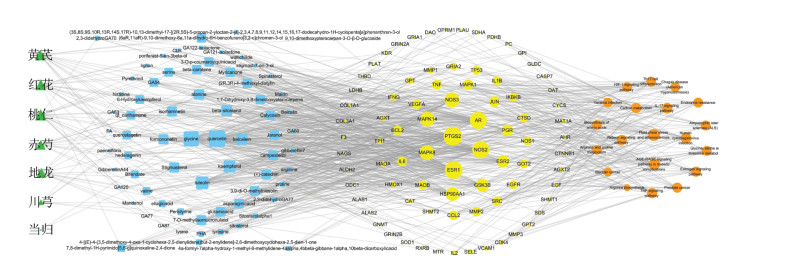
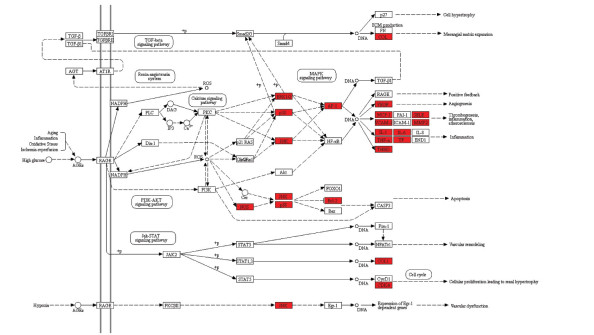
将“2.5”中得到的前20条KEGG信号通路,与参与调控的靶点、药物及活性成分信息一起导入Cytoscape 3.7.2软件,得到“补阳还五汤-活性成分-靶点-KEGG通路”的多维网络,见图 6。结果显示,图中共有178个节点,851条边,节点平均Degree为9.562,其中槲皮素(quercetin)的Degree值为42,靶点蛋白PTGS2、ESR1、AR、NOS2、NOS3、MAPK14、MAPK8、HSP90AA1、GSK3B、ESR2的Degree值在平均Degree值的2倍以上。将所有关键作用靶点映到KEGG数据库中的相关通路上,得到143条通路图,经分析对比后,选择如下通路图进行展示,见图 7,图中红色代表此研究中参与通路的关键靶点。
|
| 注:绿色代表药物;蓝色代表活性成分;黄色代表治疗疾病的靶点;橘黄色代表信号通路。 图 6 补阳还五汤-活性成分-靶点-信号通路网络 Fig. 6 Network of Buyang Huanwu Decoction-active ingredients- targets-signaling pathway |
|
| 图 7 AGE-RAGE信号通路图 Fig. 7 AGE-RAGE signaling pathway |
本次网络药理学研究发现,在药物活性成分的筛选中,有9种活性成分广泛分布于补阳还五汤的多味药物中,且已被证实有多种生物学效应。例如,槲皮素存在于黄芪、红花中,其可能通过Akt-mTOR途径来增加高糖培养雪旺细胞的自噬,从而对DPN起到防治作用[16-17];β-谷甾醇存在于红花、桃仁、赤芍、当归中,其可通过提高脂肪组织中胰岛素受体和葡萄糖转运蛋白4的活性来调控血糖[18-19];黄芩素、黄芩苷存在于红花、赤芍中,其中黄芩素可通过抗氧化应激反应,抑制PKC、p38MAPK及多元醇通路的激活等途径,起到延缓DPN发生的作用[20]。
在DPN的分子水平研究上,已有研究显示,MAPK、SRC、TNF、IL-6等与DPN的发生发展有关[21-23],但仍有部分靶点如PTGS2、ESR1、AR、NOS2、F2等在网络中的关联性较高,在目前的研究中尚未进行充分的证实,可为日后的研究提供新方向。
通过对补阳还五汤化合物-疾病靶点进行GO及KEGG分析,发现补阳还五汤治疗DPN主要涉及糖尿病并发症AGE-RAGE信号通路、炎症通路、癌症通路、内分泌抵抗通路等。
本研究发现B淋巴细胞瘤/白血病-2基因(BCl2)、IL-6、JUN、MAPK1、TNF等19个基因主要富集于AGE-RAGE信号通路上,而AGE-RAGE信号通路在糖尿病周围神经病变中起重要作用。研究证实,晚期糖基化终末产物(AGEs)可在周围神经组织中积聚,与其受体相结合,激活NADPH氧化酶,进而诱导氧化应激,通过启动下游关键细胞信号通路p38(MAPK)途径活化NF-κB,进一步激活白细胞介素IL-1、IL-6、TNF-α及VEGF的表达,促进炎症反应,最终引起神经细胞凋亡[24]。由此猜测,补阳还五汤可能通过调控AGE-RAGE信号通路中的上述相关蛋白来预防DPN发生。
IL-6、IL1B、TNF、CCl2、JUN、MAPK1等14个基因主要富集在TNF信号通路。有研究表明,糖尿病神经炎症反应可由NF-κB轴活化介导,NF-κB的衍生细胞因子TNF-α可诱导环氧合酶-2(COX-2)过度表达和丝裂原活化蛋白激酶(MAPK)激活,进一步触发氧化应激和过度炎症反应的发生[25]。而TNF-α、IL-1、IL-6等可参与DPN的发病机制[26]。
EGFR、JUN、MAPK8、MMP1、NOS1、SRC等14个基因主要富集于松弛素信号通路上,该通路是由松弛素家族多肽通过与4种松弛素家族多肽受体(RXFPs)结合后激活的复杂信号转导途径,可发挥广泛的生理作用[27]。包括抗纤维化、舒张血管、抑制氧化应激、抗炎、治疗心力衰竭、促进伤口愈合等[28]。另外,研究提示,松弛素-2可增加糖代谢异常患者对外周胰岛素的敏感性,其可能在某一程度上反映了胰岛β细胞的代偿能力和对葡萄糖的反应能力[29]。为进一步探索松弛素在抑制和阻断糖尿病及其各种并发症中起到的作用提供方向。
BCl2、EGF、EGFR、IL-6、NOS2、VEGFA等12个基因主要富集于HIF-1信号通路,HIF-1α在糖尿病多种并发症中的作用逐渐受到重视。实验证明,糖尿病小鼠HIF-1α是外周感觉神经元中活性氧(ROS)的上游调控因子,HIF-1α信号的激活可抑制线粒体功能障碍、降低线粒体内过多ROS的产生、并可诱导VEGF的表达,从而起到保护感觉神经元的作用[30]。
综上,DPN发病机制错综复杂,运用网络药理学对其物质基础及分子作用机制的研究,有助于预防及治疗此病。结果提示,补阳还五汤治疗疾病是通过多成分、多靶点、多通路的途径来发挥疗效,其可能通过参与抑制氧化应激及炎症反应等多种活动发挥治疗DPN的作用,为补阳还五汤治疗DPN的基础和临床研究提供了新的方向。
| [1] |
DAVIES M, BROPHY S, WILLIAMS R, et al. The prevalence, severity, and impact of painful diabetic peripheral neuropathy in type 2 diabetes[J]. Diabetes Care, 2006, 29(7): 1518-1522. DOI:10.2337/dc05-2228 |
| [2] |
DWORKIN R H, O'CONNOR A B, KENT J, et al. Pharmacologic management of neuropathic pain:evidence-based recommendations[J]. Pain, 2007, 132(3): 237-251. DOI:10.1016/j.pain.2007.08.033 |
| [3] |
BACKONJA M M, STACEY B. Neuropathic pain symptoms relative to overall pain rating[J]. Journal of Pain, 2004, 5(9): 491-497. DOI:10.1016/j.jpain.2004.09.001 |
| [4] |
SINGH R, KISHORE L, KAUR N. Diabetic peripheral neuropathy:current perspective and future directions[J]. Pharmacological Research, 2014, 80: 21-35. DOI:10.1016/j.phrs.2013.12.005 |
| [5] |
FELDMAN E L, CALLAGHAN B C, POP-BUSUI R, et al. Diabetic neuropathy[J]. Nature Reviews Disease Primers, 2019, 5(1): 42. DOI:10.1038/s41572-019-0097-9 |
| [6] |
POP-BUSUI R, BOULTON A J, FELDMAN E L, et al. Diabetic neuropathy:a position statement by the American Diabetes Association[J]. Diabetes Care, 2017, 40(1): 136-154. DOI:10.2337/dc16-2042 |
| [7] |
率红莉, 汪津洋. 糖尿病周围神经病变治疗药物研究进展[J]. 中国药房, 2014, 25(4): 377-382. SHUAI H L, WANG J Y. Research progress in drug therapy for diabetic peripheral neuropathy[J]. China Pharmacy, 2014, 25(4): 377-382. |
| [8] |
娄树静, 马静敏, 于秀辰. 吕仁和教授"六对论治"在糖尿病周围神经病变中的应用[J]. 北京中医药大学学报(中医临床版), 2009, 16(5): 26-27. LOU S J, MA J M, YU X C. The application of Professor LV Renhe's "six pairs of treatment" in diabetic peripheral neuropathy[J]. Modern Chinese Clinical Medicine, 2009, 16(5): 26-27. |
| [9] |
孙伯欣, 李羚青. 补阳还五汤治疗糖尿病周围神经病变的临床疗效观察[J]. 基因组学与应用生物学, 2017, 36(8): 3398-3402. SUN B X, LI L Q. Clinical effect of Buyang Huanwu Decoction on treating diabetic peripheral neuropathy[J]. Genomics and Applied Biology, 2017, 36(8): 3398-3402. |
| [10] |
裴强, 吴阳, 王涛. 加味补阳还五汤对糖尿病周围神经病变患者血清PNT, IGF-1的影响[J]. 中国实验方剂学杂志, 2019, 25(16): 67-72. PEI Q, WU Y, WANG T. Effect of modified Buyang Huanwu Decoction on serum PNT and IGF-1 in patients with diabetic peripheral neuropathy[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(16): 67-72. |
| [11] |
张振国, 邱作成, 马晖, 等. 补阳还五汤治疗糖尿病周围神经病变30例临床观察[J]. 时珍国医国药, 2012, 23(9): 2353-2354. ZHANG Z G, QIU Z C, MA H, et al. Clinical observation of Buyang Huanwu Decoction in the treatment of 30 patients with diabetic peripheral neuropathy[J]. Lishizhen Medicine and Materia Medica Research, 2012, 23(9): 2353-2354. |
| [12] |
RU J, LI P, WANG J, et al. TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6: 13. DOI:10.1186/1758-2946-6-13 |
| [13] |
UNIPROT CONSORTIUM T. Uniprot:the universal protein knowledgebase[J]. Nucleic Acids Research, 2017, 45(D1): D158-D169. DOI:10.1093/nar/gkw1099 |
| [14] |
WISHART D S, FEUNANG Y D, GUO A C, et al. DrugBank 5.0:a major update to the Drugbank database for 2018[J]. Nucleic Acids Research, 2018, 46(D1): D1074-D1082. DOI:10.1093/nar/gkx1037 |
| [15] |
REBHAN M, CHALIFA-CASPI V, PRILUSKY J, et al. GeneCards:Integrating information about genes, proteins and diseases[J]. Trends in Genetics, 1997, 13(4): 163. DOI:10.1016/S0168-9525(97)01103-7 |
| [16] |
屈岭, 梁晓春, 顾蓓, 等. 槲皮素通过自噬途径减轻高糖致体外培养RSC96细胞的损伤[J]. 环球中医药, 2015, 8(6): 687-691. QU L, LIANG X C, GU B, et al. Quercetin decreased RSC96 cells apoptosis induced by high glucose and increased proliferation via the pathway of autophagy[J]. Global Traditional Chinese Medicine, 2015, 8(6): 687-691. |
| [17] |
屈岭, 梁晓春, 顾蓓, 等. 槲皮素通过Akt-mTOR途径上调高糖培养RSC96细胞的自噬[J]. 基础医学与临床, 2015, 35(5): 596-602. QU L, LIANG X C, GU B, et al. Quercetin up-regulates autophagy in RSC96 cells cultured in high glucose via the pathway of Akt-mTOR[J]. Basic & Clinical Medicine, 2015, 35(5): 596-602. |
| [18] |
PONNULAKSHMI R, SHYAMALADEVI B, VIJAYALAKSHMI P, et al. Insilico and in vivo analysis to identify the antidiabetic activity of beta sitosterol in adipose tissue of high fat diet and sucrose induced type-2 diabetic experimental rats[J]. Toxicology Mechanisms and Methods, 2019, 29(4): 276-290. DOI:10.1080/15376516.2018.1545815 |
| [19] |
BABU S, KRISHNAN M, RAJAGOPAL P, et al. Beta-sitosterol attenuates insulin resistance in adipose tissue via IRS-1/Akt mediated insulin signaling in high fat diet and sucrose induced type-2 diabetic rats[J]. European Journal of Pharmacology, 2020, 873: 173004. DOI:10.1016/j.ejphar.2020.173004 |
| [20] |
王星, 李彩娜, 申竹芳. 黄芩素对糖尿病周围神经病变保护作用机制研究进展[J]. 中国临床药理学杂志, 2018, 34(1): 70-72, 76. WANG X, LI C N, SHEN Z F. Advances on the protective mechanism study of baicalein on diabetic peripheral neuropathy[J]. The Chinese Journal of Clinical Pharmacology, 2018, 34(1): 70-72, 76. |
| [21] |
LAM D, MOMENI Z, THEAKER M, et al. RAGE-dependent potentiation of TRPV1 currents in sensory neurons exposed to high glucose[J]. Plos One, 2018, 13(2): e0193312. DOI:10.1371/journal.pone.0193312 |
| [22] |
陈明卫, 王佑民, 胡红琳, 等. 血清肿瘤坏死因子α、游离脂肪酸以及抵抗素与2型糖尿病患者胰岛素抵抗的关系[J]. 中国糖尿病杂志, 2006, 14(1): 4-6. CHEN M W, WANG Y M, HU H L, et al. Relationships of serum tumor necrosis factor-alpha, free fatty acid and resistin with insulin resistance in type 2 diabetes mellitus[J]. Chinese Journal of Diabetes, 2006, 14(1): 4-6. |
| [23] |
陆游, 陆颖理. 糖尿病性周围神经病变发生机制的研究进展[J]. 上海交通大学学报(医学版), 2017, 37(10): 1441-1445. LU Y, LU Y L. Progress in pathogenesis of diabetic peripheral neuropathy[J]. Journal of Shanghai Jiaotong University(Medical Science), 2017, 37(10): 1441-1445. |
| [24] |
鲍伟杰, 张文健, 许世清, 等. AGE-RAGE系统在糖尿病神经病变中的作用[J]. 生理科学进展, 2014, 45(2): 137-139. BAO W J, ZHANG W J, XU S Q, et al. The effect of AGE-RAGE system in diabetic neuropathy[J]. Progress in Physiological Sciences, 2014, 45(2): 137-139. |
| [25] |
CAMERON N E, COTTER M A. Pro-inflammatory mechanisms in diabetic neuropathy:focus on the nuclear factor kappa B pathway[J]. Current Drug Targets, 2008, 9(1): 60-67. DOI:10.2174/138945008783431718 |
| [26] |
MU Z P, WANG Y G, LI C Q, et al. Association between tumor necrosis factor-α and diabetic peripheral neuropathy in patients with type 2 diabetes:a meta-analysis[J]. Molecular Neurobiology, 2017, 54(2): 983-996. DOI:10.1007/s12035-016-9702-z |
| [27] |
BATHGATE R A, HALLS M L, VANDER WESTHUIZEN E T, et al. Relaxin family peptides and their receptors[J]. Physiological Reviews, 2013, 93(1): 405-480. DOI:10.1152/physrev.00001.2012 |
| [28] |
苏伟, 王萍, 陈晖. 松弛素与糖尿病的微妙关系[J]. 医学研究杂志, 2013, 42(4): 8-11. SU W, WANG P, CHEN H. The subtle relationship between relaxin and diabetes[J]. Journal of Medical Research, 2013, 42(4): 8-11. |
| [29] |
高翔宇, 王萍, 刘锐锋, 等. 2型糖尿病患者血清松弛素-2与胰岛β细胞功能的相关性研究[J]. 临床和实验医学杂志, 2018, 17(19): 2068-2072. GAO X Y, WANG P, LIU R F, et al. Correlation between serum relaxin-2 and islet β-cell function in patients with type 2 diabetes mellitus[J]. Journal of Clinical and Experimental Medicine, 2018, 17(19): 2068-2072. |
| [30] |
ROJAS D R, TEGEDER I, KUNER R, et al. Hypoxia-inducible factor 1α protects peripheral sensory neurons from diabetic peripheral neuropathy by suppressing accumulation of reactive oxygen species[J]. Journal of Molecular Medicine (Berlin), 2018, 96(12): 1395-1405. |
2. Tianjin Wuqing District Hospital of Traditional Chinese Medicine, Tianjin 301700, China
 2020, Vol. 37
2020, Vol. 37