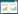文章信息
- 胡涛, 周晓芸, 薛丹, 张丽华
- HU Tao, ZHOU Xiaoyun, XUE Dan, ZHANG Lihua
- 培土生金法对COPD小鼠骨骼肌线粒体能量代谢保护作用机制研究
- Study on the protective effect and mechanism of the method of strengthening the spleen to benefit the lung on the mitochondrial energy metabolism of skeletal muscle of mice with chronic obstructive pulmonary disease
- 天津中医药, 2020, 37(11): 1294-1298
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(11): 1294-1298
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.11.20
-
文章历史
- 收稿日期: 2020-06-28
2. 广州医科大学, 广州 511436
香烟烟雾等有害气体或有害颗粒长期作用于肺部是慢性阻塞性肺疾病(COPD)的发病机制之一,有害气体可刺激细胞释放大量活性氧(ROS),从而引起氧化/抗氧化失衡,加速COPD的进展,最终发展成为呼吸衰竭,具有较高的病死率,而骨骼肌能量代谢不足是呼吸衰竭的直接原因,目前临床上面临着治疗挑战。呼吸肌大部分属于骨骼肌,对能量有着较高的需求和敏感性,而线粒体是“能量加工厂”,如果其结构或功能损伤可直接导致骨骼肌供能不足。中医学认为COPD晚期的呼吸衰竭属于“喘证、气脱”等范畴,其关键病机是“脾虚(痰)湿盛”。参苓白术散为培土生金的代表方,具有益气健脾,祛湿化痰功效。临床研究[1-2]发现参苓白术散可提高COPD患者运动耐力,减轻氧化损伤,但其相关作用机制目前尚不明确。故本实验通过参苓白术散干予COPD小鼠模型,检测腓肠肌组织三磷酸腺苷(ATP)、二磷酸腺苷(ADP)和一磷酸腺苷(AMP)及腺苷酸活化蛋白激酶(AMPK)、过氧化物酶体增殖活化受体γ共激活因子-1α(PGC-1α)、线粒体融合蛋白2(Mfn2)指标变化,探讨培土生金法对COPD小鼠骨骼肌线粒体能量代谢的保护作用及机制。
1 材料与方法 1.1 实验动物SPF级8周龄健康雄性SD小鼠50只(20±2) g,由广东省医学实验动物中心提供,动物许可证号:SCXK(粤)2018-0094,本实验得到广东省中医院实验动物伦理委员会批准。
1.2 药物的配制参苓白术散(莲子10 g,炒薏苡仁10 g,砂仁10 g,桔梗10 g,炒白扁豆15 g,茯苓20 g,党参20 g,炙甘草20 g,白术20 g,山药20 g),购自广州市第一人民医院中药房,经广州中医药大学中药中心鉴定合格,用回流提取法将药液浓缩至相当于药液含2.25 g/mL生药,4 ℃保存备用。
1.3 实验药品与试剂大前门牌过滤嘴香烟(20支/包,烟碱含量0.8 mg,焦油量11 mg/支,一氧化碳含量13 mg/支,上海烟草集团有限责任公司出品);考马斯亮蓝蛋白定量试剂盒(南京建成生物工程研究所提供);RIPA裂解液由武汉博士德生物工程有限公司提供;兔抗小鼠AMPK、p-AMPK一抗(美国Cell Signaling Technology公司),兔抗小鼠PGC-1α一抗(美国Novus Biological公司),兔抗小鼠Mfn2单抗(英国Abcam公司)、β-actin单抗、山羊抗兔二抗(美国Cell Signaling Technology公司)。
1.4 实验仪器自制熏烟染毒箱:70 cm×50 cm×40 cm,145 L,每侧各有1.5 cm×1.5 cm小孔;ODSHYPERSIL C18色谱柱(Thermo);1260高效液相色谱仪(Agilent);NanoDrop 2000C超微量紫外/可见分光光度计(Thermo);恒温水浴槽(上海安宁医疗器械厂);低温台式高速离心机(中国上海TLG16G);电泳及转膜装置(美国Bio-RAD公司)。
1.5 COPD模型复制及药物干预小鼠在SPF级动物实验室适应性饲养3 d后,采用随机法将50只小鼠分为5组,分别为对照组(Control)、模型组(Model)、参苓白术散高、中、低剂量组(SL-H、SL-M、SL-L),参照宋一平等[3]的方法制作小鼠COPD模型。除对照组小鼠,所有小鼠置入自制熏烟染毒箱,每天2批次予以被动吸烟,每批次8支大前门香烟,分两次给予,每次持续30 min,2次熏烟间隔时间大于4 h,持续8周。熏烟完毕将动物放回原饲养笼中正常进食进水。熏烟4周后,在熏烟前给予药物干预(SL-H、SL-M和SL-L分别按20、10、5 g/kg灌胃),对照组及模型组予生理盐水灌胃。
1.6 观察指标及检测方法 1.6.1 生存状态每日观察各组小鼠的精神状态、呼吸、摄食量、大便性状及体质量变化等。
1.6.2 腓肠肌ATP、AMP及ADP含量检测精准称取各组小鼠腓肠肌,置于冰上,制样、检测组织中ATP、AMP、ADP含量[4]。
1.6.3 Western blotting法测定蛋白AMPK、p-AMPK、PGC-1α及Mfn2称取各组肌肉组织,按照1 mg:7.5 μL的比例将肌肉组织与RIPA裂解液混合置于冰上,用玻璃匀浆器进行研磨并裂解40 min,低温离心机上离心半径105 mm,12 000 r/min离心10 min,取上清,BCA法测定蛋白浓度后将样本保存于-20 ℃冰箱。利用Western blot检测各组小鼠腓肠肌组织AMPK(1:500)、p-AMPK(1:500)、PGC1-α(1:800)的表达变化,用试剂化学发光法显色条带,采用Sigma Scan Pro软件进行数据分析,以β-actin作为内参标记各组蛋白表达水平,其中AMPK磷酸化程度则用pAMPK/AMPK比值表示。每组蛋白重复测量3次。
1.7 统计学方法实验数据采用SPSS 24.0统计软件处理,所有数据均以均数±标准差(x±s)表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD法,P<0.05表示差异具有统计学意义。
2 实验结果 2.1 各组小鼠生存状态变化情况各组小鼠熏烟时均喜聚集,多有流涎、点头呼吸、喘促等症状,其中模型组喘促症状呈进行性加重,并伴有口鼻分泌物增多,喉中痰鸣,消瘦,大便稀软,饮食及摄水量减少等。与对照组相比,各组小鼠体质量均增长缓慢,尤以模型组明显,熏烟结束时体质量和前后差值体质量均有统计学意义(P<0.05),而药物干预组上述症状较模型组有所改善,但无统计学意义(P>0.05)。各组小鼠体质量变化,见图 1。
|
| 注:A,体质量增加与时间关系;B,各组小鼠实验前后体质量变化,与对照组相比,*P<0.05。 图 1 各组小鼠体质量变化情况 Fig. 1 Changes in body weight of mice in each group |
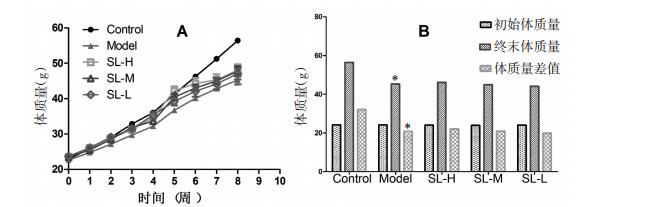
与对照组比较,模型组ATP/AMP降低(P<0.05);ADP/ATP无明显趋势,提示模型组小鼠腓肠肌存在着能量代谢障碍;与模型组相比,参苓白术散高剂量组ATP/AMP升高(P<0.05),ADP/ATP无明显趋势,表明高剂量参苓白术散可改善骨骼肌能量不足状态。见图 2。
|
| 注:A,ATP/AMP比值变化,与对照组相比,*P<0.05;与模型组相比,#P<0.05;B,ADP/AMP比值变化。 图 2 各组小鼠ATP/AMP和ADP/ATP的变化 Fig. 2 Changes in ATP/AMP and ADP/ATP of mice in each group |
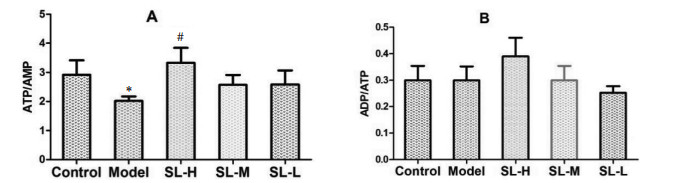
Western blot结果显示,与对照组比较,模型组小鼠腓肠肌组织内p-AMPK/AMPK、PGC-1α均下降(P<0.05),提示腓肠肌组织磷酸化水平、调控能量代谢功能下降,而参苓白术散药物干预后,肌肉组织内p-AMPK/AMPK、PGC-1α均增加(P<0.05),提示参苓白术散可增加骨骼肌组织内的p-AMPK水平,诱导PGC-1α的表达,改善能量代谢,且存在着剂量效应,见图 3。
|
| 注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。 图 3 Western blot检测参苓白术散对腓肠肌组织内AMPK磷酸化水平、PGC-1α的影响 Fig. 3 Effect of Shenling Baizhu Powder on AMPK phosphorylation level and PGC-1α in gastrocnemius muscle tissue detected by Western blot |
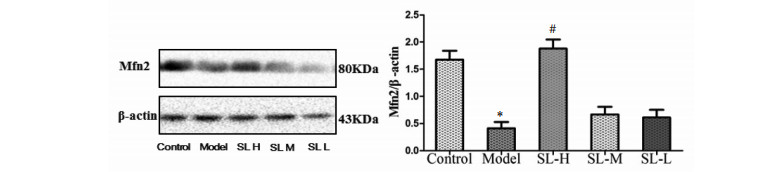
Western blot结果显示,与对照组比较,模型组小鼠腓肠肌组织内Mfn2表达降低(P<0.05),提示腓肠肌组织线粒体稳态被破坏,能量代谢障碍,而参苓白术散药物干预后,高剂量组Mfn2表达水平较模型组升高(P<0.05),提示参苓白术散在线粒体层面保护COPD小鼠腓肠肌能量代谢,见图 4。
|
| 注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。 图 4 Western blot检测参苓白术散对腓肠肌组织内Mfn2表达水平的影响 Fig. 4 Effect of Shenling Baizhu Powder on the expression level of Mfn2 in gastrocnemius muscle tissue detected by Western blot |
中医传统理论认为“脾主肌肉,脾胃为气血生化之源”,而宗气是治疗呼吸肌疲劳不可或缺的重要因素[5],故健脾益气(培土生金)可能为治疗COPD骨骼肌疲劳的治则之一。相关研究表明[6-8],健脾益气中药及健脾治则可改善动物骨骼肌疲劳,调控线粒体能量代谢。葡萄糖是机体内重要的能量物质,是维持机体活动的“原动力”,它主要是通过三羧酸循环等氧化分解代谢过程释放ATP,而ATP可代谢为ADP和AMP,ATP含量、ADP/ATP、ATP/AMP[9-11]均与葡萄糖代谢相关。ATP/AMP反应的细胞内的能量变化,与AMPK的激活存在着关联[12],激活后的AMPK,一方面抑制消耗ATP的分解活动,另一方面通过线粒体生物合成等促进ATP的产生,从而恢复能量平衡[13]。本实验研究发现,COPD模型组ATP/AMP比值降低(P<0.05),提示腓肠肌能量存在着不足,可直接影响其功能状态,而参苓白术散高剂量干预后,ATP/AMP比值升高(P<0.05),提示参苓白术散可改善COPD小鼠骨骼肌的能量供应,进而维持其正常发挥功能作用。
AMPK是机体内重要的调控因子,可感受细胞内能量变化,被激活后可进而调控下游各种蛋白激酶或基因表达,从而调控机体能量代谢。在线粒体保护方面,AMPK可首先激活PGC-1α,后者是促进线粒体生物合成的主要调节因子,在调节线粒体含量方面占有非常大的比重,可调节线粒体的数量和质量,调控能量合成,参与脂肪酸氧化过程,防止氧化应激损伤[14-17]。本实验研究结果表明,与对照组比较,模型组小鼠腓肠肌组织内p-AMPK/AMPK、PGC-1α均下降(P<0.05),提示腓肠肌组织磷酸化水平、调控能量代谢功能下降,而参苓白术散药物干预后,肌肉组织内p-AMPK/AMPK、PGC-1α增加(P<0.05),提示参苓白术散可通过磷酸化AMPK改善COPD小鼠腓肠肌能量代谢障碍,此过程伴随着PGC-1α表达的上调,表明参苓白术散可通过AMPK-PGC-1α保护COPD小鼠骨骼肌功能状态。
Mfn2是维持线粒体稳态的关键蛋白[18-19],它处于线粒体外膜和肌浆网之间,主要介导线粒体之间的融合,从而促进物质交换。PGC-1α与雌激素相关受体共同调控着Mfn2[20-22],PGC-1α表达下降及其本身乙酰化修饰后,Mfn2表达下调,线粒体稳态被破坏[23],而导致能量产生障碍。本研究发现,模型组小鼠的Mfn2表达较对照组降低(P<0.05),而参苓白术散干预后,Mfn2表达较模型组升高(P<0.05),提示参苓白术散在线粒体层面影响到COPD小鼠腓肠肌能量代谢。
综合本实验结果,参苓白术散可能通过激活AMPK-PGC-1α-Mfn2参与保护COPD小鼠骨骼肌功线粒体生物合成及功能状态,可提高p-AMPK、PGC-1α、Mfn2的表达,促进线粒体生物合成,进而增加ATP的生成。综上所述,培土生金法(参苓白术散)在一定程度上可改善COPD小鼠骨骼肌能量代谢重构,从而起到保护COPD小鼠骨骼肌功能的作用。
| [1] |
胡涛, 马军, 蔡敬宙, 等. 参苓白术散对慢性阻塞性肺疾病稳定期肺脾两虚患者运动耐力及氧化应激水平的影响[J]. 时珍国医国药, 2019, 30(1): 125-127. HU T, MA J, CAI J Z, et al. Effects of Shenling Baizhu Powder on exerciseendurance and oxidative stress level in patients with chronic obstructive pulmonary disease at the stable stage of pulmonary and spleen deficiency[J]. Lishizhen Medicine and Materia Medica Research, 2019, 30(1): 125-127. |
| [2] |
胡涛, 金龙伟. 培土生金对慢性阻塞性肺疾病稳定期呼吸肌疲劳的疗效[J]. 中华中医药学刊, 2019, 37(6): 1359-1361. HU T, JIN L W. The effect of cultivating earth to produce gold on respiratory muscle fatigue in chronic obstructive pulmonary disease in stable period[J]. Chinese Archives of Traditional Chinese Medicine, 2019, 37(6): 1359-1361. |
| [3] |
宋一平, 崔德健, 茅培英, 等. COPD大鼠模型的建立及药物干预的影响[J]. 中华内科杂志, 2000, 39(8): 556-557. SONG Y P, CUI D J, MAO P Y, et al. Establishment of COPD rat model and the influence of drug intervention[J]. Chinese Journal of Internal Medicine, 2000, 39(8): 556-557. |
| [4] |
DAI Y, MA T, REN X, et al. Tongluo Xingnao Effervescent Tablet preserves mitochondrial energy met-abolism and attenuates cognition deficits in APPswe/PS1De9 mice[J]. Neuroscience Letters, 2016, 630: 101-108. DOI:10.1016/j.neulet.2016.07.044 |
| [5] |
胡涛, 林琳, 吴蕾. 宗气与慢性阻塞性肺疾病膈肌疲劳相关理论浅析[J]. 时珍国医国药, 2015, 26(5): 1183-1185. HU T, LIN L, WU L. Theoretical analysis of zongqi and diaphragmatic fatigue in chronic obstructive pulmonary disease[J]. Lishizhen Medicine and Materia Medica Research, 2015, 26(5): 1183-1185. |
| [6] |
吕林, 王凤云, 唐旭东, 等. 脾虚一号方对脾虚型功能性消化不良大鼠胃组织线粒体呼吸链复合物Ⅳ亚单位的影响[J]. 中国实验方剂学杂志, 2017, 23(7): 102-108. LYU L, WANG F Y, TANG X D, et al. Effect of Spleen Deficiency No.1 Prescription on Ⅳ subunit of mitochondrial respiratory chain complex in gastric tissue of rats with spleen deficiency type functional dyspepsia[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(7): 102-108. |
| [7] |
戎志斌, 罗安明, 姚乃礼. "脾虚-线粒体-有氧糖酵解-肿瘤关联"病因病机新假说[J]. 医学争鸣, 2016, 7(1): 19-22. RONG Z B, LUO A M, YAO N L. New hypothesis of etiology and pathogenesis of "spleen deficiency-mitochondrial-aerobic glycolysis-tumor association"[J]. Negative, 2016, 7(1): 19-22. |
| [8] |
胡芳玉, 宋雅芳, 雷孝文. 从线粒体生物合成及其调控信号通路探讨脾虚与重症肌无力的相关性[J]. 辽宁中医杂志, 2016, 43(7): 1379-1381. HU F Y, SONG Y F, LEI X W. To explore the correlation between spleen deficiency and myasthenia gravis from mitochondrial biosynthesis and its regulatory signaling pathways[J]. Liaoning Journal of Traditional Chinese Medicine, 2016, 43(7): 1379-1381. |
| [9] |
SALEH M C, WHEELER M B, CHAN C B. Endogenous islet uncoupling protein-2 expression and loss of glucose homeostasis in ob/ob mice[J]. Journal of Endocrinology, 2006, 190(3): 659. DOI:10.1677/joe.1.06715 |
| [10] |
DERAMCHIA K, MORAND P, BIRAN M, et al. Contribution of pyruvate phosphate dikinase in the maintenance of the glycosomal ATP/ADP balance in the Trypanosoma brucei procyclic form[J]. Journal of Biological Chemistry, 2014, 289(25): 17365-17378. DOI:10.1074/jbc.M114.567230 |
| [11] |
MIYAMOTO S, HSU C C, HAMM G, et al. Mass spectrometry imaging reveals elevated glomerular ATP/-AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator[J]. EBio Medicine, 2016(7): 121-134. |
| [12] |
谷崎. 递增负荷对大鼠心肌ATP、AMP、ATP/AMP的影响[J]. 西安工业大学学报, 2012, 32(11): 932-935. GU Q. The effect of increasing load on myocardial ATP, AMP, ATP/AMP in rats[J]. Journal of Xi'an Technological University, 2012, 32(11): 932-935. |
| [13] |
HARDIE D G. AMP-activated protein kinase:An energy sensor that regulates all aspects of cell function[J]. Genes & Development, 2011, 25(18): 1895-1908. |
| [14] |
王懿, 张艳, 礼海. 益气活血方干预PGC-1α调控心衰心肌细胞能量代谢重构的作用机制[J]. 中国实验方剂学杂志, 2015, 21(6): 169-173. WANG Y, ZHANG Y, LI H. The mechanism of Yiqi Huoxue Recipe intervening PGC-1α in regulating the energy metabolism and remodeling of heart failure cardiomyocytes[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2015, 21(6): 169-173. |
| [15] |
ST-PIERRE J, DRORI S, ULDRY M, et al. Suppression of reactive oxygen species and neurodegeneration by the PGC-1α transcriptional coactivators[J]. Cell, 2006, 127(2): 397-408. DOI:10.1016/j.cell.2006.09.024 |
| [16] |
MARMOLINO D, MANTO M, ACQUAVIVA F, et al. PGC-1alpha down regulation affects the antioxidant res-ponse in Friedreich's ataxia[J]. PLoS One, 2010, 5(4): e10025. DOI:10.1371/journal.pone.0010025 |
| [17] |
IRRCHER I, LJUBICIC V, KIRWAN A F, et al. Amp-activated protein kinase-regulated activation of the PGC-1alpha promoter in skeletal muscle cells[J]. PLoS One, 2008, 3(10): e3614. DOI:10.1371/journal.pone.0003614 |
| [18] |
FRANCO A, KITSIS R N, FLEISCHER J A, et al. Correcting mitochondrial fusion by manipulating mitofusin conformations[J]. Nature, 2016, 540(7631): 74-79. DOI:10.1038/nature20156 |
| [19] |
VACEK J C, BEHERA J, GEORGE A K, et al. Tetrahydrocurcumin ameliorates homocysteine-mediated mitoch-ondrial remodeling in brain endothelial cells[J]. Journal of Cellular Physiology, 2018, 233(4): 3080-3092. DOI:10.1002/jcp.26145 |
| [20] |
BARBULLUSHI K, ABATI E, RIZZO F, et al. Disease modeling and therapeutic strategies in CMT2A:state of the art[J]. Molecular Neurobiology, 2019, 56(9): 6460-6471. DOI:10.1007/s12035-019-1533-2 |
| [21] |
BELL M B, BUSH Z, MCGINNIS G R, et al. Adult skeletal muscle deletion of mitofusin 1 and 2 impedes exercise performance and training capacity[J]. Journal of Applied Physiology, 2019, 126(2): 341-353. DOI:10.1152/japplphysiol.00719.2018 |
| [22] |
ESHIMA H, MIURA S, SENOO N, et al. Improved skeletal muscle Ca2+ regulation in vivo following contra-ctions in mice overexpression PGC-1α[J]. American Journal of Physiology-Regulatory Integrative and Comparative Physiology, 2017, 312(6): 1017-1028. DOI:10.1152/ajpregu.00032.2017 |
| [23] |
YEO D, KANG C, GOMEZ-CABRERA M C, et al. Intensified mitophagy in skeletal muscle with aging is downregulated by PGC-1α overexpression in vivo[J]. Free Radical Biology Medicine, 2019, 130: 361-368. DOI:10.1016/j.freeradbiomed.2018.10.456 |
2. Guangzhou Medical University, Guangzhou 511436, China
 2020, Vol. 37
2020, Vol. 37