文章信息
- 王文秀, 高晗, 张环宇, 谭伟, 李振国, 田晓轩
- WANG Wenxiu, GAO Han, ZHANG Huanyu, TAN Wei, LI Zhenguo, TIAN Xiaoxuan
- 宽体金线蛭的特异性PCR分子鉴定
- Specific PCR molecular identification of Whitmania pigra
- 天津中医药, 2020, 37(11): 1299-1303
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(11): 1299-1303
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.11.21
-
文章历史
- 收稿日期: 2020-06-20
2. 天津中医药大学中医药研究院, 天津 301617;
3. 牡丹江友搏药业有限责任公司, 黑龙江 157000
水蛭为中国传统中药材,2015版药典规定水蛭药材为蚂蟥、水蛭或柳叶蚂蟥的干燥全体[1]。蚂蟥又名宽体金线蛭,体略呈纺锤形,长一般60~130 mm,宽10~20 mm。背面暗绿色,有5条纵行的黑色间杂淡黄色的斑纹,腹面两侧以及中间共有9条断续的黑色纵纹[2]。宽体金线蛭为药用优良品种,具有体型大、抗病强等优点[3]。因此目前市场上水蛭药材以宽体金线蛭为主[4]。水蛭中含有多种多肽及脂类[5-6],具有抗凝血、抗血栓等作用[7-9]。随着水蛭在心脑血管疾病制剂中的广泛应用[10],市场上出现不少混伪品。特异性聚合酶链式反应(PCR)技术具有快速、准确等优点[11-13]。近年来特异性PCR技术已在地龙、鹿茸、龟甲等多种动物药材中得到应用[14-17]。此研究旨在建立宽体金线蛭特异性PCR鉴定方法,实现对宽体金线蛭简单、快速、准确鉴别。
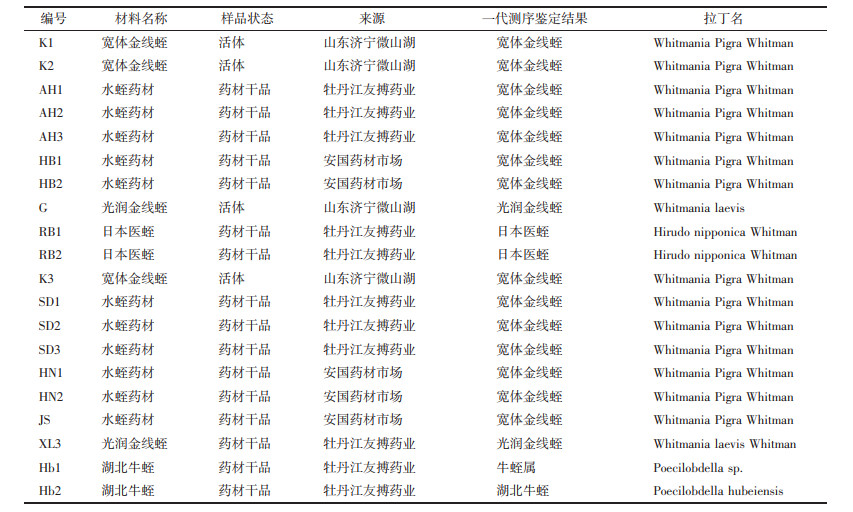
1 实验材料 1.1 实验样品此研究所用样品材料部分采自山东、河北两地,部分样品材料由牡丹江友搏药业有限责任公司提供。共20份样品材料,经天津中医药大学中医药研究院田晓轩副研究员鉴定和一代测序鉴定,样品材料保存于天津中医药大学中医药研究院。不同基源水蛭样品见图 1,详细信息及一代鉴定结果见表 1。
|
| 图 1 水蛭样品图 Fig. 1 Leech sample drawing |
凝胶成像分析仪(CueneGenins);DYY-8C型核酸电泳仪(北京六一生物科技有限公司);ZHJH-C1112B型超净工作台(上海智城分析仪器制造有限公司);移液枪(德国Eppendorf公司);聚合酶链式反应仪(德国Eppendorf公司);ZF-6型紫外分析仪(上海嘉鹏科技有限公司);JA3003型电子精密天平(天津天马衡基仪器有限公司)。
1.3 实验试剂SpeedSTARTM HS DNA Polymerase(TaKaRa公司);Tks GflexTM DNA Polymerase(TaKaRa公司);10×Fast Buffer I(TaKaRa公司);dNTP Mixture(TaKaRa公司);DEPC水(Biosharp公司);琼脂糖(Lonza公司);无水乙醇(天津市大茂化学试剂厂);6×Loading Buffer(TaKaRa公司);10 000×SYBR GreenI核酸染料(北京索莱宝科技有限公司);DuRed核酸染料(北京泛博生物化学有限公司);D2000 DNA Marker(北京天根生化科技有限公司);TAE(50×)(合肥志宏生物技术有限公司);血液/细胞/组织基因组DNA提取试剂盒(天根生化科技有限公司)。
2 方法 2.1 引物设计从NCBI数据库下载宽体金线蛭及可能存在的混伪物种Hirudo orientalis、Hirudo verbana、欧洲医蛭、日本医蛭、丽医蛭、菲牛蛭、棒纹牛蛭、南京牛蛭、尖细金线蛭、光润金线蛭的细胞色素C氧化酶亚基I(COI)基因序列。使用软件MAFFTv71进行多重序列比对,分析宽体金线蛭及其混伪品的COI序列差异单核苷酸多态性(SNP)位点。
使用软件Geneious8.0.4设计宽体金线蛭的特异性鉴别引物;使用软件oligo7对引物进行评价。特异性引物由生工生物工程(上海)股份有限公司合成。引物序列见表 2。
剪取各水蛭样品肌肉组织约30 mg,按照动物血液/细胞/组织基因组DNA提取试剂盒(TIANGEN)说明书提取基因组总DNA。总DNA采用Nanodrop2000微量核酸定量分析仪测定浓度,判断DNA质量。所得基因组总DNA进行特异性PCR实验或储存于-20 ℃备用。
2.3 一代测序(又称Sanger测序)各样本COI扩增体系为50 μL,包含25 μL 2×Gflex PCR Buffer (Mg2+,dNTP plus),引物COI1490和HCO2198各1 μL 10 μmol/L,1 μL(5~150 ng)DNA模板,1.25 U Tks GflexTM DNA Polymerase,加DEPC水补足至50 μL。PCR反应结束后,向5 μL扩增产物中加入1 μL 6×Loading buffer (Takara公司),于含Du Red核酸染料的1%琼脂糖凝胶上进行电泳检测。检测扩增成功后,扩增产物40 μL进行Sanger双端测序。一代测序工作由北京华大基因完成。测序数据经过在线BLAST鉴定结果,一代鉴定与传统鉴定结果一致。COI通用引物序列及扩增循环条件见表 2。
2.4 DNA模板浓度灵敏度考察及方法适用性考察选取K1组样品,将DNA模板浓度梯度稀释为25、5、1、0.2、0.04 ng。扩增反应体系25 μL,包含2.5 μL 10×Fast BufferI,2 μL dNTP Mixture(2.5 mmol/L),引物sz97F和sz244R各0.5 μL 10 μmol/L,0.5 μL(5~150 ng) DNA模板,0.625 U SpeedSTARTM HS DNA Polymerase,加DEPC水补足至25 μL。PCR反应结束后,5 μL反应产物中加入1 μL 6×Loading buffer(Takara公司),混匀后于DU Red核酸染料染色的1.5 %琼脂糖凝胶电泳。电泳结束后经凝胶成像系统成像、观察。扩增循环条件见表 2。20份不同产地来源样品方法适用性考察的扩增体系、引物、循环条件及凝胶成像同上。然后向20 μL扩增产物中加入0.5 μL 10 000×SYBR Green I核酸染料于254 nm紫外灯下观察。
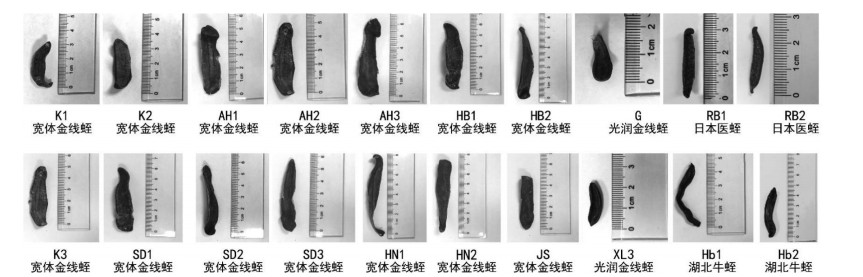
3 结果 3.1 DNA模板浓度灵敏度考察结果DNA模板浓度在0.2~25 ng间时,宽体金线蛭能够扩增得到149 bp的条带。DNA模板浓度在0.04 ng及以下时无明显扩增条带。因此确定了DNA模板浓度0.02 ng为特异性PCR扩增的下限,进行特异性PCR实验时应保证DNA模板浓度不低于0.2 ng/μL。DNA模板浓度灵敏度考察扩增结果,见图 2。

|
| 图 2 DNA模板浓度梯度特异性PCR扩增结果图 Fig. 2 DNA template concentration gradient specific PCR amplification results |
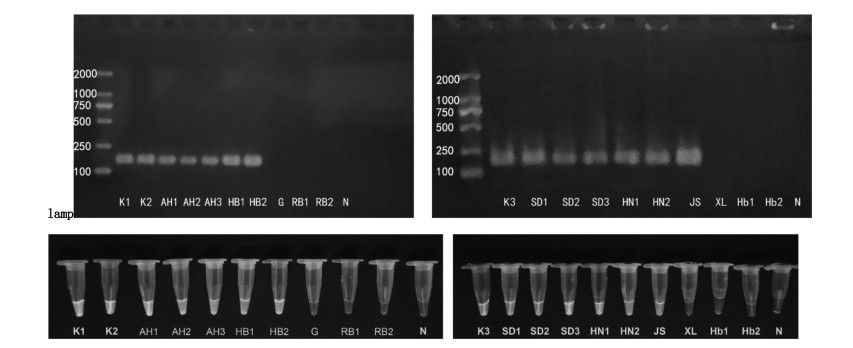
对20份不同产地来源的实验样品进行PCR扩增,产物经琼脂糖凝胶电泳检测,254 nm紫外灯下观察。宽体金线蛭均扩增产生149 bp特异性单一条带,混伪品均无明显条带产生。向各样品组20 μL扩增产物中加入0.5 μL 10 000×SYBR Green I核酸染料于紫外灯下观察,宽体金线蛭扩增产物均呈现黄绿色荧光,混伪品组扩增产物及空白对照组N均不呈现黄绿色荧光。检测鉴定结果见图 3。不同产地来源的正品宽体金线蛭均产生一致结果,表明该体系能够稳定准确鉴别宽体金线蛭。
|
| 注:K1、K2、AH1、AH2、HB1、HB2、K3、SD1、SD2、HN1、HN2、JS:宽体金线蛭;G、XL:光润金线蛭;RB1、RB2:日本医蛭;Hb1:Poecilobdella sp.;Hb2:Poecilobdella hubeiensis;N:空白对照。 图 3 20份水蛭样品扩增产物电泳凝胶成像结果图及紫外灯下扩增产物荧光显色图 Fig. 3 Electrophoretic gel imaging results of 20 amplified samples of leech samples and fluorescent chromogram of amplified products under ultraviolet lamp |
水蛭药材的应用始载于《神农本草经》,具有破血通经、逐瘀、利水道等作用[18-19]。随着心血管疾病越来越受到人们的关注,以水蛭为主要原料的药品如溶栓胶囊、欣复康、疏血通注射液、抗血栓片等不断研制开发,使中国水蛭需求量不断增加[20-21]。特异性PCR鉴定方法一般分为寻找特异性鉴别位点,设计特异性鉴别引物,PCR扩增条件确定,样品适用性考察4部分。特异性PCR分子鉴定操作简单、快速、准确性高,非常适用于中药材的鉴定。同时实验对于DNA较为敏感,应特别注意外源DNA的引入,以防止实验中假阳性结果的出现。宽体金线蛭特异性PCR鉴定方法结合荧光染料法,实验通常在35 min内完成,不需要贵重仪器,因此十分适合市场上宽体金线蛭中药材快速鉴定。
DNA序列同时具有物种的特异性和物种间的多样性是特异性引物设计的基础[22]。宽体金线蛭特异性引物扩增得到的DNA片段为149 bp,与658 bp通用DNA条形码COI相比,片段短小。因此对于DNA发生降解的药材仍然能够有效扩增得到鉴定结果。DNA模板的浓度是特异性PCR扩增中的重要影响因素,此实验对其DNA模板浓度灵敏度进行考察,在0.2~25 ng时,宽体金线蛭DNA能够扩增得到目的条带,0.02 ng以下时无明显扩增条带。因此0.02 ng为特异性PCR扩增时DNA模板的下限浓度,特异性鉴定实验中DNA模板浓度应不低于0.02 ng。不同产地来源的20份水蛭药材进行特异性验证,验证结果与形态鉴定、一代分子鉴定结果一致。表明该引物在宽体金线蛭真伪鉴定方面具有稳定性和准确性。核酸染料染色的方法更为简便快速,不需要进行30 min左右的电泳,只需向扩增产物中加入核酸染料,紫外灯下观察即可辨别真伪,更适用于应用和推广。此研究提供了一种宽体金线蛭快速鉴定的方法,对宽体金线蛭药材使用、流通的安全性与规范性起到了保障作用。
| [1] |
国家药典委员会.中华人民共和国药典[S].北京: 中国医药科技出版社, 2015: 83. Chinese Pharmacopoeia Commission. Pharmacopoeia of people's republic of China[S]. Beijing: China Medical Science Press, 2015: 83. |
| [2] |
杨谋, 张选杰, 张娇, 等. 水蛭的药用价值和养殖现状[J]. 当代畜牧, 2018, 36(18): 58-60. YANG M, ZHANG X J, ZHANG J, et al. Medicinal value and cultivation status of leech[J]. Contemporary Animal Husbandry, 2018, 36(18): 58-60. |
| [3] |
刘飞, 杨大坚. 中国水蛭人工养殖的现行模式调研[J]. 世界科学技术-中医药现代化, 2014, 16(10): 2170-2173. LIU F, YANG D J. Investigation on the current model of artificial breeding of leech in China[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2014, 16(10): 2170-2173. |
| [4] |
叶乃卫. 药用水蛭的人工养殖[J]. 农村实用技术, 2002, 15(1): 38-39. YE N W. Artificial culture of medicinal leech[J]. Applicable Technologies for Rural Areas, 2002, 15(1): 38-39. |
| [5] |
李桃.宽体金线蛭的化学成分研究[D].广州: 暨南大学, 2013. LI T. Chemical constituents from Whitmania pigra[D]. Guangzhou: Jinan University, 2013. |
| [6] |
钟山, 杨得坡, 崔征. 水蛭抗凝血活性成分的研究[J]. 中国中药杂志, 2008, 33(23): 2781-2784. ZHONG S, YANG D P, CUI Z. Study on anticoagulant active components of leech[J]. China Journal of Chinese Materia Medica, 2008, 33(23): 2781-2784. |
| [7] |
韩文博, 孙爱军, 孟丽君, 等. 水蛭抗动脉粥样硬化作用研究进展[J]. 天津中医药, 2019, 36(7): 724-727. HAN W B, SUN A J, MENG L J, et al. Research progress in effect of anti-atherosclerosis with leeches[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(7): 724-727. |
| [8] |
吴晶魁.中药水蛭抗动脉粥样硬化及调脂机制研究[D].天津: 天津医科大学, 2018. WU J K. Mechanism of leech on anti-atherosclerosis and regulating serum lipids[D]. Tianjin: Tianjin Medical University, 2018. |
| [9] |
刘璇, 高美风, 孔毅. 水蛭化学成分及药理作用的研究进展[J]. 药物生物技术, 2017, 24(1): 76-80. LIU X, GAO M F, KONG Y. Research progress on chemical composition and pharmacological action of leech[J]. Pharmaceutical Biotechnology, 2017, 24(1): 76-80. |
| [10] |
邓妙丽, 李宝红, 程怡, 等. 水蛭的研究概况[J]. 海峡药学, 2012, 24(3): 5-8. DENG M L, LI B H, CHENG Y, et al. Progress of leech research[J]. Strait Pharmaceutical Journal, 2012, 24(3): 5-8. |
| [11] |
崔璐, 郑振秋. PCR技术在中药检验中的应用[J]. 检验检疫学刊, 2019, 29(4): 116-117. CUI L, ZHENG Z Q. Application of PCR technology in the examination of traditional Chinese medicine[J]. Journal of Inspection and Quarantine, 2019, 29(4): 116-117. |
| [12] |
罗达龙, 黄琳. PCR技术在中药鉴定中的应用[J]. 临床医药文献电子杂志, 2017, 4(24): 4731. LUO D L, HUANG L. Application of PCR technology in identification of traditional Chinese medicine[J]. Electronic Journal of Clinical Medical Literature, 2017, 4(24): 4731. |
| [13] |
黄璐琦, 袁媛, 蒋超, 等. 动物药材分子鉴别现状与策略[J]. 中国现代中药, 2017, 19(1): 1-10. HUANG L Q, YUAN Y, JIANG C, et al. Status and strategies on molecular authentication of animal medicines[J]. Modern Chinese Medicine, 2017, 19(1): 1-10. |
| [14] |
田娜, 魏艺聪, 袁媛, 等. 地龙的多重位点特异性PCR鉴别[J]. 中国实验方剂学杂志, 2019, 25(17): 124-129. TIAN N, WEI Y C, YUAN Y, et al. Identification of pheretima by multiplex allele-specific PCR[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(17): 124-129. |
| [15] |
王学勇, 刘春生, 张蓉, 等. 位点特异性PCR方法的建立及对近源种鹿茸药材的鉴别研究[J]. 中国中药杂志, 2009, 34(23): 3013-3016. WANG X Y, LIU C S, ZHANG R, et al. Establishment of allele-specific diagnostic PCR method for identification of antlers[J]. China Journal of Chinese Materia Medica, 2009, 34(23): 3013-3016. |
| [16] |
刘中权, 王义权, 周开亚, 等. 中药材龟甲及原动物的高特异性PCR鉴定研究[J]. 药学学报, 1999, 34(12): 941-945. LIU Z Q, WANG Y Q, ZHOU K Y, et al. Study on highly specific diagnostic PCR of traditional Chinese medicine tortoise plastron and its original animals[J]. Acta Pharmaceutica Sinica, 1999, 34(12): 941-945. |
| [17] |
陈康, 蒋超, 袁媛, 等. 快速PCR方法在蛇类药材真伪鉴别中的应用[J]. 中国中药杂志, 2014, 39(19): 3673-3677. CHEN K, JIANG C, YUAN Y, et al. Application of rapid PCR to authenticate medicinal snakes[J]. China Journal of Chinese Materia Medica, 2014, 39(19): 3673-3677. |
| [18] |
顾观光, 杨鹏举. 神农本草经[M]. 北京: 学苑出版社, 2008: 300. GU G G, YANG P J. Shennong's herbal classic of materia medica[M]. Beijing: Xueyuan Press, 2008: 300. |
| [19] |
H J, SHANG Z J. Supplementary records of famous physicians[M]. Beijing: People's Medical Publishing House, 1986: 301.
|
| [20] |
黄秋阳, 冷静, 甘奇超, 等. 水蛭及其制剂在心脑血管疾病中的应用[J]. 中成药, 2019, 41(8): 1915-1920. HUANG Q Y, LENG J, GAN Q C, et al. Application of leech and its preparation in cardiovascular and cerebrovascular diseases[J]. Chinese Traditional Patent Medicine, 2019, 41(8): 1915-1920. |
| [21] |
沈仕伟, 邸莎, 韦宇, 等. 水蛭临床应用及其用量[J]. 吉林中医药, 2019, 39(3): 313-316. SHEN S W, DI S, WEI Y, et al. Exploration about the clinical application and dosage of leech[J]. Jilin Journal of Chinese Medicine, 2019, 39(3): 313-316. |
| [22] |
吴田泽, 赵小惠, 胡心怡, 等. 中药材DNA条形码鉴定技术应用进展[J]. 中医药导报, 2019, 25(16): 125-130. WU T Z, ZHAO X H, HU X Y, et al. Application progress on DNA barcoding technology of traditional Chinese medicine[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2019, 25(16): 125-130. |
2. Research Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Mudanjiang YouBo Pharmaceutical Co., Ltd., Mudanjiang 157000, China
 2020, Vol. 37
2020, Vol. 37