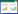文章信息
- 赵伟鹏, 孙琳琳, 佟仲生
- ZHAO Weipeng, SUN Linlin, TONG Zhongsheng
- 三阴性乳腺癌的免疫治疗研究进展
- Advances in immunotherapy for triple-negative breast cancer
- 天津中医药, 2020, 37(11): 1309-1315
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(11): 1309-1315
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.11.23
-
文章历史
- 收稿日期: 2020-07-20
三阴性乳腺癌(TNBC)作为乳腺癌的一种独立临床病理类型,占乳腺癌的12% ~17%,其肿瘤细胞表面缺乏雌激素受体-α(ER-α)、孕激素受体(PR)及人表皮生长因子受体2(HER-2)等可用于治疗特异性表面标志。TNBC相比其他的乳腺癌亚型,TNBC患者具有总生存期短、恶性程度高、侵袭能力强、早期复发率高等临床特征[1]。TNBC因缺乏靶向性的药物,抗内分泌和抗HER-2治疗无效,化疗仍是目前TNBC治疗的主要方式,但临床仅有部分化疗敏感的TNBC(< 18%)患者可从化疗中获益,其中仍有30%左右患者出现原发性或继发性的耐药[2-3]。在过去10年乳腺癌综合治疗取得了重要进展,美国国家综合癌症网络(NCCN)指南不断更新相关治疗进展,随着免疫治疗的时代来临,可能为改善TNBC患者的预后提供新的选择[4]。目前研究者针对TNBC的免疫治疗前景展开了大量的临床试验,见表 1。
近代经典肿瘤免疫理论认为,肿瘤细胞表面抗原可以被抗原递呈细胞识别,从而活化效应性T细胞,激发机体产生免疫反应,达到清除肿瘤细胞的效果。激活的效应T细胞可以直接杀伤肿瘤细胞,可以通过分泌细胞因子诱导肿瘤细胞和基质细胞凋亡,同时可以趋化巨噬细胞实现非特异性免疫杀伤。但肿瘤细胞与肿瘤免疫微环境相互作用后表面可识别的肿瘤抗原和MHC-Ⅱ类分子逐渐减少或缺失,逃避免疫系统的杀伤,从而有利于肿瘤细胞的生长与转移,其中免疫抑制性细胞和分子如调节性T细胞(Treg)、髓源性抑制细胞(MDSCs)、肿瘤相关巨噬细胞和白细胞介素-6(IL-6)等在这个过程中也起到相当重要的作用[5-6]。因此,促进抗原呈递细胞(APCs)的抗原呈递功能、T细胞的抗肿瘤效应以及抑制肿瘤相关的免疫抑制因素是免疫治疗的主要策略。
MDSCs以Gr1和CD11b的表达为特征,是机体免疫耐受的主要细胞,可以通过多种途径抑制机体的获得性和天然性抗肿瘤免疫,使肿瘤细胞逃避机体的免疫监视和攻击,促进肿瘤进展[7-8]。目前研究提示,荷瘤动物和患者的MDSCs从骨髓移出,被肿瘤细胞招募到周边血、脾、淋巴结核肿瘤组织,MDSCs通过直接结合肿瘤内皮细胞,通过抑制淋巴细胞增殖、促进其凋亡,并其干扰素-γ(INF-γ)分泌、促进转化生长因子(TGF)、白细胞介素-10(IL-10)释放等,达到抑制先天适应性免疫的效果。而肿瘤患者血液循环中MDSs增加,与TNBC临床肿瘤分期和转移性肿瘤负荷有关[9]。近期研究发现MDSCs与免疫检查点抑制剂的疗效呈负相关,并由此推测MDSCs在免疫抑制性肿瘤微环境中的主导作用可能是导致免疫检查点抑制剂耐药的主要原因[10-12]。因此,以MDSCs为靶点并联合免疫检查点抑制剂有可能成为逆转免疫抑制性肿瘤微环境的有效策略。
乳腺癌与免疫治疗相关的靶标是由于肿瘤浸润淋巴细胞(TIL)的关联,研究证实TILs存在于乳腺癌的所有分子亚型中,但以三阴性和HER2过表达型最为常见[13-14]。目前研究热点在于高水平的TILs预示着新辅助化疗后的病理完全应答(pCR)。德国1项纳入3 771例接受新辅助化疗的原发性乳腺癌患者的研究证实在所有乳腺癌分子亚型中,TILs水平是新辅助化疗后pCR的预测因子并与之呈正相关。在所有纳入的乳腺癌患者中,相较于低水平TILs组(0%~10%)的乳腺癌患者,中等水平(11%~59%)和高水平TILs(≥60%)组患者的pCR率分别增加7%和24%,差异具有明显的统计学意义(P<0.000 1)。在三阴性乳腺癌患者中也观察到相同的趋势,高水平TILs组的三阴性乳腺癌患者较低水平TILs组患者的pCR率增加19%[14]。此外TILs具有预后价值,TILs数目的增加提示患者预后较好。ECOP的E2197&E1199试验入选481 TNBC患者进行10.6年随访,发现iTILs(瘤内)密度80%,sTILs(间质)密度15%,sTILs每增加10%,死亡或复发风险下降14%(P=0.002);远处复发风险下降18%(P=0.04)[15]。一项纳入139例早期TNBC患者的研究显示在不考虑辅助化疗影响的情况下,以50%为临界值进行二分层时,TILs是TNBC患者无病生存的有力预测因子(P=0.01)[16]。
2 TNBC与肿瘤疫苗肿瘤疫苗指自体或异体肿瘤细胞或其提取物,经过反复冻融或辐照后失去致瘤性,但仍包含肿瘤特异性抗原(TSA)或肿瘤相关抗原(TAA),可以诱导机体产生针对肿瘤细胞的体液免疫或细胞免疫,抑制肿瘤的生长、扩散及复发。
多肽疫苗治疗是根据自身存在的主动免疫为不同患者选择不同多肽并触发针对癌细胞的免疫反应。研究发现表皮生长因子受体(EGFR)家族和胰岛素样生长因子(IGF-1R)肽模拟物/双靶向疫苗的组合,在TNBC细胞系和肿瘤患者中显示具有抗肿瘤效果。Takahashi等[17]在18例多肽治疗转移复发性三阴性乳腺癌(mrTNBC)患者的单臂Ⅱ期试验研究中发现,接种疫苗后的患者观察到细胞毒性T淋巴细胞(CTL)和/或免疫球蛋白G(IgG)反应的升高。Clifton等[18]报告的一项Ⅱb期随机试验的结果显示,一种靶向HER2的肽疫苗—Nelipepimut-S(NPS)与曲妥珠单抗联合使用是安全的。但是,在TNBC患者中观察到了显著的临床获益。与对照组相比(安慰剂联合粒细胞-巨噬细胞集落刺激因子/GM-CSF),NPS组(NPS联合GM-CSF)的DFS有所改善(HR=0.26,95%CI:0.08~0.81,P=0.01)。1项纳入14例化疗无效的mTNBC的Ⅱ期临床试验显示疫苗诱导的免疫增强是一个有利的预后因素,在给予患者多肽疫苗单药治疗后,中位IgG滴度较高组患者的中位OS明显高于中位IgG滴度较低组患者的中位OS(P<0.01)[19]。
树突状细胞(DC)是一种骨髓来源的抗原提呈细胞(APC),它在诱导和调控免疫反应中发挥重要作用。在肿瘤疫苗的研究中,DC常作为一种天然佐剂来诱导肿瘤抗原特异性效应和记忆性细胞。肿瘤DC疫苗可分为肿瘤抗原肽负载的DC肿瘤疫苗、基因修饰的DC肿瘤疫苗和肿瘤全细胞抗原负载的DC肿瘤疫苗,TNBC免疫治疗相关的肿瘤疫苗主要为基因修饰的DC肿瘤疫苗和肿瘤全细胞抗原负载的DC肿瘤疫苗。肿瘤患者体内DC细胞受化疗等因素影响,其数量减少,MHC分子表达下降,降低了其抗原递呈能力,同源异体功能活性正常的DC进行融合疫苗[20-21]。Tomasicchio等[22]在体外使用自体乳腺癌细胞作为“靶细胞”,测试了DC疫苗对自身肿瘤细胞的体外效果。DC疫苗能诱导强大的、剂量依赖性的抗原特异性细胞毒性T淋巴细胞反应(65%),其对自体乳腺癌细胞具有杀伤作用(P<0.005)。Zhang等[23]采用MDA-MB-231荷瘤模型,与对照组相比DC-肿瘤融合疫苗可以更好地刺激同种异体T淋巴细胞的增殖,促进乳腺癌细胞凋亡,体外引发有效的特异性抗肿瘤T细胞反应。
据既往研究发现,T细胞对肿瘤新抗原的识别在免疫检查点抑制剂的治疗中起着重要的作用,肿瘤新抗原的负荷与帕博利珠单抗的反应有关,提示疫苗和免疫检查点抑制剂联合治疗可能是有效的[24]。Kodumudi等[25]采用临床前模型探索了DC瘤苗序贯抗PD-1治疗在HER2阳性乳腺癌中的疗效。结果显示,与对照组小鼠相比,联合治疗显著延缓了实验组小鼠瘤体的生长,并改善了生存率(P<0.01)。
3 TNBC与免疫检查点药物肿瘤细胞可以过表达免疫检查点相关分子,抑制T细胞活性从而逃脱机体的免疫反应而存活。免疫检查点抑制剂(ICB)可以抑制免疫检查点分子的活性从而释放T细胞的活性,恢复对肿瘤细胞的杀伤作用达到抗肿瘤的目的。目前主要有CTLA-4受体抑制剂和PD-1/PD-L1抑制剂两类。肿瘤细胞以及肿瘤周围的免疫细胞上表达PD-L1,说明原来发生过抗肿瘤的免疫反应。肿瘤细胞微环境的细胞高表达PD-L1、CTLA-4、TIM-3、IDO等免疫抑制分子,就是肿瘤细胞免疫逃逸的机制之一[26-27]。PD-L1和CTLA4是分别在T细胞激活的起始和效应阶段的抗原呈递细胞表面上表达的免疫检查点。乳腺癌约50%的PD-L1跨膜蛋白,以雄激素受体(AR)阴性多见,TNBC细胞表达PD-L1,其受体是PD-1,并且还结合PD-L2作为其它配体,同时表达CTLA4。这两者都可能共同表达PIK3A和PTEN,这可能允许双重阻断这些途径的机会更有效的肿瘤反应[26-28]。显示PD-L1上调在基底乳腺癌中更常见,并且与更高的T细胞细胞毒性免疫应答有关。PD-L1上调与更好地生存和化疗反应相关。PD-L1抑制剂对非活性TIL的再激活提示PD-L1上调可能为乳腺癌有希望的策略[29]。
阿特珠单抗是第1个获得美国FDA批准的ICB用于治疗PD-L1阳性转移性三阴性乳腺癌(TNBC)。目前PD-1/PD-L1阻滞剂仍是TNBC免疫治疗的研究热点,初步研究显示单一抗体的亦可有效性,以及与其他化疗药物(例如白蛋白紫杉醇)均显示良好的效果,且在早期和晚期三阴性乳腺癌中均取得了很好的疗效。在Ⅱ期KEYNOTE-086研究中,研究者分别对单药帕博利珠单抗在PD-L1阳性转移性TNBC(mTNBC)患者的一线和后线(二线及以上)治疗中的作用进行了评估。B队列共纳入了84例未接受过系统治疗的转移性TNBC患者(患者肿瘤PD-L1的CPS评分≥1),结果显示单药帕博利珠单抗治疗PD-L1阳性mTNBC患者的ORR为21.4%,没有患者出现4级不良事件,单药帕博利珠单抗具有可控的安全性,并显示出持久的抗肿瘤活性[30]。队列A共纳入了170例既往接受过一线及以上的系统治疗的mTNBC患者(61.8%患者的肿瘤呈PD-L1阳性),结果显示在所有纳入的患者中,ORR为5.3%,在PD-L1阳性患者中,ORR为5.7%,并且有12.9%的患者出现了3或4级的不良事件。与A组患者相比,B组患者对帕博利珠单抗的反应较好。综上所述,对于mTNBC的患者来说,尤其是PD-L1阳性的患者,早期使用帕博利珠单抗可以明显提高药物的反应率[31]。
几种常用于乳腺癌的化疗药物可以促进免疫原性细胞死亡,从而释放肿瘤细胞抗原,促进免疫应答[32]。因此化疗药物联合免疫检查点抑制剂可能取得较好的治疗效果。Schmid等[33]在Ⅲ期KEYNOTE-522研究中发现在早期TNBC患者中,接受帕博利珠单抗联合新辅助化疗的患者的pCR明显高于安慰剂联合新辅助化疗组(P<0.001)。在初始Ⅰ期试验中,MPDL3280A试验中,PD-L1抗体在接受过多次治疗的TNBC患者仍显示出一定的效果。在复发转移性TNBC患者中,与白蛋白紫杉醇联用,客观反应率为66.7%,同时该研究提示PD-L1表达状态与PD-L1抗体治疗效果无明显相关性。在另一项Ⅱ期研究中,采用在第二和第三线治疗方案与PD-L1抗体联合使用,也显示出良好的反应率。同时毒性曲线和药物耐受性是可以被接受的[34]。在IMpassion130试验中(Ⅲ期临床试验),研究者发现在PD-L1阳性的晚期TNBC患者中,相对于安慰剂联合白蛋白紫杉醇组,阿特珠单抗联合白蛋白紫杉醇组患者的PFS延长(P<0.001),且未发现新的不良反应[35]。2020年ASCO公布的ENHANCE 1研究(摘要号:1015)探讨了艾立布林联合帕博利珠单抗的效果。截止到目前为止,该研究纳入了167例转移性TNBC患者,分为一线治疗组(66例)和后线治疗组(101例)。结果显示总体ORR为23.4%,相对于PD-L1阴性患者,PD-L1阳性患者使用该联合治疗的效果更佳,但此种趋势仅见于一线治疗患者。对于mTNBC患者,艾立布林联合ICB效果比单药治疗效果更好,尤其对于PD-L1阳性患者,早期使用可以明显改善ORR。
除联合化疗之外,ICB联合局部治疗也取得了较好的效果。在一项单臂Ⅱ期试验中,McArthur等[36]发现帕博利珠单抗联合放疗在转移性TNBC患者中是可以耐受的,且3/9(33%)的患者在治疗后显示出持久的抗肿瘤反应。PARP抑制剂可以阻断DNA修复途径,促使胞质游离DNA增高,激活cGAS/STING通路,诱导抗肿瘤免疫反应,揭示了PARP抑制剂联合ICB的可能性。临床前模型显示PARP抑制剂联合ICB可以增强效应T细胞的功能[37-38]。1项单臂Ⅱ期临床试验共纳入了55例晚期或转移性TNBC患者,其中15例患者携带突变的BRCA基因,给予所有患者口服尼拉帕利联合静脉使用帕博利珠单抗。结果显示在可评估的47例患者中,ORR为21%,DCR为49%;在15例携带BRCA突变基因的患者中,ORR为47%,DCR为80%,中位PFS为8.3个月;在27例携带野生型BRCA基因的患者中,ORR为11%,DCR为33%,中位PFS为2.1个月。尼拉帕利和帕博利珠单抗联合应用在晚期或转移性TNBC患者中具有很好的抗肿瘤活性,在肿瘤BRCA突变患者中有较高的应答率[39]。
4 TNBC与细胞因子类药物白细胞介素(IL)治疗是有效的方式之一,大剂量IL免疫治疗被证明在癌症如黑素瘤中发挥关键性作用。TNBC的生长也依赖于ILs的炎症信号传导和产生。用于治疗类风湿性关节炎的IL-1β受体拮抗剂在与局部晚期TNBC中的化疗,与树突细胞疫苗联合的试验研究表明,IL可以提高肿瘤疫苗及化疗患者的疗效,其机制可能是阻断IL-6/JAK/Stat通路发挥作用[40-41]。另外,IL-6和IL-8表达的同时抑制TNBC体外的集落形成和细胞存活,同时抑制体内移植瘤的生长。患者标本的Cox多变量分析显示IL-6和IL-8表达预测患者存活时间,可能作为独立的预后预测因子。这些发现一起为IL-6/IL-8信号传导的双重抑制提供了理论依据,作为增强TNBC的免疫治疗策略[42]。Qian等[43]发现IL-17在TNBC(非特殊类型)肿瘤内外的基质细胞中过度表达,另外,肿瘤内IL-17阳性细胞与肿瘤细胞血管内皮生长因子A(VEGFA)表达及肿瘤内微血管密度(MVD)呈正相关,且肿瘤内IL-17阳性的细胞是预测不良PFS的独立预后因素。
5 TNBC与过继细胞疗法过继性免疫细胞治疗(ACT),是指从肿瘤患者体内分离免疫活性细胞,在体外进行扩增和功能鉴定,然后向患者回输,从而达到直接杀伤肿瘤或激发机体的免疫应答达到杀伤肿瘤细胞的目的。过继细胞疗法分为非特异性细胞治疗[如细胞因子诱导的杀伤细胞(CIK),淋巴因自己活得杀伤细胞(LAK),树突状细胞(DC)、自热杀伤细胞(NK)等]和特异性细胞治疗[如融合抗原受体(CAR-T)],目前尚无研究证明非特异性的细胞治疗对肿瘤有明确的疗效。过继性细胞免疫研究已经发展为通过基因工程技术使普通T细胞具有抗肿瘤活性。将具有高度亲和力的肿瘤特异性的T细胞受体(TCR)基因通过反转录病毒等载体导入普通T细胞中。另一种方式是融合抗原受体(CAR)表达CAR的T细胞可以通过主要组织相容性复合体(MHC)非限制性的途径与抗原结合。实验动物和临床试验显示,增强了抗原呈递功能鉴于其以癌症为中心的过表达,FRα一直是针对性的药物传播候选人结合FRα的叶酸缀合的治疗化合物或鼠,嵌合和人源化单克隆抗体体或共轭体内的单体(mAb)克隆,T细胞和刺激性细胞因子恶性组织。另外,转基因的T细胞以嵌合抗原受体(CAR)特异性重定向对于FRα是一个有吸引力的技术,正在积极地进行调查。CAR方法结合了具有T细胞能力的抗体的抗原特异性介导在单次融合中杀死肿瘤细胞,CAR修饰的T细胞主动和具体靶向它们具有指定的抗原并具有持续的能力记忆细胞在体内。因此,CAR修改T靶向肿瘤相关抗原(TAAs)的细胞,如作为FRα,可能比mAb在产生中更有效持久的肿瘤反应。FRα具有细胞内CD27共刺激的特异性CAR信号结构域并评估其疗效T细胞被转导以表达该CAR,人类TNBC移植模型。该研究提示,如TNBC细胞过表达表面FRα蛋白,FRα-特异性CAR-T细胞具有抑制人类的能力TNBC在体内的生长和更强的肿瘤反应[44]。Zhou等[45]使用临床前模型证实CAR-T可以溶解肿瘤细胞,在体内和体外均能有效地抑制TNBC肿瘤的生长,阻断PD-1信号转导可促进CAR-T细胞在体外杀伤肿瘤。目前CAR-T细胞治疗仍主要处于临床前研究阶段,可能为TNBC治疗提供新的选择。
6 TNBC与中药免疫治疗针对三阴性乳腺癌治疗的新靶点,除了热门的免疫治疗外,中医药的发展也很好地填补了三阴性乳腺癌目前的治疗空缺。既往研究证实在乳腺癌治疗的不同阶段给予中药干预,可以改善患者的免疫状态,降低复发转移率,延长生存期[46]。杨阳等[47]探讨了中药对肿瘤相关调节性T细胞的作用及机制。研究发现中药可以减少调节性T细胞的数量或比例、降低调节性T细胞的活性并抑制其功能,解除免疫抑制,促进免疫应答,增强机体抗肿瘤活性,抑制肿瘤生长,改善患者预后。中药还可以通过促进树突状细胞成熟,增强自然杀伤细胞的毒性,促进淋巴细胞增殖活化等起到抗肿瘤的作用。因此,中药联合免疫治疗很有可能在未来成为TNBC新的治疗策略。
目前实现乳腺癌的免疫治疗还存在一些障碍。首先,目前还缺乏完善与统一的评价指标,治疗早期缺乏有意义的分子标志物,因免疫治疗的疗效较传统治疗出现延迟,而最终的疗效评价无法完全适用现行的评价系统。MHC限制性、抗原免疫原性低、肿瘤的异质性以及肿瘤微环境中的免疫抑制因素等都限制了乳腺癌免疫治疗的效果。目前的免疫治疗研究大多集中于局部晚期或转移性乳腺癌的研究,如果早期乳腺癌患者也能从中受益,那么很可能将从根本上改变目前乳腺癌治疗的局面。
| [1] |
FOULKES W D, SMITH I E, REIS-FILHO J S, et al. Triple-negative breast cancer[J]. New England Journal of Medicine, 2010, 363(20): 1938-1948. DOI:10.1056/NEJMra1001389 |
| [2] |
HUTCHINSON L. Breast cancer:TNBC:can we treat the untargetable?[J]. Nature Reviews Clinical Oncology, 2014, 11(7): 379. |
| [3] |
SZÉKELY B, SILBER A L, PUSZTAI L, et al. New therapeutic strategies for triple-negative breast Cancer[J]. Oncology, 2017, 31(2): 130-137. |
| [4] |
STAGG J, ALLARD B. Immunotherapeutic approaches in triple-negative breast cancer:latest research and clinical prospects[J]. Therapeutic Advances in Medical Oncology, 2013, 5(3): 169-181. DOI:10.1177/1758834012475152 |
| [5] |
NISHIMURA T. The regulation of antitumor immune responses by helper T cells——From the bench research to the discovery of H/K-HELP cancer vaccine[J]. Nihon Rinsho Meneki Gakkai Kaishi, 2012, 35(5): 412-423. DOI:10.2177/jsci.35.412 |
| [6] |
LUEN S J, SAVAS P, FOX S B, et al. Tumour-infiltrating lymphocytes and the emerging role of immunotherapy in breast cancer[J]. Pathology, 2017, 49(2): 141-155. |
| [7] |
TEO Z L, VERSACI S, DUSHYANTHEN S, et al. Combined CDK4/6 and PI3Kalpha Inhibition Is Synergistic and Immunogenic in Triple-Negative Breast Cancer[J]. Cancer Research, 2017, 77(22): 6340-6352. DOI:10.1158/0008-5472.CAN-17-2210 |
| [8] |
WESOLOWSKI R, DUGGAN M C, STIFF A, et al. Circulating myeloid-derived suppressor cells increase in patients undergoing neo-adjuvant chemotherapy for breast cancer[J]. Cancer Immunology Immunotherapy, 2017, 66(11): 1437-1447. DOI:10.1007/s00262-017-2038-3 |
| [9] |
SINGH M, RAMOS I, ASAFU-ADJEI D, et al. Curcumin improves the therapeutic efficacy of Listeria(at)-Mage-b vaccine in correlation with improved T-cell responses in blood of a triple-negative breast cancer model 4T1[J]. Cancer Medicine, 2013, 2(4): 571-582. DOI:10.1002/cam4.94 |
| [10] |
TCYGANOV E, MASTIO J, CHEN E, et al. Plasticity of myeloid-derived suppressor cells in cancer[J]. Current Opinion in Immunology, 2018, 51: 76-82. DOI:10.1016/j.coi.2018.03.009 |
| [11] |
OSTRAND-ROSENBERG S, FENSELAU C. Myeloid-derived suppressor cells:immune-suppressive cells that impair antitumor immunity and are sculpted by their environment[J]. Journal of Immunology, 2018, 200(2): 422-431. DOI:10.4049/jimmunol.1701019 |
| [12] |
HOU A, HOU K, HUANG Q, et al. Targeting myeloid-derived suppressor cell, a promising strategy to overcome resistance to immune checkpoint inhibitors[J]. Frontiers in Immunology, 2020, 11: 783. DOI:10.3389/fimmu.2020.00783 |
| [13] |
NOSKE A, MBUS V, WEBER K, et al. Relevance of tumour-infiltrating lymphocytes, PD-1 and PD-L1 in patients with high-risk, nodal-metastasised breast cancer of the German Adjuvant Intergroup Node-positive study[J]. European Journal of Cancer, 2019, 114: 76-88. |
| [14] |
DENKERT C, VON MINCKWITZ G, DARB-ESFAHANI S, et al. Tumour-infiltrating lymphocytes and prognosis in different subtypes of breast cancer:a pooled analysis of 3771 patients treated with neoadjuvant therapy[J]. Lancet Oncology, 2018, 19(1): 40-50. DOI:10.1016/S1470-2045(17)30904-X |
| [15] |
ADAMS S, GRAY R J, DEMARIA S, et al. Prognostic value of tumor-infiltrating lymphocytes in triple-negative breast cancers from two phase Ⅲ randomized adjuvant breast cancer trials:ECOG 2197 and ECOG 1199[J]. Journal of Clinical Oncology, 2014, 32(27): 2959-2966. DOI:10.1200/JCO.2013.55.0491 |
| [16] |
FUCHS T L, PEARSON A, PICKETT J, et al. Why pathologists and oncologists should know about tumour-infiltrating lymphocytes (TILs) in triple-negative breast cancer:an Australian experience of 139 cases[J]. Pathology, 2020, 52(5): 515-521. DOI:10.1016/j.pathol.2020.04.004 |
| [17] |
TAKAHASHI R, TOH U, IWAKUMA N, et al. Feasibility study of personalized peptide vaccination for metastatic recurrent triple-negative breast cancer patients[J]. Breast Cancer Research, 2014, 16(4): R70. DOI:10.1186/bcr3685 |
| [18] |
CLIFTON G T, HALE D, VREELAND TJ, et al. Results of a randomized phase Ⅱb trial of Nelipepimut-S + Trastuzumab versus trastuzumab to prevent recurrences in patients with High-Risk HER2 low-expressing breast cancer[J]. Clinical Cancer Research, 2020, 26(11): 2515-2523. DOI:10.1158/1078-0432.CCR-19-2741 |
| [19] |
TOH U, SAKURAI S, SAKU S, et al. Early phase Ⅱ study of mixed 19-peptide vaccine monotherapy for refractory triple-negative breast cancer[J]. Cancer Science, 2020, 111(8): 2760-2769. DOI:10.1111/cas.14510 |
| [20] |
PINZON-CHARRY A, SCHMIDT C, LÓPEZ J A. Dendritic cell immunotherapy for breast cancer[J]. Expert Opinion on Biological Therapy, 2006, 6(6): 591-604. DOI:10.1517/14712598.6.6.591 |
| [21] |
GELAO L, CRISCITIELLO C, ESPOSITO A, et al. Dendritic cell-based vaccines:clinical applications in breast cancer[J]. Immunotherapy, 2014, 6(3): 349-360. DOI:10.2217/imt.13.169 |
| [22] |
TOMASICCHIO M, SEMPLE L, ESMAIL A, et al. An autologous dendritic cell vaccine polarizes a Th-1 response which is tumoricidal to patient-derived breast cancer cells[J]. Cancer Immunology Immunotherapy, 2019, 68(1): 71-83. DOI:10.1007/s00262-018-2238-5 |
| [23] |
ZHANG P, YI S, LI X, et al. Preparation of triple-negative breast cancer vaccine through electrofusion with day-3 dendritic cells[J]. PLoS One, 2014, 9(7): e102197. DOI:10.1371/journal.pone.0102197 |
| [24] |
MCGRANAHAN N, FURNESS A J, ROSENTHAL R, et al. Clonal neoantigens elicit T cell immunoreactivity and sensitivity to immune checkpoint blockade[J]. Science, 2016, 351(6280): 1463-1469. DOI:10.1126/science.aaf1490 |
| [25] |
KODUMUDI K N, RAMAMOORTHI G, SNYDER C, et al. Sequential Anti-PD1 Therapy Following Dendritic Cell Vaccination Improves Survival in a HER2 Mammary Carcinoma Model and Identifies a Critical Role for CD4 T Cells in Mediating the Response[J]. Frontiers in Immunology, 2019, 10: 1939. DOI:10.3389/fimmu.2019.01939 |
| [26] |
BOTTI G, COLLINA F, SCOGNAMIGLIO G, et al. Programmed Death Ligand 1(PD-L1) Tumor Expression Is Associated with a Better Prognosis and Diabetic Disease in Triple Negative Breast Cancer Patients[J]. International Journal of Molecular Sciences, 2017, 18(2): 459. DOI:10.3390/ijms18020459 |
| [27] |
MORI H, KUBO M, YAMAGUCHI R, et al. The combination of PD-L1 expression and decreased tumor-infiltrating lymphocytes is associated with a poor prognosis in triple-negative breast cancer[J]. Oncotarget, 2017, 8(9): 15584-15592. DOI:10.18632/oncotarget.14698 |
| [28] |
TOMIOKA N, AZUMA M, IKARASHI M, et al. The therapeutic candidate for immune checkpoint inhibitors elucidated by the status of tumor-infiltrating lymphocytes (TILs) and programmed death ligand 1(PD-L1) expression in triple negative breast cancer (TNBC)[J]. Breast Cancer, 2018, 25(1): 34-42. DOI:10.1007/s12282-017-0781-0 |
| [29] |
SABATIER R, FINETTI P, MAMESSIER E, et al. Prognostic and predictive value of PDL1 expression in breast cancer[J]. Oncotarget, 2015, 6(7): 5449-5464. DOI:10.18632/oncotarget.3216 |
| [30] |
ADAMS S, LOI S, TOPPMEYER D, et al. Pembrolizumab monotherapy for previously untreated, PD-L1-positive, metastatic triple-negative breast cancer:cohort B of the phase Ⅱ KEYNOTE-086 study[J]. Annals of Oncology, 2019, 30(3): 405-411. DOI:10.1093/annonc/mdy518 |
| [31] |
ADAMS S, SCHMID P, RUGO H S. Pembrolizumab monotherapy for previously treated metastatic triple-negative breast cancer:cohort A of the phase Ⅱ KEYNOTE-086 study[J]. Annals of Oncology, 2019, 30(3): 397-404. DOI:10.1093/annonc/mdy517 |
| [32] |
VANMEERBEEK I, SPROOTEN J, DE RUYSSCHER D, et al. Trial watch:chemotherapy-induced immunogenic cell death in immuno-oncology[J]. Oncoimmunology, 2020, 9(1): 1703449. DOI:10.1080/2162402X.2019.1703449 |
| [33] |
SCHMID P, CORTES J, PUSZTAI L, et al. Pembrolizumab for Early Triple-Negative Breast Cancer[J]. New England Journal of Medicine, 2020, 382(9): 810-821. DOI:10.1056/NEJMoa1910549 |
| [34] |
ALICE G. Anti-PD-L1 agent shows activity in early study of triple-negative breast cancer[J]. The ASCO POST, 2015, 6(10): 10. |
| [35] |
SCHMID P, ADAMS S, RUGO H S, et al. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer[J]. New England Journal of Medicine, 2018, 379(22): 2108-2121. DOI:10.1056/NEJMoa1809615 |
| [36] |
MCARTHUR H L, BARKER C A, GUCALP A, et al. A single-arm, phase Ⅱ study assessing the efficacy of pembrolizumab (pembro) plus radiotherapy (RT) in metastatic triple negative breast cancer (mTNBC)[J]. Journal of Clinical Oncology, 2018, 36(S5): 14. |
| [37] |
HIGUCHI T, FLIES D B, MARJON N A, et al. CTLA-4 Blockade Synergizes Therapeutically with PARP Inhibition in BRCA1-Deficient Ovarian Cancer[J]. Cancer Immunology Research, 2015, 3(11): 1257-1268. DOI:10.1158/2326-6066.CIR-15-0044 |
| [38] |
JIAO S, XIA W, YAMAGUCHI H, et al. PARP Inhibitor Upregulates PD-L1 Expression and Enhances Cancer-Associated Immunosuppression[J]. Clinical Cancer Research, 2017, 23(14): 3711-3720. DOI:10.1158/1078-0432.CCR-16-3215 |
| [39] |
VINAYAK S, TOLANEY S M, SCHWARTZBERG L, et al. Open-Label Clinical Trial of Niraparib Combined With Pembrolizumab for Treatment of Advanced or Metastatic Triple-Negative Breast Cancer[J]. JAMA Oncology, 2019, 5(8): 1132-1140. DOI:10.1001/jamaoncol.2019.1029 |
| [40] |
IBRAHIM S A, GADALLA R, EL-GHONAIMY E A, et al. Syndecan-1 is a novel molecular marker for triple negative inflammatory breast cancer and modulates the cancer stem cell phenotype via the IL-6/STAT3, Notch and EGFR signaling pathways[J]. Molecular Cancer, 2017, 16(1): 57. DOI:10.1186/s12943-017-0621-z |
| [41] |
IBRAHIM S A, HASSAN H, VILARDO L, et al. Syndecan-1(CD138) modulates triple-negative breast cancer stem cell properties via regulation of LRP-6 and IL-6-mediated STAT3 signaling[J]. PLoS One, 2013, 8(12): e85737. DOI:10.1371/journal.pone.0085737 |
| [42] |
HARTMAN Z C, POAGE G M, DEN HOLLANDER P, et al. Growth of triple-negative breast cancer cells relies upon coordinate autocrine expression of the proinflammatory cytokines IL-6 and IL-8[J]. Cancer Research, 2013, 73(11): 3470-3480. DOI:10.1158/0008-5472.CAN-12-4524-T |
| [43] |
QIAN X L, XU P, ZHANG Y Q, et al. Increased number of intratumoral IL-17+ cells, a harbinger of the adverse prognosis of triple-negative breast cancer[J]. Breast Cancer Research and Treatment, 2020, 180(2): 311-319. DOI:10.1007/s10549-020-05540-6 |
| [44] |
SONG D G, YE Q, POUSSIN M, et al. Effective adoptive immunotherapy of triple-negative breast cancer by folate receptor-alpha redirected CAR T cells is influenced by surface antigen expression level[J]. Journal of Hematology & Oncology, 2016, 9(1): 56. |
| [45] |
ZHOU R, YAZDANIFAR M, ROY L D, et al. CAR T cells targeting the tumor MUC1 glycoprotein reduce triple-negative breast cancer growth[J]. Frontiers in Immunology, 2019, 10: 1149. DOI:10.3389/fimmu.2019.01149 |
| [46] |
瞿文超, 吴雪卿, 冯佳梅, 等. 中药复方对不同分子分型乳腺癌患者无病生存率及总生存率的影响[J]. 中医药学报, 2017, 45(6): 92-95. QU W C, WU X Q, FENG J M, et al. Effect of Chinese herbal compound on disease-free survival rate and overall survival rate of breast cancer patients with different molecular types[J]. Acta Chinese Medicine and Pharmacology, 2017, 45(6): 92-95. |
| [47] |
杨阳, 陈新. 中药及其活性成分对肿瘤相关调节性T细胞抑制作用研究[J]. 自然杂志, 2019, 41(4): 261-265. YANG Y, CHEN X. Research on the inhibitory effect of traditional Chinese medicine and its active ingredients on tumor-related regulatory T cells[J]. Chinese Journal of Nature, 2019, 41(4): 261-265. |
 2020, Vol. 37
2020, Vol. 37