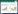文章信息
- 胡还甫, 阮斌, 邹进, 李习平
- HU Huanfu, RUAN Bin, ZOU Jin, LI Xiping
- 肿痛巴布膏对大鼠闭合性软组织损伤模型的影响
- Effect of Zhongtong Cataplasms on rats with closed soft tissue injury
- 天津中医药, 2020, 37(12): 1420-1424
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(12): 1420-1424
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.12.21
-
文章历史
- 收稿日期: 2020-07-15
肿痛巴布膏系民间验方,由血三七、血当归、八里麻、续断加工做成巴布膏,具有舒筋活血,消肿止痛的功效,常用于治疗闭合性软组织损伤。现将其对大鼠闭合性软组织损伤模型的影响实验研究报告如下。
1 实验材料 1.1 药品 1.1.1 受试品肿痛巴布膏,根据实验需要制成3种规格,分别为12.96 g生药/片,6.48 g生药/片,3.24 g生药/片,批号:20180301,有效期至2019年9月,由湖南省中医药科技发展总公司提供。
1.1.2 阳性对照药扶他林软膏,由北京诺华制药有限公司生产,批号:X8109,有效期至2019年8月29日。适应症:用于缓解肌肉,软组织和关节中度疼痛。
1.2 实验动物SD大鼠72只,SPF级,雌雄各半,体质量180.7~217.7 g,动物合格证号:No.43004700007877,购于湖南斯莱克景达实验动物有限公司,实验动物生产许可证号:SCXK(湘)2013-0004。
1.3 主要试剂前列腺素E2(PGE2)酶联免疫吸附测定(ELISA)试剂盒(美国RB公司,批号:201802,有效期至2019年8月)。
1.4 主要仪器MR-96A酶标仪(深圳迈瑞生物医疗电子股份有限公司);DK-600B电热恒温水槽(上海森信实验仪器有限公司);S10型手提式高速分散器(上海新芝);软组织打击器(自制);DL-5M型多管低速冷冻离心机(长沙平凡仪器仪表有限公司);AR-109型电子天平(康市艾瑞贸易有限公司)。
2 实验方法 2.1 造模与分组SD大鼠按性别体质量随机分为6组,每组12只,分别为空白对照组、模型对照组、肿痛巴布膏低(0.35 g生药/只)、中(0.70 g生药/只)、高(1.40 g生药/只)剂量组和扶他林软膏组(0.20 g/只)。造模前给大鼠右腿脱毛,用2%戊巴比妥钠按40 mg/kg剂量腹腔注射将大鼠麻醉,固定于软组织打击器上,右腿外展固定,于右小腿中部外侧软组织标记定位,将打击锤拉至约16 cm高度,松开打击锤,自由落下,连击7下。打击后肉眼即见皮肤肿胀、瘀血,以无皮肤破裂为标准,造模当天开始给药,每日给药1次,连续给药7 d,模型对照组给予空白基质[1-2]。空白对照组大鼠只接受脱毛和麻醉,给药期间不给药但进行包扎处理。造模前和造模后1 h以及给药期间每天测定损伤标记处的周长;分别于给药后2、4、7 d给药后1 h每组各取4只大鼠处死,进行损伤症状指数评分,测定损伤组织中PGE2的含量,进行组织形态学检查[3-4]。
2.2 检测指标 2.2.1 小腿周长的测定造模前和造模后1 h以及给药期间每天测定损伤标记处的周长。
2.2.2 损伤症状指数每组大鼠分别在造模后2、4、7 d各取4只大鼠,采血后二氧化碳(CO2)麻醉处死,观察伤肢肿胀和瘀斑等症状表现,并分级评分。1)皮下瘀血:多量块状计2分,少量点状计1分,无瘀血者计0分。2)肌肉肿胀:明显肿胀计2分,稍有肿胀计1分,无肿胀者计0分。3)皮肤颜色:紫暗色深计2分,暗红色浅计1分,色泽正常计0分。计算每只动物的总评分[5]。
2.2.3 PGE2含量测定取打击中心部位肌肉组织,生理盐水漂洗干净,滤纸吸干水分,称取肌肉组织约0.5 g,加入9倍体积冰生理盐水后,于高速分散器中粉碎,以2 500 r/min 4 ℃离心15 min,离心半径为225 mm,收集上清液,采用PGE2 ELISA试剂盒检测各组标本PGE2含量[6-8]。
2.2.4 组织形态学检查截下已经切除少量肌肉的整支右腿,置10%甲醛溶液内浸泡。切取伤部组织样本(包括皮肤、皮下组织、肌肉),经常规脱水、包埋、苏木精-伊红(HE)染色后,光镜下观察,指标包括创伤局部皮下组织、肌肉组织等病理表现。
2.3 剂量设计肿痛巴布膏临床拟用量:每日39 g生药,根据体表面积法换算成大鼠等效剂量为3.51 g生药/kg。本实验以肿痛巴布膏大鼠等效剂量作为中剂量,另设低、高剂量,分别为等效剂量的1/2、2倍,即1.76 g、7.02 g生药/kg。又肿痛巴布膏含量为12.96 g、6.48 g生药/片和3.24 g生药/片,每片面积为7 cm×10 cm,故根据上述大鼠剂量设计,可得具体剂量设计见表 1,扶他林软膏组的剂量参照文献[2, 4]。
采用SPSS 23.0进行统计分析,实验数据用均数±标准差(x±s)表示,如符合正态性和方差齐性,多组间比较采用单因素方差分析,组间两两比较采用LSD法;如不符合则多组间比较采用Kruskal-Wallis H检验,P < 0.05为差异具有统计学意义。
3 结果 3.1 肿痛巴布膏对大鼠软组织损伤模型小腿周长的影响造模前各组的周长无统计学差异,造模后,与空白对照组比较,其它各组周长显著增加(P < 0.01),提示大鼠闭合性软组织肿胀。与模型对照组比较,给药第2天肿痛巴布膏低、中、高剂量对周长无显著影响,第4天和第7天肿痛巴布膏中、高剂量能显著减小模型大鼠小腿的周长(P < 0.05或P < 0.01),提示肿痛巴布膏具有消肿作用。阳性药扶他林软膏第4天和第7天能显著减少大鼠的周长(P < 0.05)。见表 2。
|
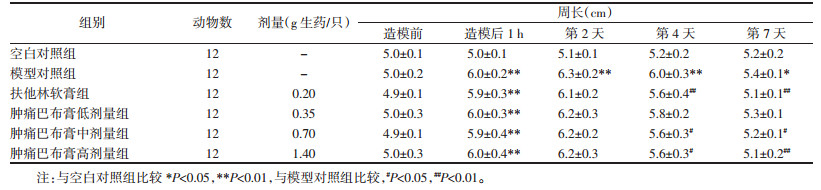
与空白对照组比较,模型对照组损伤症状指数差异具有统计学意义(P < 0.05),提示大鼠闭合性软组织损伤模型成功。与模型对照组比较,给药第2天肿痛巴布膏低、中、高剂量对损伤症状指数无显著影响,第4天和第7天肿痛巴布膏中、高剂量能显著降低模型大鼠的损伤症状指数(P < 0.05)。阳性药扶他林软膏第4天和第7天能显著减少大鼠的损伤症状指数(P < 0.05)。见表 3。
|
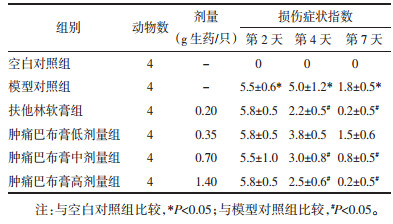
与空白对照组比较,模型对照组炎症因子PGE2的含量显著增加(P < 0.05)。与模型对照组比较,给药第2天肿痛巴布膏低、中、高剂量对PGE2的含量无显著影响,第4天和第7天肿痛巴布膏高剂量能显著降低模型大鼠的PGE2的含量(P < 0.05)。阳性药扶他林软膏第2天、第4天和第7天能显著降低大鼠的PGE2的含量(P < 0.01或P < 0.05)。见表 4。
|
空白对照组的皮下组织一直无病理变化;模型对照组,造模后第2天,皮下组织可见大量红细胞,炎症细胞浸润,炎症程度最为严重;第4天,皮下组织可见少量红细胞,炎症细胞浸润,炎症程度有所减轻;第7天,皮下组织血管充血、出血,间质轻度水肿,炎症程度进一步减轻。
肿痛巴布膏低剂量组,给药后第2天,与模型组情况相似;第4天,可见少量散在红细胞,纤维组织增生,间质少量炎症细胞浸润,炎症程度有所减轻;第7天,可见大量红细胞,间质轻度水肿,炎症程度进一步减轻。
肿痛巴布膏中剂量组,给药后第2天,可见大量红细胞,间质少量炎症细胞浸润,炎症程度最为严重;第4天可见少量散在红细胞,纤维组织增生,间质少量炎症细胞浸润,炎症程度有所减轻;第7天,纤维组织增生,间质少量炎性细胞浸润,炎症程度进一步减轻。
肿痛巴布膏高剂量组,给药后第2天,可见少量红细胞,间质中少量炎症细胞,炎症程度最为严重;第4天,间质中少量散在红细胞,散在炎症细胞,炎症程度明显减轻;第7天,皮下组织轻度水肿,间质中少量炎性细胞,炎症基本恢复。
扶他林软膏组,给药后第2天,可见少量散在红细胞,间质少量炎症细胞浸润,炎症程度最为严重;第4天,可见少量散在红细胞,间质少量炎症细胞浸润,炎症程度明显减轻;第7天,血管轻度充血,间质少量散在炎性细胞,炎症程度进一步减轻,已经基本恢复。见图 1。
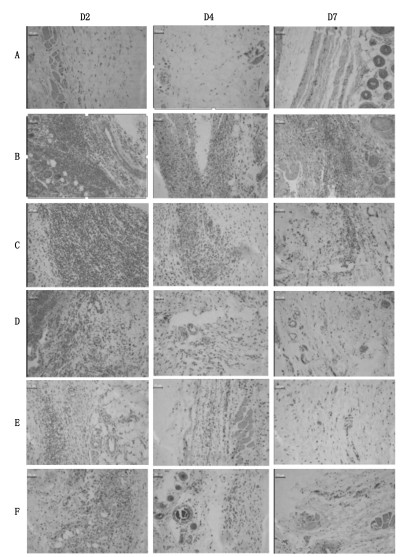
|
| 注:A.空白对照组,B.模型对照组,C.肿痛巴布膏低剂量组,D.肿痛巴布膏中剂量组,E.肿痛巴布膏高剂量组,F-扶他林软膏组。 图 1 皮下组织病理切片图(HE,×200) Fig. 1 Subcutaneous histopathological section(HE, ×200) |
空白对照组的肌肉组织一直无病理变化;模型对照组,造模后第2天,肌肉组织中肌细胞变性坏死,血管出血,间质中大量炎症细胞浸润,炎症程度最为严重;第4天,肌细胞变性,血管出血,间质中大量炎性细胞浸润,炎症程度有所减轻;第7天,肌细胞变性,血管出血,间质中大量炎性细胞浸润,炎症程度进一步减轻。
肿痛巴布膏低剂量组,给药后第2天,少量肌细胞变性坏死,间质轻度水肿,炎症细胞浸润,炎症程度最为严重;第4天,间质轻度水肿,炎性细胞浸润,炎症程度有所减轻;第7天,间质轻度水肿,炎性细胞浸润,炎症程度进一步减轻。
肿痛巴布膏中剂量组,给药后第2天,少量肌细胞变性坏死,间质少量炎症细胞浸润,炎症程度最为严重;第4天,间质少量炎性细胞浸润,炎症程度有所减轻;第7天,间质少量炎性细胞浸润,炎症程度进一步减轻。
肿痛巴布膏高剂量组,给药后第2天,间质少量炎症细胞浸润,炎症程度最为严重;第4天,无明显病理变化,炎症程度明显有所减轻;第7天,无明显病理变化,炎症基本恢复。
扶他林软膏组,给药后第2天,少量肌细胞变性坏死,间质炎症细胞浸润,炎症程度最为严重;第4天,无明显病理变化,炎症程度明显减轻;第7天,肌肉组织无明显病理变化,炎症程度进一步减轻,已经基本恢复。见图 2。
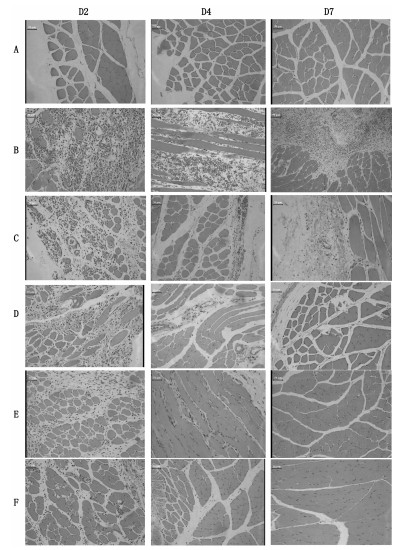
|
| 注:A.空白对照组,B.模型对照组,C.肿痛巴布膏低剂量组,D.肿痛巴布膏中剂量组,E.肿痛巴布膏高剂量组,F-扶他林软膏组。 图 2 肌肉组织病理切片图(HE,×200) Fig. 2 Pathological section of muscle tissue(HE, ×200) |
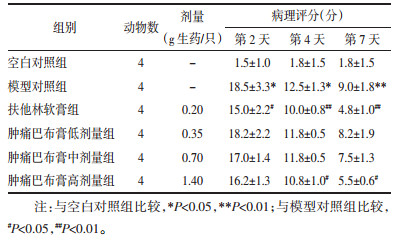
与空白对照组比较,模型对照组病理评分显著增加(P < 0.05)。与模型对照组比较,给药第2天肿痛巴布膏低、中、高剂量对病理评分无显著影响,第4天和第7天肿痛巴布膏高剂量能显著降低模型大鼠的病理评分(P < 0.05),阳性药扶他林软膏第2天、第4天和第7天能显著降低大鼠的病理评分(P < 0.01或P < 0.05)。见表 5。
|
上述结果表明,肿痛巴布膏中、高剂量能显著减小闭合性软组织损伤模型大鼠肿胀小腿的周长和减少损伤症候指数,肿痛巴布膏高剂量能显著减少闭合性软组织损伤模型大鼠的PGE2的含量和改善组织形态学,肿痛巴布膏对闭合性软组织损伤模型大鼠具有明显的改善作用。
| [1] |
肖鹏, 刘显东, 徐强, 等. 二黄新伤凝胶膏治疗大鼠急性软组织损伤的效果研究[J]. 中国中医骨伤科杂志, 2018, 11(26): 46-49. XIAO P, LIU X D, XU Q, et al. Effect of Erhuang Xinshang gel paste treating on acute soft tissue injury in ratsr[J]. Chinese Journal of Traditional Medical Traumatology & Orthopedics, 2018, 11(26): 46-49. |
| [2] |
高渐联, 李汉伟, 邓智建, 等. 泽兰甲醇提取物对慢性软组织损伤模型大鼠的影响及其机制[J]. 中成药, 2018, 3(26): 51-55. GAO J L, LI H W, DENG Z J, et al. The effects and mechanism of methanol extract from Zeeland on chronic soft tissue injury model rats[J]. Chinese Traditional Patent Medicine, 2018, 3(26): 51-55. |
| [3] |
陈奇. 中药药理研究方法学[M]. 北京: 人民卫生出版社, 2010. CHEN Q. Chinese medicine pharmacological research methodology[M]. Beijing: People's Medical Publishing House, 2010. |
| [4] |
EGHBALZADEH K, BRIXIUS K, BLOCH W, et al. Skeletal muscle nitric oxide (NO) synthases and NO-signaling in "diabesity"-what about the relevance of exercise training interventions?[J]. Nitric Oxide, 2014, 37: 28-40. DOI:10.1016/j.niox.2013.12.009 |
| [5] |
ALVES A N, RIBEIRO B G, FERNANDES K P, et al. Comparative effects of low-level laser therapy pre-and post-injury on mRNA expression of MyoD, myogenin, and IL-6 during the skeletal muscle repair[J]. Lasers in Medical Science, 2016, 31(4): 679-685. DOI:10.1007/s10103-016-1908-9 |
| [6] |
KALINSKI P. Regulation of immune responses by prostaglandin E2[J]. Journal of Immunology, 2012, 188(1): 21-28. DOI:10.4049/jimmunol.1101029 |
| [7] |
覃博, 韦葛谨, 潘小清. 接活肿痛膏对急性软组织损伤大鼠的影响及机制研究[J]. 中药药理与临床, 2016, 3(32): 9-12. QIN B, WEI G J, PAN X Q. Study on the effect and mechanism of Jiehuo Zhongtong Gao on acute soft tissue injury rats[J]. Pharmacology and Clinics of Chinese Materia Medica, 2016, 3(32): 9-12. |
| [8] |
杨大伟, 宋雪, 罗宗键, 等. 丹归消肿膏外敷对大鼠急性软组织损伤的消肿止痛作用[J]. 长春中医药大学学报, 2017, 4(33): 277-282. YANG D W, SONG X, LUO Z J, et al. The effects of inflammation and pain relief of Dangui Xiaozhong Gao external application on acute soft tissue injury in rats[J]. Journal of Changchun University of Chinese Medicine, 2017, 4(33): 277-282. |
 2020, Vol. 37
2020, Vol. 37