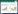文章信息
- 程传景, 丛龙飞, 李振强, 郝二伟, 侯小涛, 侯媛媛, 白钢, 邓家刚
- CHENG Chuanjing, CONG Longfei, LI Zhenqiang, HAO Erwei, HOU Xiaotao, HOU Yuanyuan, BAI Gang, DENG Jiagang
- 金花茶叶中冲山茶苷的筛查、制备及抗肿瘤活性考察
- Screening, preparation and anti-tumor activity investigation of okicamelliaside in Camellia nitidissima C. W. Chi
- 天津中医药, 2020, 37(12): 1425-1430
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(12): 1425-1430
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.12.22
-
文章历史
- 收稿日期: 2020-10-11
2. 广西中医药大学农作物废弃物功能成分研究协同创新中心, 南宁 530200
金花茶(Camellia nitidissima C. W. Chi)是山茶科山茶属的常绿灌木或小乔木,《本草纲目》中记载:“山茶产南方,深冬开花,红瓣黄蕊。”金花茶是山茶科中最早发现的开金黄色蜡质花朵的物种,被誉为“植物界的大熊猫”“茶族皇后”[1]。2010年金花茶被批准为国家新资源食品,其花和叶为广西壮族的传统用药,收载于《广西中药材标准》和《现代本草纲目》中,用于防治咽喉炎、肾炎、黄疸性肝炎、痢疾、肿瘤、便血、高血压和月经不调等病症[2]。冲山茶苷(okicamelliaside),次甲基鞣花酸-4’葡萄糖苷,为金花茶中一种鞣花酸衍生物,2010年日本学者首次发现并命名[3]。虽然冲山茶苷在金花茶叶中含量较为丰富,但对其研究报道的文献极少[4-5]。
近红外光谱分析技术操作简单,检测迅速,分析成本低,对原药材和药材提取物样本可以进行无损的定性及定量分析,因此近年来在中药材分析方面有着较好的应用[6-7]。药材中活性化合物的含量对其功效的发挥、分离提取工艺以及制备效率有直接的影响,快速筛选出高含量的药材是保障质量的关键。本研究建立了以冲山茶苷为质量标志物,利用近红外技术直接对不同产地的金花茶叶片中冲山茶苷的含量进行快速筛选与评价的方法,并选择高含量的优质样品,通过大孔吸附树脂吸附分离,结合高效制备液相进行纯化,建立了冲山茶苷的定向分离制备方法,为其生物活性研究提供了保障。
1 材料 1.1 主要仪器MASTER10傅里叶变换近红外光谱仪(上海荧飒光学有限公司);岛津LC-15C液相色谱仪(日本岛津公司);JMF-320闪蒸仪(智晶生物科技股份有限公司);CoMetro高效制备液相色谱仪(美国CoMetro公司);Waters Milford UPLC-Q/TOF MS液质联用仪(美国Waters公司);Varian 7.0T FTMS傅里叶变换高分辨质谱仪(美国Varian公司);400 MHz全数字核磁共振仪(德国Bruker公司);MD SpectraMax i3x型多功能酶标仪(奥地利Molecular Devices公司)。
1.2 药材与试剂金花茶样品由广西中医药大学广西中药药效研究重点实验室提供,经侯小涛教授鉴定为山茶科山茶属植物金花茶Camellia nitidissima C. W. Chi的叶;冲山茶苷对照品(自主分离制备,经高效液相色谱法(HPLC)测定含量在95%以上);分析纯无水乙醇(天津市康科德科技有限公司);色谱级甲醇、乙腈(德国Merck公司);AB-8大孔吸附树脂(北京索莱宝科技有限公司);CCK-8检测试剂盒(北京Bioss生物技术有限公司)。
1.3 主要软件布鲁克近红外数据分析软件OPUS 7.5,数据处理软件Graphpad Prism 6.0。
2 方法 2.1 近红外光谱法检测 2.1.1 近红外原始光谱的采集取自然阴干的金花茶叶,60 ℃加热4 h得待测样品。选取直径大于3 cm平整的叶片置于采集池光斑下,直接进行近红外原始光谱的采集。傅里叶变换近红外光谱仪的检测条件设为:分辨率8 cm-1,样品扫描次数64次,扫描范围12 000~4 000 cm-1,扫描方式为连续光斑漫反射扫描。每个样品重复测定3次,取平均光谱。
2.1.2 近红外光谱模型的建立选取50片金花茶叶片的近红外光谱及其所对应的冲山茶苷含量,通过OPUS 7.5软件定量模块进行建模操作,建立冲山茶苷的近红外光谱分析方法,采用交叉验证的方法,分别对光谱预处理方法、光谱区段的选择进行考察优化。以相关系数(R2)、交叉检验均方根误差(RMSECV)大小以及相对分析误差(RPD)为评价指标,对于模型预测性能进行评判。其中R2越接近1,RMSECV越小,模型的准确度及预测效果越好;当RPD>3.0,则认为所建模型具有较高可靠性,可用于后续分析。进一步的另取30批金花茶叶片,采集原始的近红外光谱,并参照OPUS 7.5分析方法[8],调入所建好的模型进行分析,预测待测样品中冲山茶苷的含量,并与HPLC含量测定结果相比较,考察模型的预测效果。
2.2 HPLC分析及含量测定 2.2.1 样本的制备选取光谱扫描部位所对应的金花茶叶片,分别称质量,粉碎后按10:1的比例(V/W)加入50%甲醇溶液,超声提取30 min后,3 600 r/min下离心10 min,离心半径65 mm,上清液经0.22 μm微孔滤膜滤过,收集续滤液用于HPLC分析。
2.2.2 液相色谱条件采用岛津LC-15C液相色谱仪,Phenomenex Luna C18色谱柱(250 mm×4.6 mm,5 μm);流速1.0 mL/min;紫外检测器,检测波长254 nm;样品进样量:20 μL;柱温35 ℃;流动相:A为0.1%甲酸-水溶液,B为乙腈;二元梯度洗脱:0~5 min,2%~20%B;5~7 min,20%~25%B;7~40 min,25~35%B;40~45 min,35%~100%B。
2.2.3 含量测定采用上述色谱条件检测冲山茶苷的含量,通过获取峰面积积分进行含量的计算。
2.3 高效制备液相色谱条件CoMetro高效制备液相色谱仪,选用Phenomenex Luna C18色谱柱(250 mm×21.2 mm,5 μm);流速9 mL/min;CoMetro紫外检测器,检测波长254 nm;进样量:500 μL;柱温35 ℃;流动相:A为纯水,B为甲醇;二元梯度洗脱:0~7 min,10%~25%B;7~20 min,25%~40%B;20~35 min,40~48%B;35~36 min,48%~100%B;36~45 min,100%~100%B。
2.4 冲山茶苷的结构表征取冲山茶苷样品,配置成0.1 mg/mL的甲醇溶液,采用傅里叶变换高分辨质谱仪进行质谱分析,测定分子量。另取冲山茶苷样品10 mg,溶于0.5 mL氘代DMSO中,采用Bruker 400 MHz全数字核磁共振仪,测定1H NMR和13C NMR图谱。
2.5 细胞毒实验采用MTS法检测冲山茶苷对不同细胞系(A375、MCF-7、A549)的细胞毒活性。A375、MCF-7、A549细胞株均由本实验室保存。其中A549细胞培养采用F12-K完全培养基(含10%FBS和1%双抗),A375与MCF-7采用DMEM高糖完全培养基。培养箱条件为:无菌,37 ℃,5 %CO2。待培养的细胞生长至80%密度时进行消化,取100 μL细胞悬液接种于96孔培养板中,置于培养箱中培养过夜。细胞贴壁后将3.125、6.25、12.5、25、50、100 μmol/L不同梯度的冲山茶苷分别加入到96孔板中,每组设置6个复孔,给药孵育72 h。加入CCK-8溶液10 μL,37 ℃条件下孵育30 min后,采用酶标仪在450 nm处测定其吸光度,绘制抑制曲线,计算IC50值。
2.6 细胞凋亡将A549细胞消化,细胞混悬液接种于6孔培养板中,待细胞贴壁生长至70%密度时,加入供试溶液,置培养箱中孵育24 h。实验设置空白对照组和不同浓度(10、20、40、80 μmol/L)冲山茶苷给药组。孵育结束后将六孔板中的细胞消化,收集于流式管中,4 ℃条件下800 rpm离心3 min,弃去上清液,用磷酸盐缓冲液(PBS)缓冲液重悬细胞后,再次离心并弃去上清液,重复操作两次。按照Annexin V-FITC/PI双染试剂盒说明书的操作,设置空白细胞不染组、空白细胞的PI、FITC单染组、空白细胞双染组以及不同浓度(10、20、40 μmol/L)的冲山茶苷双染组,分别对应加入PI或FITC。加入后在半小时内完成上机检测,采用FlowJo软件进行数据处理。
2.7 统计学方法实验数据采用GraphPad 6.0进行分析,除未有说明外,数据采用平均值±标准误来表示。t检验用于组间数据分析,P<0.05时认为具有显著性差异。
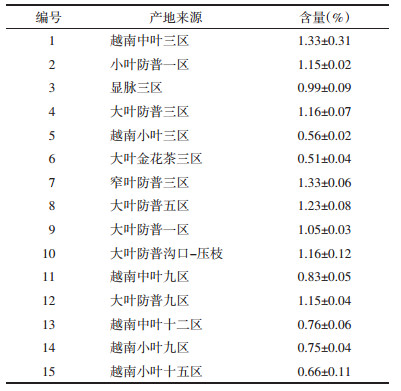
3 结果 3.1 冲山茶苷的近红外光谱拟合分别采集不同金花茶树叶的近红外光谱,通过矢量归一化进行预处理后,消除了背景干扰,见图 1A。同时通过HPLC法分别测定50批光谱采集部位的冲山茶苷的含量,发现金花茶叶中冲山茶苷的含量差异较大,其中最高含量可达1.79%,最低仅为0.42%,含量平均值在1%左右,见图 1B。将上述50批次样品的近红外预处理光谱与其冲山茶苷含量进行建模拟合,经优化发现选用4 600~4 200 cm-1波段所构建的模型具有较高的稳健性,见图 1C,相关系数R2=93.31%,RMSECV=0.031 5,RPD=3.79。为了进一步验证模型的准确性,另选取30批次样本进行验证,根据预测值与各批次中HPLC所测定的冲山茶苷真实值进行拟合,见图 1D,其相关系数可以达到R2=0.914 5,表明所建模型具有良好的预测能力。

|
| 注:A.预处理光谱谱图;B.含量分布图;C.含量拟合模型;D.预测值与真实值拟合图。 图 1 金花茶中冲山茶苷的近红外光谱分析 Fig. 1 NIR spectroscopy analysis for okicamelliaside |
选取来自中国广西与越南不同产地的15批金花茶的叶片,每个产地随机选取3个样本,见表 1。分别采集其近红外光谱,利用上述模型对其中的冲山茶苷含量进行考察。结果发现不同批次的含量之间存在较大差异,其中NO.1、2、4、7、8、9、10、12中冲山茶苷含量相对较高。除NO.1外,其余批次均属于防城港普通种(防普),故而选取其中大叶防普品种进行冲山茶苷的制备。
|
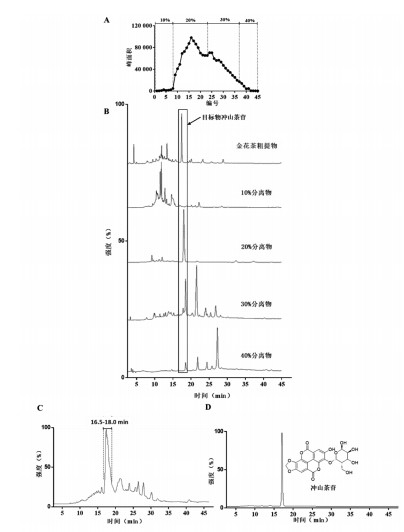
取大叶防普叶片1.1 kg,按照10:1比例(V/W)加超纯水11 L,加热提取40 min。采用100目不锈钢筛趁热过滤,向滤液中加入终浓度为70%的乙醇后静置过夜,取上清液经闪蒸仪减压浓缩,得到金花茶粗提物74.4 g(冲山茶苷:19.2%)。配置1%粗提物的水溶液,上样AB-8大孔吸附树脂柱(直径:5.5 cm,柱高:35 cm,柱体积约800 mL),流速2 mL/min。经10%的乙醇溶液冲洗后,分别以20%,30%和40%不同浓度的乙醇溶液进行梯度洗脱,流速1 mL/min。按段收集所有洗脱液,采用HPLC法监测其中冲山茶苷的洗脱情况,见图 2A。结果表明,20%乙醇可洗脱出大部分的冲山茶苷,合并20%乙醇洗脱馏分,得冲山茶苷粗提物1.1 g(冲山茶苷:56.3%),见图 2B。取上述冲山茶苷粗提物,配制成50 mg/mL的溶液,采用制备液相对其进行进一步纯化制备,见图 2C。收集16.5~18.0 min馏分,经HPLC检测得高纯度冲山茶苷132 mg,见图 2D。
|
| 注:A.大孔吸附树脂洗脱;B.冲山茶苷含量;C.高效制备液相图;D.冲山茶苷HPLC图。 图 2 冲山茶苷的分离纯化 Fig. 2 Isolation and purification for okicamelliaside |
分别采用高分辨质谱和核磁共振分析方法对制备得到的冲山茶苷进行结构确证。质谱数据显示负离子模式下特征碎片为[M-H]- 475.050 5,[2M-H]- 951.110 7以及[M-Glu]- 312.999 7,与冲山茶苷的HRMS理论值[M-H]- 475.051 3相一致。采用全数字核磁共振仪进行测定的氢谱和碳谱的具体数据如下:1H NMR(400 MHz,DMSO-d6)δ 7.54(s,1 H),7.42(s,1 H),6.32(d,J=2.6 Hz,2 H),4.99(d,J=4.0 Hz,1 H),4.92(d,J=5.0 Hz,1 H),4.64(t,J=5.8 Hz,1 H),4.47(d,J=7.0 Hz,1 H),3.70(dd,J=5.0,11.5 Hz,2 H),3.48(dd,J=5.9,11.8 Hz,2 H),3.15(qd,J=3.7,9.5,9.9 Hz,4 H). 13C NMR(101 MHz,DMSO-d6)δ 159.9,158.5,150.5,149.8,138.4,137.7,132.4,118.9,117.1,115.5,112.8,105.8,103.8,102.7,94.8,92.8,77.5,76.9,73.6,69.6,60.9。以上核磁数据与参考文献[9]报道一致,确认该化合物为冲山茶苷。
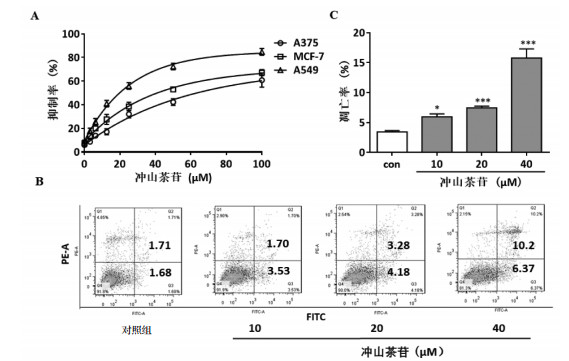
3.5 抗肿瘤活性CCK-8测定细胞毒性显示,冲山茶苷对癌细胞具有一定的抑制效果,对A375、MCF-7、A549的IC50值分别为132.2、71.17、22.97 μM,其中对A549作用效果最好,具有一定的特异性,见图 3A。采用流式细胞仪检测冲山茶苷对A549细胞凋亡的影响,结果表明,冲山茶苷能浓度依赖性地诱导A549细胞凋亡,见图 3B。对其凋亡率进行统计显示,40 μM冲山茶苷作用24 h后,可使A549细胞的凋亡达到约16%,见图 3C。
|
| 注:A. CCK-8;B.流式细胞凋亡图;C.冲山茶苷对细胞凋亡的影响。与对照组比较,*P < 0.05,***P < 0.001。 图 3 冲山茶苷的抗肿瘤活性 Fig. 3 Anti-tumor activity of okicamelliaside |
近年来近红外光谱技术在中药分析方面取得了较快的发展,并广泛应用于中药材的种类、产地、真伪鉴别,以及药效物质的含量测定与品质评价中。例如,通过近红外光谱技术实现了枸杞产地的鉴别以及对玛咖、重楼、石斛等中药材的品质监控[10-13]。近红外技术的优势还体现在对所监测样本特别是叶类样品的直接检测上,可以实现对新鲜黄瓜叶中叶绿素、β-胡萝卜素和叶黄素色素含量的检测[14];甘薯叶和茎中镉、铜、锌等重金属含量的预测分析[15];以及银杏叶样品中黄酮及内酯类活性成分的含量测定等[16]。金花茶作为一种新资源有巨大的开发价值[17],冲山茶苷作为金花茶中代表性的化学成分物质,因品种、产地与采收季节等不同,含量也存在较大差异。本研究采用近红外技术对金花茶叶片进行直接扫描,通过所建立的预测模型实现了冲山茶苷含量的迅速准确的分析,为富含冲山茶苷品种的选育和优质原料的收集提供了便捷的手段。
研究表明鞣花酸具有抑制多种癌细胞的活性,段婧等在细胞及动物层面均证实了鞣花酸抑制A549细胞的生长增值[18];5~40 μg/mL鞣花酸对胃癌细胞SGC7901的杀伤效果明显,作用效果跟药物的作用时间呈正相关[19];此外程浩等研究发现鞣花酸能抑制胰腺癌细胞PANC-1的细胞周期,其作用机制可能与下调环氧合酶(COX-2)和NF-κB的蛋白表达相关[20]。冲山茶苷作为鞣花酸衍生物,已报到其具有细胞毒性及抗脱敏活性[21-22],但是否可以作为金花茶的质量标志物还有待进一步研究。本研究结果证明,冲山茶苷对癌细胞的增殖和凋亡具有较好的活性,同时也提供了其质量评价与制备方法,为金花茶资源的开发与利用奠定了基础。
| [1] |
张武君, 赵云青, 刘保财, 等. 金花茶成分及药理作用研究进展[J]. 亚热带农业研究, 2018, 14(1): 66-72. ZHANG W J, ZHAO Y Q, LIU B C, et al. Research progress on composition and pharmacological action of Camellia nitidissima Chi[J]. Subtropical Agriculture Research, 2018, 14(1): 66-72. |
| [2] |
HE D, LI X, SAI X, et al. Camellia nitidissima CW Chi:a review of botany, chemistry, and pharmacology[J]. Phytochemistry Reviews, 2018, 17(2): 327-349. DOI:10.1007/s11101-017-9537-x |
| [3] |
ONODERA K, TSUHA K, YASUMOTO-HIROSE M, et al. Okicamelliaside, an extraordinarily potent anti-degranulation glucoside isolated from leaves of Camellia japonica[J]. BiosciBiotechnolBiochem, 2010, 74(12): 2532-2534. |
| [4] |
KOBAYASHI R, HANAYA K, SHOJI M, et al. Synthesis of okicamelliaside, a glucoside of ellagic acid with potent anti-degranulation activity[J]. BiosciBiotechnolBiochem, 2013, 77(4): 810-813. |
| [5] |
KUBA-MIYARA M, AGARIE K, SAKIMA R, et al. Inhibitory effects of an ellagic acid glucoside, okicamelliaside, on antigen-mediated degranulation in rat basophilic leukemia RBL-2H3 cells and passive cutaneous anaphylaxis reaction in mice[J]. Int Immunopharmacol, 2012, 12(4): 675-681. DOI:10.1016/j.intimp.2012.01.013 |
| [6] |
王耀鹏, 顾志荣, 孙宇靖, 等. 近红外光谱快速定量技术在中药分析中的最新应用进展[J]. 中国实验方剂学杂志, 2015, 21(9): 223-226. WANG Y P, GU Z R, SUN Y J, et al. Latest application progress of rapid quantitative technique based on near infrared spectroscopy in analysis of traditional Chinese medicine[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2015, 21(9): 223-226. |
| [7] |
白钢, 丁国钰, 侯媛媛, 等. 引进近红外技术用于中药材品质的快速评价[J]. 中国中药杂志, 2016, 41(19): 3501-3505. BAI G, DING G Y, HOU Y Y, et al. Rapid identification and evaluation of Chinese materia medica quality by near infrared spectroscopy[J]. China Journal of Chinese Materia Medica, 2016, 41(19): 3501-3505. |
| [8] |
闫孟琳, 白钢, 刘昌孝, 等. 基于质量标志物的当归血管舒张功效的近红外快速评价[J]. 中草药, 2019, 50(19): 4538-4546. YAN M L, BAI G, LIU C X, et al. Rapid evaluation of vasodilation efficacy of Angelica sinensis by near infrared spectroscopy based on quality markers[J]. Chinese Traditional and Herbal Drugs, 2019, 50(19): 4538-4546. DOI:10.7501/j.issn.0253-2670.2019.19.003 |
| [9] |
KOBAYASHI R, HANAYA K, SHOJI M, et al. Synthesis of okicamelliaside, a glucoside of ellagic acid with potent anti-degranulation activity[J]. Bioscience, biotechnology, and biochemistry, 2013, 77(4): 810-813. DOI:10.1271/bbb.120966 |
| [10] |
杜敏, 巩颖, 林兆洲, 等. 样品表面近红外光谱结合多类支持向量机快速鉴别枸杞子产地[J]. 光谱学与光谱分析, 2013, 33(5): 1211-1214. DU M, GONG Y, LIN Z Z, et al. Rapid identification of wolfberry fruit of different geographic regions with sample surface near infrared spectra combined with multi-class SVM[J]. Spectroscopy and Spectral Analysis, 2013, 33(5): 1211-1214. DOI:10.3964/j.issn.1000-0593(2013)05-1211-04 |
| [11] |
王元忠, 赵艳丽, 张霁, 等. 近红外光谱信息筛选在玛咖产地鉴别中的应用[J]. 光谱学与光谱分析, 2016, 36(2): 394-400. WANG Y Z, ZHAO Y L, ZHANG J, et al. Study on application of NIR spectral information screening in identification of Maca origin[J]. Spectroscopy and Spectral Analysis, 2016, 36(2): 394-400. |
| [12] |
赵艳丽, 张霁, 袁天军, 等. 近红外光谱快速鉴别不同产地药用植物重楼的方法研究[J]. 光谱学与光谱分析, 2014, 34(7): 1831-1835. ZHAO Y L, ZHANG J, YUAN T J, et al. Study on rapid identification of medicinal plants of Paris Polyphyllafrom different origin areas by NIR spectroscopy[J]. Spectroscopy and Spectral Analysis, 2014, 34(7): 1831-1835. DOI:10.3964/j.issn.1000-0593(2014)07-1831-05 |
| [13] |
胡甜, 杨海龙, 汤清, 等. 微型近红外光谱技术快速鉴别霍山石斛种类(英文)[J]. 光谱学与光谱分析, 2014, 34(10): 2808-2814. HU T, YANG H L, TANG Q, et al. Absolutely nondestructive discrimination of Huoshandendrobium nobilespecies with miniature near-in frared (NIR) spectrometer engine[J]. Spectroscopy and Spectral Analysis, 2014, 34(10): 2808-281. DOI:10.3964/j.issn.1000-0593(2014)10-2808-07 |
| [14] |
邹小波, 陈正伟, 石吉勇, 等. 基于近红外高光谱图像的黄瓜叶片色素含量快速检测[J]. 农业机械学报, 2012, 43(5): 152-156. ZOU X B, CEHN Z W, SHI J Y, et al. Rapid detection of cucumber leaves pigments based on near infrared hyper-spectral image technology[J]. Transactions of the Chinese Society of Agricultural Machinery, 2012, 43(5): 152-156. DOI:10.6041/j.issn.1000-1298.2012.05.026 |
| [15] |
徐庆贤, 沈恒胜, 林斌, 等. 利用近红外漫反射光谱(NIRS)技术建立甘薯茎叶重金属预测模型[J]. 福建农业学报, 2011, 26(3): 440-445. XU Q X, SEHN H S, LIN B, et al. Near-infrared diffuse reflectance spectroscopy for heavy metal determination of sweet potato leaves and stems[J]. Fujian Journal of Agricultural Sciences, 2011, 26(3): 440-445. DOI:10.3969/j.issn.1008-0384.2011.03.021 |
| [16] |
张立国, 程佳佳, 倪力军, 等. 紫外、近红外、多源复合光谱信息的银杏叶质量快速分析[J]. 光谱学与光谱分析, 2017, 37(10): 3063-3069. ZHANG L G, CHENG J J, NI L J, et al. Rapid analysis of the quality of Ginkgo biloba leaf based on UV, near infrared and multi-source composite spectral information[J]. Spectroscopy and Spectral Analysis, 2017, 37(10): 3063-3069. |
| [17] |
王欣晨, 李文兰, 阎新佳, 等. 金花茶化学成分及药理活性研究[J]. 哈尔滨商业大学学报(自然科学版), 2018, 34(5): 522-527, 563. WANG X C, LI L W, YAN X J, et al. Research on chemical constituents and pharmacological activities of flowers from Camellia chrysanth (Hu) Tuyama[J]. Journal of Harbin University of Commerce(Natural Sciences Edition), 2018, 34(5): 522-527, 563. DOI:10.3969/j.issn.1672-0946.2018.05.003 |
| [18] |
段婧.鞣花酸对非小细胞肺癌的抑制作用及机制研究[D].北京: 中国农业大学, 2018. DUAN J. Ellagic acid exert anti-non-small cell lung cancer activity in vitro and in vivo[D]. Beijing: ChinaAgricultural University, 2018. |
| [19] |
张彩云, 谢秀嫦, 李俊伟. 鞣花酸对人胃癌细胞SGC7901的作用研究[J]. 广东化工, 2015, 42(8): 126. ZHANG C Y, XIE X C, LI J W, et al. The effect of ellagic acid on human gastric cancer cell SGC7901[J]. Guangdong Chemical Industry, 2015, 42(8): 126. DOI:10.3969/j.issn.1007-1865.2015.08.058 |
| [20] |
程浩, 卢成林, 潘一明, 等. 鞣花酸对胰腺癌细胞株PANC-1增殖和凋亡的影响及其机制[J]. 中华实验外科杂志, 2016, 33(5): 1244-1246. CHENG H, LU C L, PAN Y M, et al. The effect of ellagic acid on the proliferation and apoptosis of pancreatic cancer cell line PANC-1 and its mechanism[J]. Chinese Journal of Experimental Surgery, 2016, 33(5): 1244-1246. DOI:10.3760/cma.j.issn.1001-9030.2016.05.022 |
| [21] |
MEGUMI K, KAZUYO T, KEIKO T, et al. In vivo analysis of the anti-allergic activities of camellia japonica extract and okicamelliaside, a degranulation inhibitor[J]. Journal of Health Science, 2008, 54(5): 331-335. |
| [22] |
喻军.金花茶叶多酚类化合物分析研究[D].桂林: 广西中医药大学, 2017. YU J.Analysis of polyphenols in Camellia nitidissima Chi[D]. Guilin: Guangxi University of Chinese medicine, 2017. |
2. Collaborative Innovation Center of Research on Functional Ingredients from Agricultural Residues, Guangxi University of Chinese medicine, Nanning 530200, China
 2020, Vol. 37
2020, Vol. 37