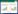文章信息
- 高杉, 王鹏伟, 冯曼, 王朔, 李琳, 潘晔, 刘昳佳, 于春泉
- GAO Shan, WANG Pengwei, FENG Man, WANG Shuo, LI Lin, PAN Ye, LIU Yijia, YU Chunquan
- 基于PI3K/Akt通路的冠心病痰瘀互结证大鼠发病机制研究
- Pathogenesis research of coronary heart disease with phlegm-stasis syndrome rat model based on PI3K/Akt pathway
- 天津中医药, 2020, 37(2): 209-213
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(2): 209-213
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.02.21
-
文章历史
- 收稿日期: 2019-10-30
冠心病(CHD)是由于冠状动脉粥样硬化引起的心血管疾病,严重危害人类健康,是世界卫生组织(WHO)公认的全球死亡的主要原因[1]。中医将其归为“胸痹”“真心痛”等范畴,其病机“痰”“瘀”“虚”贯穿疾病发展始末,早期“热”“毒”相对较重,后期则由实转虚,末期多发展为血瘀、水饮和气阴两虚虚实夹杂之证[2-3]。近10年,中国将冠心病按中医证型分类,其中虚证以气虚证、阴虚证多见,实证以血瘀证、痰浊证居多。血瘀和痰浊是致病因素,同时又是CHD重要的病理产物,两者多相兼为病,而导致痰瘀互结之证[4]。有文献调研显示,近年痰瘀互结证患者人数逐年增加[5],开展CHD痰瘀互结证的发病机制研究对防治CHD具有重大意义。课题组前期通过在高脂饲料喂养的基础上联合冠状动脉左前降支结扎的方法成功建立CHD痰瘀互结证大鼠模型[6],本实验以前期实验模型为基础,通过检测丝氨酸/苏氨酸激酶(Akt)、磷酸化Akt(p-Akt)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关的促凋亡蛋白(Bax)、半胱氨酸蛋白酶-3(Caspase-3)蛋白表达情况,进一步探讨CHD痰瘀互结证的发病机制。
1 材料和方法 1.1 实验动物健康雄性Wistar大鼠,体质量180~220 g,由北京维通利华动物实验中心提供,动物合格证编号:SCXK(京)2016-001。饲养于天津市南开医院实验动物中心。
1.2 实验主要试剂与仪器末端脱氧核苷酸转移酶介导的缺口末端标记测定(Tunel)试剂盒购自瑞士Roche公司;Akt抗体、p-Akt抗体、Bax抗体、Bcl-2抗体、Caspase-3抗体均购自Cell signal technology公司;二喹啉甲酸(BCA)蛋白浓度测定试剂盒(Thermo公司)、涡旋振荡仪(其林贝尔仪器制造有限公司)、低温高速离心机(Eppendorf公司)、电泳仪(美国GE公司)、转膜仪(美国GE公司)。
1.3 实验方法 1.3.1 实验分组及模型制备大鼠实验期间保持自由饮水和进食,饲养环境温度为(24±1)℃,湿度为55%±5%,实验前适应性喂养1周。根据随机数字表将115只大鼠分为空白组(15只)、假手术组(20只)、痰浊组(20只)、血瘀组(30只)、痰瘀互结组(30只)。空白组、假手术组和血瘀组用普通饲料喂养8周。痰浊组和痰瘀互结组用高脂饲料喂养8周,第49天目内眦取血,剔除血脂未升高的大鼠。第54天,血瘀组和痰瘀互结组行冠状动脉左前降支结扎术,假手术组只穿线,不结扎。实验过程中剔除不符合标准的大鼠,并记录死亡情况。
1.3.2 标本采集与处理8周末大鼠腹腔注射10%水合氯醛麻醉,腹主动脉取血后生理盐水冲洗心脏,剪取心脏,-80 ℃冰箱保存待测。
1.3.3 Tunel染色法观察大鼠心肌凋亡情况取心脏组织,进行石蜡包埋、切片,依据Tunel试剂盒说明书操作,光学显微镜下观察各组大鼠心肌细胞凋亡情况。
1.3.4 蛋白免疫印迹(Western blot)法检测心肌组织Akt、p-Akt、Bcl-2、Bax和Caspase-3蛋白表达情况取适量左心室心肌组织,按照心肌组织质量:裂解液体积=1:10的比例加入配置好的裂解液,冰上匀浆。然后13 000 r/min、4 ℃离心15 min。离心完成后取上清分装保存。采用BCA法进行蛋白定量测定,计算上样量,100 ℃水浴变性10 min,冷却后保存于-20 ℃冰箱中。用移液枪将蛋白标记物(Marker)及待测样品依次加入到加样孔内,电泳1 h,切胶,将蛋白转印至聚偏氟乙烯(PVDF)膜,TBST漂洗2 min,用5%脱脂奶粉室温封闭,置于摇床上,轻摇1 h。吸尽封闭液,加入一抗,4 ℃过夜。次日回收一抗,加TBST洗液3次,每次5 min。吸尽洗液,加入二抗,孵育2 h,之后洗涤3次,每次5 min。最后用ECL化学发光显示,收集图片,Image J程序对条带上的灰度值进行统计,从而进行定量分析。
1.4 统计学分析采用SPSS 23.0软件进行统计分析,实验数据以均数±标准差(x±s)表示,进行正态分布检验和方差齐性检验后,多组间比较使用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD法,P < 0.05为差异有统计学意义。
2 结果 2.1 Tunel染色空白组和假手术组未见明显细胞凋亡,与假手术组相比,痰浊组、血瘀组和痰瘀互结组大鼠心肌细胞凋亡数目增加,痰浊组大鼠心肌可见少量细胞凋亡,血瘀组和痰瘀互结组大鼠心肌组织存在大量细胞凋亡。见图 1。
|
| A:空白组;B:假手术组;C:痰浊组;D:血瘀组;E:痰瘀互结组 图 1 大鼠心脏病理结构变化的影响(Tunel,×100) Fig. 1 Pathological changes in the cardiac tissue of rats (Tunel, × 100) |
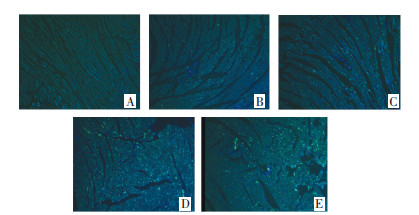
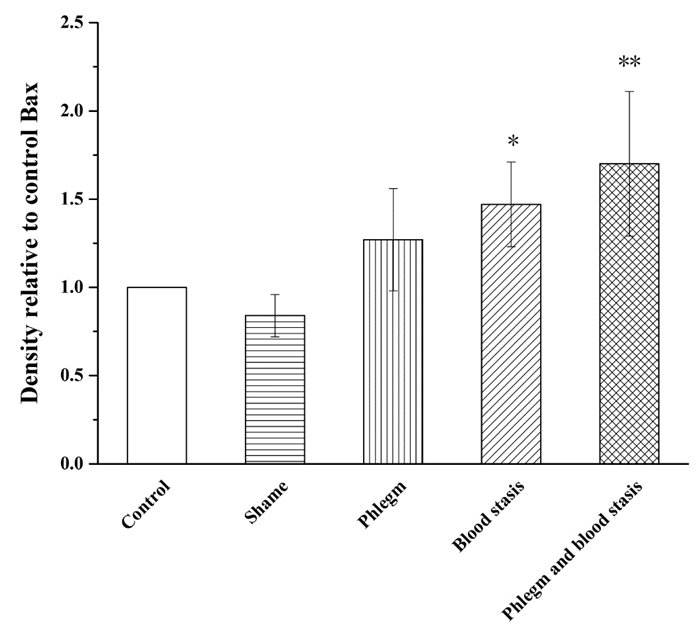
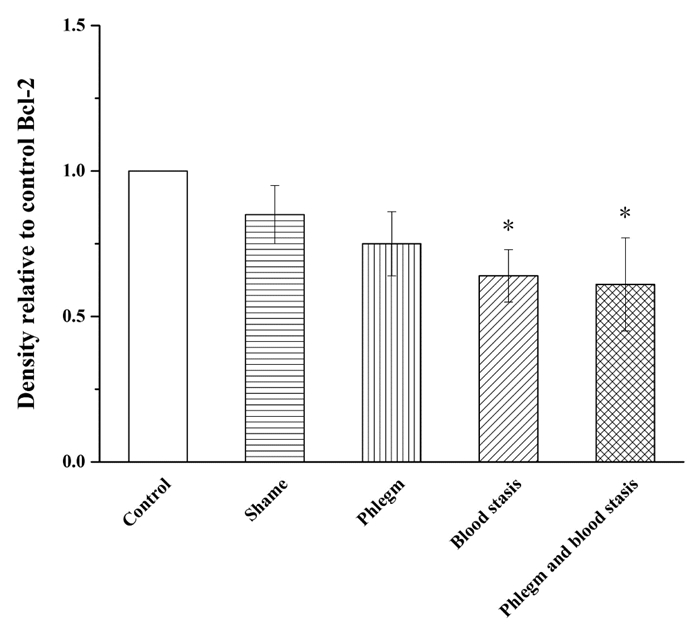
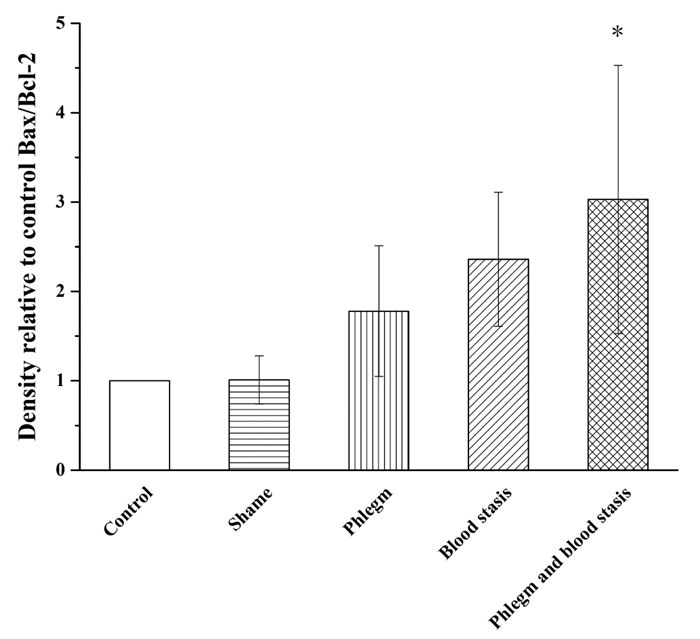
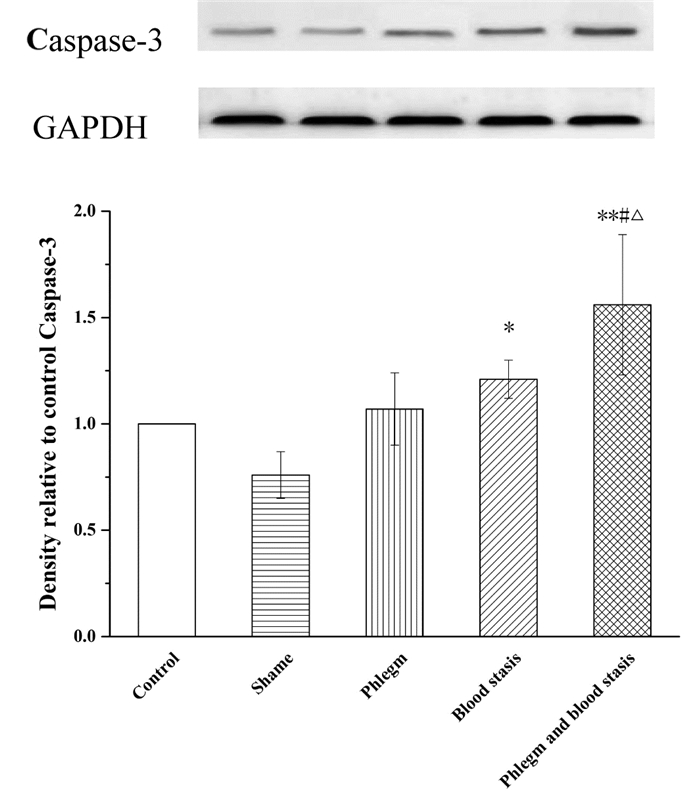
与假手术组相比,空白组大鼠Akt、Bcl-2、Bax和Caspase-3蛋白表达水平和Bax/Bcl-2比值无统计学差异,p-Akt蛋白表达水平明显升高(P<0.01);血瘀组和痰瘀互结组大鼠Akt、p-Akt和Bcl-2蛋白表达水平明显降低(P<0.05或P<0.01);Bax和Caspase-3蛋白表达水平明显升高(P<0.05或P<0.01);痰浊组大鼠p-Akt蛋白表达明显升高(P<0.05),Akt、Bcl-2、Bax和Caspase-3蛋白表达无统计学差异;痰浊组和血瘀组大鼠Bax/Bcl-2比值无统计学差异,但具有升高趋势,痰瘀互结组大鼠Bax/Bcl-2比值显著升高(P<0.05)。与痰浊组相比,血瘀组p-Akt蛋白表达明显降低(P<0.01),Akt、Bcl-2、Bax、Caspase-3蛋白表达和Bax/Bcl-2比值无统计学差异,但Akt、Bcl-2蛋白表达有降低趋势,Bax、Caspase-3蛋白表达和Bax/Bcl-2比值有升高趋势;痰瘀互结组Akt和p-Akt蛋白表达明显降低(P<0.05或P<0.01),Caspase-3蛋白表达明显升高(P<0.05)。与血瘀组相比,p-Akt蛋白表达明显降低(P<0.05),Caspase-3蛋白表达明显升高(P<0.05),Bax、Bcl-2蛋白表达水平和Bax/Bcl-2比值无统计学差异,但Bax蛋白表达和Bax/Bcl-2比值有升高趋势,Bcl-2蛋白表达有降低趋势。见图 2-7。

|
| Control:空白组;Shame:假手术组;Phlegm:痰浊组;Blood stasis:血瘀组;Phlegm and blood stasis:痰瘀互结组。与假手术组比较,*P<0.05,**P<0.01;与痰浊组比较,#P<0.05 图 2 心肌组织Akt蛋白表达(x±s) Fig. 2 Expression of Akt protein in the myocardial tissue of rats(x±s) |
|
| Control:空白组;Shame:假手术组;Phlegm:痰浊组;Blood stasis:血瘀组;Phlegm and blood stasis:痰瘀互结组。与假手术组比较,*P<0.05,**P<0.01 图 3 心肌组织Bax蛋白表达(x±s) Fig. 3 Expression of Bax protein in the myocardial tissue of rats(x±s) |
|
| Control:空白组;Shame:假手术组;Phlegm:痰浊组;Blood stasis:血瘀组;Phlegm and blood stasis:痰瘀互结组。与假手术组比较,*P<0.05,**P<0.01;与痰浊组比较,#P<0.01;与血瘀组比较,△P<0.05 图 4 心肌组织p-Akt蛋白表达(x±s) Fig. 4 Expression of p-Akt protein in the myocardial tissue of rats(x±s) |
|
| Control:空白组;Shame:假手术组;Phlegm:痰浊组;Blood stasis:血瘀组;Phlegm and blood stasis:痰瘀互结组。与假手术组比较,*P<0.05 图 5 心肌组织Bcl-2蛋白表达(x±s) Fig. 5 Expression of Bcl-2 protein in the myocardial tissue of rats(x±s) |
|
| Control:空白组;Shame:假手术组;Phlegm:痰浊组;Blood stasis:血瘀组;Phlegm and blood stasis:痰瘀互结组。与假手术组比较,*P<0.05 图 6 心肌组织Bax/Bcl-2蛋白表达(x±s) Fig. 6 Expression of Bax/Bcl-2 protein in the myocardial tissue of rats(x±s) |
|
| Control:空白组;Shame:假手术组;Phlegm:痰浊组;Blood stasis:血瘀组;Phlegm and blood stasis:痰瘀互结组。与假手术组比较,*P<0.05,**P<0.01;与痰浊组比较,#P<0.01;与血瘀组比较,△P<0.05 图 7 心肌组织Caspase-3蛋白表达(x±s) Fig. 7 Expression of Caspase-3 protein in the myocardial tissue of rats(x±s) |
CHD属中医“胸痹”范畴,《金匮要略·胸痹心痛气短脉证治》中记载:“师曰:夫脉当取太过不及,阳微阴弦,即胸痹而痛,所以然者,责其极虚也。”提出胸痹的病机为“阳微阴弦”,中医证型多属本虚标实,虚实夹杂的复合证型[7]。《症因脉治》云:“胸痹之因,饮食不节,饥饱损伤,痰凝血滞,中焦混浊,则闷食闷痛之症作矣。”表明“痰浊”和“血瘀”为CHD重要的致病因素。邓铁涛教授认为CHD属本虚标实痰瘀相关的病机,本虚主要为心阴、心阳虚,标实主要为痰与瘀[8]。《素问·奇病论》云:“食甘美而多肥也。”《素问·痹论》云:“饮食自倍,肠胃乃伤。”脾为生痰之源,饮食不节或过食肥甘厚味,则内伤脾胃,脾失健运,气血津液生化障碍,进而导致水湿内停,聚而生痰,脾胃损伤,气血生化无源,中气不足,气血运行不利,日久则瘀,瘀血阻滞又可引起气机不畅,致体内津液代谢障碍,痰瘀互生,两者相互影响,进而形成痰瘀互结的证候造成血流缓慢、血管堵塞引发CHD[9-10]。CHD痰瘀互结证病程较长,病势缠绵难愈,由此可见,对于CHD痰瘀互结证的研究已更为迫切。
西医认为CHD的发病是一个极其复杂的过程,其中几种较为公认的发病学说包括脂肪浸润学说、血栓形成和血小板聚集学说、内皮损伤反应学说和平滑肌克隆学说。内皮损伤与动脉粥样硬化紧密相连,而动脉粥样硬化又是CHD的最基本病理变化。磷脂酰肌醇-3激酶(PI3K)/Akt作为细胞内重要的信号转导通路之一,可调节下游效应分子的活化状态,发挥凋亡作用。细胞凋亡会进一步损伤内皮功能,导致动脉粥样硬化的发生和发展[11]。
Akt是PI3K下游作用的主要介质,通过协调各种细胞内信号和控制细胞对外部刺激的反应来调节细胞增殖和存活。在活化的PI3K/Akt途径中,PI3K和Akt的表达和磷酸化水平显著提高,可以抑制磷酸酶和张力蛋白同源物对血管平滑肌细胞存活的抑制作用,使细胞增殖率增加,细胞凋亡水平降低,从而保护心肌细胞免受伤害[12]。另有研究显示Akt的磷酸化调节可以影响PI3K/Akt/内皮型一氧化氮合酶(eNOS)信号传导途径和eNOS去磷酸化,诱导主动脉环的扩张,通过PI3K/Akt/eNOS信号传导途径增强了eNOS释放,导致血管舒张反应[13]。
心肌细胞富含线粒体,线粒体途径是细胞凋亡信号传导途径中最重要的途径之一,线粒体介导的凋亡在CHD心肌损伤的发病机制中起着至关重要的作用。Bcl-2家族蛋白是此途径中的关键因子,Bcl-2和Bax蛋白均属于Bcl-2家族,此类蛋白表达水平的高低与凋亡调控直接相关[11, 14-15]。LIU等[16]通过实验研究发现,大鼠心脏缺血再灌注会降低Bax和Caspase 3蛋白的表达,增加Bcl-2的表达,诱导心肌细胞凋亡,从而损伤心脏,引发功能障碍。
在本次实验中,Tunel染色结果显示痰浊组、血瘀组和痰瘀互结组心肌细胞均有明显凋亡现象,血瘀组和痰瘀互结组心肌细胞凋亡较重。提示痰浊组、血瘀组和痰瘀互结组具有不同程度的心肌损伤,其中血瘀组和痰瘀互结组损伤程度较重,痰浊组损伤程度较轻。血瘀组和痰瘀互结组大鼠Akt、p-Akt和Bcl-2蛋白表达水平明显降低(P<0.05或P<0.01);Bax和Caspase-3蛋白表达水平明显升高(P<0.05或P<0.01);痰浊组大鼠p-Akt蛋白表达明显升高(P<0.05),痰瘀互结组大鼠Bax/Bcl-2比值显著升高(P<0.05),结果提示痰浊组、血瘀组和痰瘀互结组大鼠心肌细胞都有不同程度的凋亡,其中痰瘀互结组细胞凋亡损伤最重。研究表明细胞凋亡可能是CHD痰瘀互结证的发病机制之一。
| [1] |
KELLY B B, NARULA J, FUSTER V. Recognizing global burden of cardiovascular disease and related chronic diseases[J]. Mount Sinai Journal of Medicine:A Journal of Translational and Personalized Medicine, 2012, 79(6): 632-640. DOI:10.1002/msj.21345 |
| [2] |
王永刚, 齐婧, 钟伟, 等. 冠心病中医病因病机的认识与探索[J]. 中医杂志, 2015, 56(17): 1449-1452. WANG Y G, QI J, ZHONG W, et al. Understanding and exploration to the etiology and pathogenesis of coronary heart disease in traditional Chinese medicine[J]. Journal of Traditional Chinese Medicine, 2015, 56(17): 1449-1452. |
| [3] |
王传池, 杨燕, 吴珊, 等. 冠心病不同发展阶段中医证演变规律研究[J]. 中华中医药杂志, 2019, 34(5): 2101-2106. WANG C C, YANG Y, WU S, et al. Study on the evolution rule of TCM syndromes in different development stages of coronary heart disease[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2019, 34(5): 2101-2106. |
| [4] |
毕颖斐, 毛静远, 张伯礼. 基于文献的冠心病中医证型地域性分布特征研究[J]. 中医杂志, 2012, 53(3): 228-230. BI Y F, MAO J Y, ZHANG B L. Literature study on the regional distribution characteristics of TCM syndromes of coronary heart disease[J]. Journal of Traditional Chinese Medicine, 2012, 53(3): 228-230. |
| [5] |
毕颖斐, 王贤良, 赵志强, 等. 冠心病现代中医证候特征的临床流行病学调查[J]. 中医杂志, 2017, 58(23): 2013-2019. BI Y F, WANG X L, ZHAO Z Q, et al. Clinical epidemiological investigation on current syndrome characteristics of coronary heart disease in Chinese Medicine[J]. Journal of Traditional Chinese Medicine, 2017, 58(23): 2013-2019. |
| [6] |
王朔, 梁如, 许慧愚, 等. 高脂饲料联合结扎冠状动脉左前降支探讨冠心病痰瘀互结证大鼠模型的建立与评价[J]. 天津中医药, 2018, 35(10): 727-731. WANG S, LIANG R, XU H Y, et al. Establishment and evaluation of phlegm and blood-stasis syndrome on coronary heart disease model by high-fat diet combined with ligation of left anterior descending coronary artery in rats[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(10): 727-731. |
| [7] |
石衍梅, 李洁, 蔚若川, 等. 冠心病发病机制研究进展[J]. 中国冶金工业医学杂志, 2016, 33(2): 137-138. SHI Y M, LI J, YU R C, et al. Research progress in the pathogenesis of coronary heart disease[J]. Chinese Medical Journal of Metallurgical Industry, 2016, 33(2): 137-138. |
| [8] |
李辉, 邱仕君. 邓铁涛教授对"痰瘀相关"理论的阐释和发挥[J]. 湖北民族学院学报(医学版), 2005, 22(1): 45-47. LI H, QIU S J. Professor DENG Tietao's explanation and exertion of "phlegm and blood-stasis related" theory[J]. Journal of Hubei Minzu University (Medical Edition), 2005, 22(1): 45-47. |
| [9] |
孙铭鸿, 张艳, 肖阳, 等. 冠心病不同类型与中医病机辨证的关系[J]. 中西医结合心脑血管病杂志, 2017, 15(4): 507-508. SUN M H, ZHANG Y, XIAO Y, et al. Relationship between different types of coronary heart disease and TCM pathogenesis and differentiation syndromes[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2017, 15(4): 507-508. |
| [10] |
李霖, 王硕, 康立源. 饮食结构与冠心病痰湿证关系的探讨[J]. 中华中医药学刊, 2014, 32(5): 1019-1020. LI L, WANG S, KANG L Y. Discussion of relationship between dietary structure and phlegm-dampness pattern of coronary heart disease[J]. Chinese Archives of Traditional Chinese Medicine, 2014, 32(5): 1019-1020. |
| [11] |
QIN W, REN B, WANG S, et al. Apigenin and naringenin ameliorate PKCβⅡ-associated endothelial dysfunction via regulating ROS/caspase-3 and NO pathway in endothelial cells exposed to high glucose[J]. Vascular Pharmacology, 2016(85): 39-49. |
| [12] |
WANG S, CHENG Z Y, CHEN X J. Promotion of PTEN on apoptosis through PI3K/Akt signal in vascular smooth muscle cells of mice model of coronary heart disease[J]. Journal of Cellular Biochemistry, 2019, 120(9): 14636-14644. DOI:10.1002/jcb.28725 |
| [13] |
LIN X P, CUI H J, YANG A L, et al. Astragaloside Ⅳ Improves vasodilatation function by regulating the PI3K/Akt/eNOS signaling pathway in rat aorta endothelial cells[J]. Journal of Vascular Research, 2018, 55(3): 169-176. DOI:10.1159/000489958 |
| [14] |
SIVAKUMAR D, SIVARAMAN T. A review on structures and functions of Bcl-2 family proteins from Homo sapiens[J]. Protein and Peptide Letters, 2016, 23(10): 932-941. DOI:10.2174/0929866523666160719094636 |
| [15] |
OLA M S, NAWAZ M, AHSAN H. Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J]. Molecular and Cellular Biochemistry, 2011, 351(1-2): 41-58. DOI:10.1007/s11010-010-0709-x |
| [16] |
LIU X, TAN W X, YANG F W, et al. Shengmai injection reduces apoptosis and enhances angiogenesis after myocardial ischaemia and reperfusion injury in rats[J]. Biomedicine and Pharmacotherapy, 2018(104): 629-636. |
 2020, Vol. 37
2020, Vol. 37