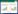文章信息
- 王贵芳, 岳占龙, 崔元璐
- WANG Guifang, YUE Zhanlong, CUI Yuanlu
- 葛根素参与的可注射钙离子敏感型水凝胶生物相容性研究
- Biocompatibility evaluation of a puerarin-interact, injectable and Ca2+ responsive hydrogel
- 天津中医药, 2020, 37(2): 214-219
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(2): 214-219
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.02.22
-
文章历史
- 收稿日期: 2019-10-15
骨关节炎是一种以关节软骨退行性病变和继发性骨质增生为特征的慢性关节疾病。其病理特点为关节软骨退行性改变,组织结构破坏,软骨下骨硬化,关节边缘和软骨下反应性增生,骨赘形成。西医学对骨关节炎的研究已经非常深入,但其发病机制仍未完全明确。目前学术界普遍认为骨关节炎与多个病理机制相关,包括软骨细胞外基质的酶降解,缺乏新细胞外基质合成,软骨细胞的异常分化等[1]。骨关节炎患者的软骨自我修复能力差,传统治疗仅能够在一定程度上缓解症状、延缓病情发展,缺少有效的治疗措施。近年来兴起的间充质干细胞(MSCs)移植疗法,为骨关节炎的治疗带来新的希望[2]。细胞3D培养技术相比传统2D培养,更贴近人体生理条件,使细胞更好地表达出生理功能[3],除了为细胞提供充足的生长空间,也能够满足细胞进行各种营养物质和氧的交换。
研究发现,正常人体关节腔内关节液的钙离子浓度为4 mmol/L左右,骨关节炎患者关节液中钙离子浓度明显升高[4-5],基于此课题组前期设计制备了一种葛根素参与的钙离子响应的海藻酸水凝胶,可用于骨关节炎的治疗[6]。本研究在前期工作基础上,针对葛根素-海藻酸钙水凝胶的生物相容性进行了体内生物相容性评价,为其临床应用提供理论基础和技术支持。
1 试剂与仪器海藻酸钠[生工生物工程(上海)股份有限公司,中国];葛根素(>99%)(上海永恒生物科技有限公司,中国);葡萄糖酸钙[生工生物工程(上海)股份有限公司,中国];粉防己碱(>98%)(江苏永健医药科技有限公司,中国);白细胞介素-6(IL-6)酶联免疫吸附(ELISA)试剂盒(PeproTech公司,美国);白细胞介素-1β(IL-1β)ELISA试剂盒(PeproTech公司,美国);肿瘤坏死因子-α(TNF-α)ELISA试剂盒(PeproTech公司,美国);二喹啉甲酸(BCA)蛋白测定试剂盒(Pierce公司,美国);UNIQ-10柱式Trizol总RNA提取试剂盒[生工生物工程(上海)股份有限公司,中国];PrimeScript Reverse Transcription试剂盒和逆转录-聚合酶链反应(RT-PCR)reaction试剂盒(TAKARA公司,日本)。
7500型实时荧光定量PCR仪(Applied Biosystems公司,美国);PCR-C1000 PCR仪(Bio-Rad公司,美国);Infinite M200型多功能读板机(TECAN公司,瑞士);VCX 130型超声波破碎仪(Sonics & Materials公司,美国);Avanti J-25型高速离心机(Beckman Coulter公司,美国);ASP300S全自动封闭脱水机(Leica仪器公司,德国);BMJ-1生物组织包埋机(天津航空机电公司,中国);RM2135型石蜡切片机(Leica仪器公司,德国)。
2 实验方法 2.1 葛根素-海藻酸钙凝胶的制备、体内埋植和取材葛根素-海藻酸钙可注射凝胶的制备参照课题组以往研究方案[6]。将制备的载粉防己碱葛根素-海藻酸钙注射水凝胶转移至培养基瓶中进行121 ℃高压灭菌,备用。
4~5周龄SD雄性大鼠36只,购买于北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2012-0001]。对大鼠进行适应性喂养,实验前对大鼠称质量,植入手术前按照0.35 mL/100 g剂量腹腔注射10%水合氯醛麻醉,在大鼠前后肢肌肉处进行局部褪毛处理。大鼠分组包括假手术组、海藻酸钙凝胶组、低浓度葛根素-海藻酸钙组(浓度为0.01%)、中浓度葛根素-海藻酸钙组(浓度为0.04%)、高浓度葛根素-海藻酸钙组(浓度为0.2%)、葛根素(浓度为0.2%)/粉防己碱(浓度为0.05%)-海藻酸钙组,每组6只大鼠。用1 mL注射器注射高压灭菌后的凝胶按照每个点注射0.5 mL[7-8],每只注射4点进行皮下埋植凝胶,埋植完成后观察大鼠活动状态以及进食饮水情况。
取材按照预先设计时间点,在埋植凝胶后的3 d、1周、2周、8周对大鼠进行称质量、腹腔注射麻醉、除去埋植点的鼠毛、颈椎脱臼处死,立即打开大鼠背部皮肤,取埋植凝胶附近的浅筋膜层组织,转移至冻存管中精确称质量并进行液氮速冻,每个组织样本质量为50 mg左右,然后转移至-80 ℃冰箱储存备用。沿凝胶块取下皮肤,去除鼠毛,于中性福尔马林溶液中固定。每组取材时对皮下埋植部位及凝胶样本拍照,测量凝胶直径大小,初步判断凝胶在埋植期间的降解速率。
2.2 ELISA法测定注射凝胶附近组织炎性因子分泌的变化取埋植凝胶手术后3 d的组织样本,转移至1.5 mL离心管,加预冷的含有蛋白酶抑制剂蛋白裂解液,于冰上进行超声组织破碎,每个样品裂解5~6 min,将裂解后的样品14 000 r/min、4 ℃离心15 min,离心后得到的上清液转移至新的1.5 mL离心管中,每个样品分装3份,所有样品保存于-80 ℃冰箱备用。取1份组织裂解上清液样品,按照BCA试剂盒说明书检测样品中总蛋白的浓度,按照ELISA试剂盒说明书检测组织裂解液中炎症因子IL-1β、IL-6和TNF-α的含量,根据标准曲线求出浓度,以组织裂解液总蛋白的浓度作为比较,计算炎症因子的相对浓度。
2.3 实时定量(Real time)RT-PCR分析注射凝胶附近组织炎性因子mRNA表达的变化首先采用UNIQ-10柱式Trizol总RNA提取试剂盒提取各组织样本的总RNA,以PrimeScript Reverse Transcription试剂盒将提取的总RNA逆转成cDNA,然后进行Real time PCR扩增,引物序列如表 1,RT-PCR reaction试剂盒分析炎性相关因子IL-1β、IL-6和TNF-α的mRNA表达变化,实验操作按照说明书进行。引物序列见表 1。
苏木精-伊红(HE)染色分析不同时间点注射凝胶附近组织病理变化将埋植实验后不同时间(3 d、1周、2周、8周)取材的大鼠背部组织,在中性福尔马林中固定,取出组织后按照改刀、脱水、透明化、包埋、切片、展片、烤片、脱蜡、染色、脱水、封片一系列步骤对组织进行切片及HE染色,将切片标本在显微镜下观察、拍照。
2.5 统计学分析采用Origin Pro 8.0软件进行数据统计分析并绘图。实验数据以均值±标准误(x±SE)表示,多组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD法,P < 0.05为差异具有统计学意义。
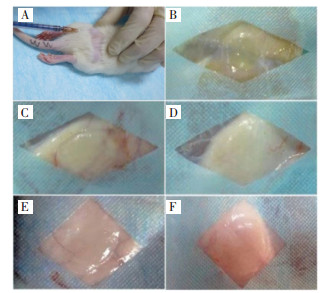
3 实验结果 3.1 凝胶的体内埋植降解分析实验所制备的凝胶可以通过1 mL注射器进行皮下注射,注射后无感染现象,大鼠饮食和活动状态良好。不同取材时间点随机选取的埋植材料直径均在1~1.5 cm,从埋植后3 d到8周时间,凝胶直径无下降趋势,凝胶体内降解速率缓慢,观察凝胶附近的皮下组织,未出现充血、红肿的现象,说明未出现明显的炎症反应。见图 1。
|
| A:皮下注射埋植凝胶;B:3 d,埋植凝胶直径=1.0 cm;C:1周,埋植凝胶直径=1.12 cm;D:2周,埋植凝胶直径=1.28 cm;E:4周,埋植凝胶直径=1.04 cm;F:8周,埋植凝胶直径=1.52 cm 图 1 凝胶皮下注射埋植与不同时间点降解情况 Fig. 1 Degradation of subcutaneous injection gels in different time points |
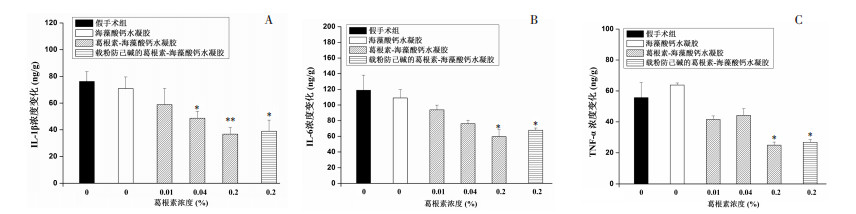
皮下埋植凝胶3 d后,各实验组埋植物周围组织中IL-1β浓度与假手术组相比明显降低。随着凝胶中葛根素含量的增加,IL-1β浓度依次递减,表现出明显的剂量依赖性(P < 0.05或P < 0.01),含有粉防己碱的实验组也明显低于假手术组(P < 0.05)。见图 2A。
|
| 与假手术组比较,*P < 0.05,** P < 0.01 图 2 凝胶皮下埋植3 d后组织中IL-1β(A)、IL-6(B)和TNF-α(C)浓度的变化(x±SE) Fig. 2 Change of IL-1β(A)、IL-6(B)and TNF-α(C) concentration after 3 days subcutaneous injection gels(x±SE) |
IL-6浓度测试结果与IL-1β相似,通过统计分析可知,皮下埋植凝胶3 d后,各实验组埋植物周围组织中IL-6浓度均低于假手术组的浓度。随着凝胶中葛根素含量的增加,IL-6浓度依次递减,表现出明显的剂量依赖性,除高浓度组(0.2%)具有统计学差异(P < 0.05),其他组均无统计学差异。与假手术组比较,载粉防己碱组也能够显著降低IL-6(P < 0.05)。见图 2B。
埋植3 d后,空白凝胶组埋植物周围组织中的TNF-α浓度略高于假手术组,但不具有统计学差异。随着凝胶中葛根素含量的增加,TNF-α浓度依次递减,高浓度葛根素凝胶和含有粉防己碱的凝胶组能够显著降低TNF-α的浓度(P < 0.05)。见图 2C。
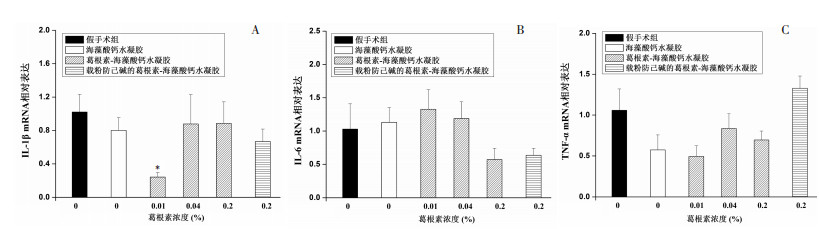
3.3 凝胶体内埋植后周围组织炎性相关因子mRNA表达的变化凝胶埋植3 d后埋植物周围组织中3种炎症因子mRNA表达水平相对空白组没有明显上调,除低浓度葛根素-海藻酸钙凝胶组的IL-1β mRNA表达有明显下调外,其余各组3种炎症因子mRNA表达与假手术组相比均没有统计学差异,3种炎症因子mRNA表达水平在各实验组之间无明显规律,见图 3。结果说明海藻酸钙凝胶、葛根素-海藻酸钙凝胶以及葛根素/粉防己碱-海藻酸钙凝胶皮下埋植后,在埋植组织周围未产生炎症反应,该注射型凝胶具有良好的体内生物相容性,可用于关节原位注射给药。
|
| 与假手术组相比,*P < 0.05 图 3 凝胶皮下埋植3 d后组织中IL-1β mRNA(A)、IL-6 mRNA(B)和TNF-α mRNA(C)表达变化(x±SE) Fig. 3 mRNA expression of IL-1β(A)、IL-6(B)and TNF-α(C) after 3 days subcutaneous injection gels(x±SE) |
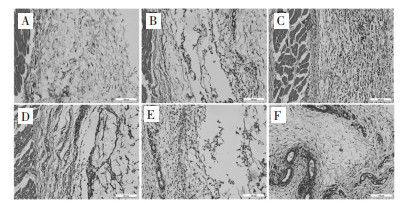
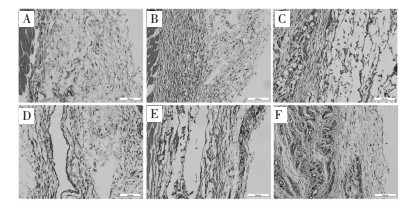
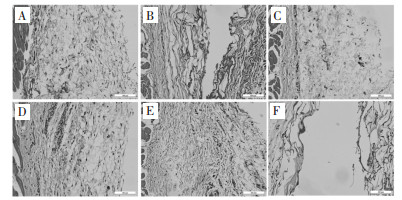
见图 4-7。由HE染色组织切片分析,经皮下注射埋植的凝胶分布于结缔组织层,被凝胶占据的位置产生大量空腔。正常大鼠皮肤的结缔组织层纤维细胞分布均匀,细胞核主要呈长扁状,靠近肌肉的有少量毛细血管分布。凝胶皮下埋植3 d后观察到结缔组织层有被凝胶占据的空腔,沿凝胶注射位置产生明显的炎症反应,淋巴细胞和巨噬细胞大量聚集,伴随有明显的毛细血管形成,对凝胶组织进行包裹,其中炎症反应并未蔓延至肌肉组织层。1周后炎症反应持续发生,相对于3 d淋巴细胞和巨噬细胞数量减少,炎症反应有所缓解,结缔组织增生,毛细血管周围肉芽组织已经形成,这个阶段仍能观察到大量蓝色细胞核,其中有大量的增生纤维细胞,形成结缔组织,还有增生毛细血管内皮细胞。埋植2周后,结缔组织层中存在增生纤维细胞和毛细血管,炎症反应基本消失。皮下埋植8周后,随着时间延长炎症反应完全消失,沿凝胶位置保留比较致密的增生结缔组织,仍保留增生的毛细血管。
|
| A:假手术组;B:空白凝胶组;C:低浓度葛根素-海藻酸钙凝胶组;D:中浓度葛根素-海藻酸钙凝胶组;E:高浓度葛根素-海藻酸钙凝胶组;F:载粉防己碱葛根素-海藻酸钙凝胶组 图 4 凝胶埋植3 d后埋植物附近组织HE染色结果(×200) Fig. 4 HE straining of the host tissues surrounding the different gels after 3 days subcutaneous injection(×200) |
|
| A:假手术组;B:空白凝胶组;C:低浓度葛根素-海藻酸钙凝胶组;D:中浓度葛根素-海藻酸钙凝胶组;E:高浓度葛根素-海藻酸钙凝胶组;F:载粉防己碱葛根素-海藻酸钙凝胶组 图 5 凝胶埋植1周后埋植物附近组织HE染色结果(×200) Fig. 5 HE straining of the host tissues surrounding the different gels after 1 week subcutaneous injection(×200) |
|
| A:假手术组;B:空白凝胶组;C:低浓度葛根素-海藻酸钙凝胶组;D:中浓度葛根素-海藻酸钙凝胶组;E:高浓度葛根素-海藻酸钙凝胶组;F:载粉防己碱葛根素-海藻酸钙凝胶组 图 6 凝胶埋植2周后埋植物附近组织HE染色结果(×200) Fig. 6 HE straining of the host tissues surrounding the different gels after 2 weeks subcutaneous injection(×200) |
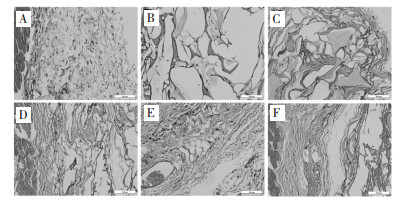
|
| A:假手术组;B:空白凝胶组;C:低浓度葛根素-海藻酸钙凝胶组;D:中浓度葛根素-海藻酸钙凝胶组;E:高浓度葛根素-海藻酸钙凝胶组;F:载粉防己碱葛根素-海藻酸钙凝胶组 图 7 凝胶埋植8周后注射凝胶附近组织HE染色结果(×200) Fig. 7 HE straining of the host tissues surrounding the different gels after 8 weeks subcutaneous injection(×200) |
皮下埋植早期仅在埋植的结缔组织中产生炎症,紧密连接的肌肉组织并受到到影响。随着埋植时间的延长,从3 d到8周皮下埋植凝胶的直径并未减小,在未被降解条件下炎症反应快速消失。所以推测皮下埋植所产生的炎症反应是由于注射凝胶在结缔组织中产生的物理机械力损伤造成的,结缔组织受到物理牵引,将结缔组织物理分开,同时凝胶的植入产生一定的压力,组织在修复过程中而产生的炎症反应,而葛根素-海藻酸钙凝胶未引起明显的炎症反应,生物相容性良好。
4 讨论本研究前期采用海藻酸与氯化钙(CaCl2)直接快速混合构建海藻酸钙凝胶,有别于传统使用的不溶性钙盐由凝胶内部缓慢释放钙离子胶凝化的方法,其中海藻酸对CaCl2浓度十分敏感,探索出海藻酸、CaCl2、葛根素比较窄的处方浓度范围,制备得到可用于关节注射的钙离子敏感葛根素海藻酸凝胶[6]。可植入生物材料的生物相容性对其长期功能具有至关重要的作用[9]。制备的不同处方凝胶均能达到无菌、均一、透明、等渗的要求,大鼠皮下注射埋植,埋植后大鼠生理状态良好,取材时未发现皮下埋植凝胶引起充血、红肿等炎症反应现象,通过对比不同时间点皮下凝胶的直径,埋植8周凝胶无明显降解。异体植入的生物材料能够引发急性和慢性炎症反应[10-11],巨噬细胞在炎症的发生和发展过程中起关键作用,被激活的巨噬细胞能够分泌大量炎性因子,如IL-1β、IL-6、TNF-α等[12-13]。埋植凝胶附近组织中的炎症因子IL-1β、IL-6、TNF-α浓度未发生明显变化,说明埋植凝胶未对周围组织产生刺激,炎症因子浓度与假手术组相比无统计学差异,随着葛根素浓度的升高,炎症因子反而受到剂量依赖的抑制作用。组织中3种炎症因子的mRNA表达量与假手术组比较也无统计学差异。对各个时间点取材的组织进行切片HE分析,结果显示3 d和1周时的皮下结缔组织产生单核细胞聚集和血管增生,并形成凝胶占据的空腔,从2周开始炎症反应明显减轻,基本恢复正常,原因推测是埋植短期内产生的炎症反应为凝胶埋植物理损伤造成的,而埋植材料生物相容性良好。通过以上一系列实验证明,葛根素-海藻酸钙凝胶具有良好的生物相容性,皮下组织未产生明显的刺激和炎症反应,可作为骨关节炎的可注射载体材料用于该疾病的治疗。
| [1] |
JOHNSON K, ZHU S, TREMBLAY M S, et al. A stem cell-based approach to cartilage repair[J]. Science, 2012, 336(6082): 717-721. DOI:10.1126/science.1215157 |
| [2] |
QI Y, FENG G, YAN W. Mesenchymal stem cell-based treatment for cartilage defects in osteoarthritis[J]. Molecular Biology Reports, 2012, 39(5): 5683-5689. DOI:10.1007/s11033-011-1376-z |
| [3] |
OH S T, KIM W R, KIM S H, et al. The preparation of polyurethane foam combined with pH-sensitive alginate/bentonite hydrogel for wound dressings[J]. Fibers and Polymers, 2011, 12(2): 159. DOI:10.1007/s12221-011-0159-4 |
| [4] |
TONNESEN H H, KARLSEN J. Alginate in drug delivery systems[J]. Drug Development and Industrial Pharmacy, 2002, 28(6): 621-630. DOI:10.1081/DDC-120003853 |
| [5] |
QIN Y. Alginate fibres:an overview of the production processes and applications in wound management[J]. Polymer International, 2008, 57(2): 171-180. DOI:10.1002/pi.2296 |
| [6] |
岳占龙, 崔元璐. 葛根素参与的可注射钙离子敏感凝胶构建和性质研究[J]. 天津中医药大学学报, 2018, 37(1): 61-66. YUE Z L, CUI Y L. Construction and proprieties of a puerarin-interact, injectable and Ca2+ responsive gel[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2018, 37(1): 61-66. |
| [7] |
WANG C C, YANG K C, LIN K H, et al. A highly organized three-dimensional alginate scaffold for cartilage tissue engineering prepared by microfluidic technology[J]. Biomaterials, 2011, 32(29): 7118-7126. DOI:10.1016/j.biomaterials.2011.06.018 |
| [8] |
SRINIVASAN S, JAYASREE R, CHENNAZHI K P, et al. Biocompatible alginate/nano bioactive glass ceramic composite scaffolds for periodontal tissue regeneration[J]. Carbohydrate Polymers, 2012, 87(1): 274-283. DOI:10.1016/j.carbpol.2011.07.058 |
| [9] |
SAINI M, SINGH Y, ARORA P, et al. Implant biomaterials:A comprehensive review[J]. World Journal of Clinical Cases, 2015, 3(1): 52-57. DOI:10.12998/wjcc.v3.i1.52 |
| [10] |
MANAMA N S, HARUNB W S W, SHRIB D N A, et al. Study of corrosion in biocompatible metals for implants:a review[J]. Journal of Alloys and Compounds, 2017(701): 698-715. |
| [11] |
VISHWAKARMA A, BHISE N S, EVANGELISTA M B, et al. Engineering immunomodulatory biomaterials to tune the inflammatory response[J]. Trends in Biotechnology, 2016, 34(6): 470-482. DOI:10.1016/j.tibtech.2016.03.009 |
| [12] |
WYNN T A, VANNELLA K M. Macrophages in tissue repair, regeneration, and fibrosis[J]. Immunity, 2016, 44(3): 450-462. DOI:10.1016/j.immuni.2016.02.015 |
| [13] |
CHEN L L, DENG H D, CUI H M, et al. Inflammatory responses and inflammation-associated diseases in organs[J]. Oncotarget, 2018, 9(6): 7204-7218. |
 2020, Vol. 37
2020, Vol. 37