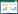文章信息
- 杨建, 王敏, 高莹, 王舒
- YANG Jian, WANG Min, GAO Ying, WANG Shu
- 基于RhoA/ROCK-1通路研究针刺干预SHR脑保护作用机制
- Study on the brain protective mechanism of acupuncture intervention on SHR based on RhoA/ROCK-1 pathway
- 天津中医药, 2020, 37(3): 313-317
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(3): 313-317
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.03.18
-
文章历史
- 收稿日期: 2019-11-29
2. 天津中医药大学第一附属医院针灸部, 国家中医临床医学研究中心, 天津 300193
高血压病是心脑血管疾病的主要诱因,随着病情的发展,最终可导致心、脑、肾、眼等靶器官的损害[1]。高血压一旦并发靶器官损害,将严重影响患者的工作和生活,因此进一步研究高血压脑损害的发病机制并探究有效防治高血压脑损害的方法已迫在眉睫。自发性高血压大鼠(SHR)与人类高血压病十分类似,是研究高血压病发病机制和筛选降压药物较为理想的动物模型。研究发现,15周龄SHR中枢神经细胞已出现核固缩、线粒体肿胀和内质网扩展等病理改变[2],18周龄SHR有明确的脑细胞凋亡、脑皮质变薄等脑损害[3]。因此,实验以针刺太冲穴为切入点,以SHR为研究对象,通过观察各组大鼠收缩压、舒张压、平均压的改变,苏木精-伊红(HE)染色光镜下检测脑组织病理形态学变化,蛋白免疫印迹(Western blot)法测定各组大鼠脑组织中RhoA、ROCK-1的表达水平,探讨针刺逆转高血压脑损害的机制,为临床防治高血压脑损害提供科学依据。
1 材料与方法 1.1 动物与分组选用16周龄SPF级SHR及WKY雄性大鼠,由北京维通利华实验动物技术有限公司提供,合格证号:SCXK-2012-0004。20只SHR按照随机数字表法分为模型对照组、太冲穴组;10只WKY大鼠为正常对照组。实验动物饲养于单独动物房层流柜中。
1.2 穴位选取参考李忠仁《实验针灸学》[4],太冲穴定位于后肢足背第1、2跖骨间凹陷处。
1.3 针刺方法应用数控捻转手法针刺仪针刺太冲穴,垂直进针2~3 mm,捻转频率固定为120次/min,捻转角度为90 °,捻转时间均为1 min。其余两组在干预期内给予相同程度,相同时长的抓取。每周治疗5 d,休息2 d,1周作为1个“治疗-休息”循环周期,共进行4个循环周期的针刺干预。
1.4 血压监测主要仪器:日本软隆(Softron)株式会社生产,型号:BP 98A。测压操作:将大鼠装入37 ℃保温鼠套固定器中固定,大鼠在固定器中适应环境平静5 min后,将加压充气尾套套在大鼠鼠尾上,观察无创血压仪显示屏上的血流波形图,待波形稳定后给尾套充气加压,测定收缩压(SBP)、舒张压(DBP)、平均压(MBP)数值,重复测量5次,取3次相近的血压值计算平均值并记录。
1.5 HE染色观察脑组织形态学改变实验周期结束后,取出鼠脑,浸泡于10%福尔马林溶液中,常规脱水、浸蜡、包埋、切片和HE染色,分别在低倍(×100)和高倍(×400)显微镜下观察脑组织病理形态学变化。
1.6 Western blot检测RhoA、ROCK-1的表达试剂:RhoA抗体(生产厂家:Abcam;货号:ab54835,批号:gr3211461-5);ROCK-1抗体(生产厂家:Abcam,货号:ab45171,批号:gr198717/24)。步骤:把脑组织剪切成小块装入EP管中,称质量;加入裂解液充分裂解;离心取上清;Bradford法蛋白质定量;取出总蛋白样品,插入冰中待其融化;加入总蛋白样品与缓冲液,变性;电泳,用非标记一抗及辣根过氧化物酶标记的二抗进行孵育,用Image J软件分析灰度值。
1.7 统计学方法数据分析应用SPSS 21.0统计软件,所有数据采用均数±标准差(x±s)表示。多组间数据比较采用单因素方差分析,重复测量资料的比较采用重复测量方差分析,P < 0.05为差异有统计学意义。
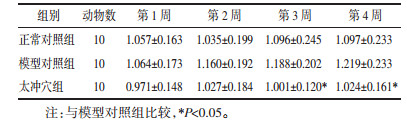
2 结果 2.1 干预前大鼠血压基线情况分别比较干预前各组大鼠基线血压,正常对照组血压值明显低于其他各组,提示高血压模型有效;模型对照组、太冲穴组SBP、DBP、MBP,差异无统计学意义(P>0.05),提示干预前各组SHR基线血压具有一致性,各组之间具有可比性,见表 1。
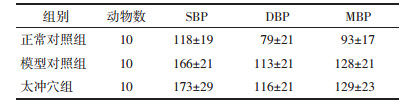
多因素重复测量方差分析结果示:不同时点与组别交互作用检验F=1.038,P=0.378 7,认为不同时点与组别间不存在交互作用,不同时点测量的血压改变率无统计学差异,F=0.314 2,P=0.928 4,组别间方差分析结果有统计学差异,F=6.364,P=0.002 4,即组间处理因素对血压改变率影响有差异。针后1 h收缩压数值及改变率分析发现:两种大鼠SBP随着鼠龄的增加而逐渐增高,WKY大鼠血压虽升高,但仍在正常范围内。与模型对照组相比,针刺太冲组大鼠血压上升缓慢,提示针刺太冲穴有降压效应。随干预周期延长,太冲穴组血压无较大的波动,提示针刺太冲穴可平稳降压。针刺干预后太冲穴组SBP改变率在第3周、第4周较模型对照组显著降低,差异有统计学意义(P < 0.05)。见表 2、表 3。
|
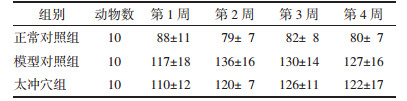
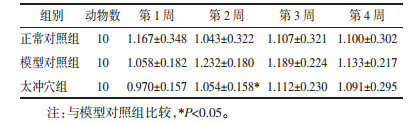
多因素重复测量方差分析结果示:不同时点与组别交互作用检验F=0.403 1,P=0.751 0,认为不同时点与组别间不存在交互作用,不同时点测量的血压改变率无统计学差异,F=0.743 1,P=0.616 1,组别间方差分析结果无统计学差异,F=1.441,P=0.241 1,即组间处理因素对血压改变率影响无统计学差异(P>0.05)。第2周DBP改变率,太冲穴组与模型对照组比较,差异有统计学意义(P < 0.05)。见表 4、表 5。
|
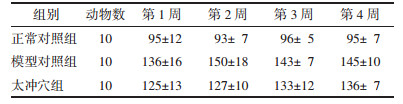
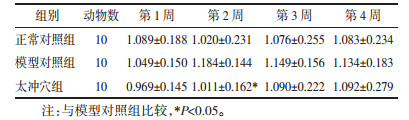
多因素重复测量方差分析结果示:不同时点测量的血压改变率无统计学差异,F=0.595 7,P=0.733 2,不同时点与组别交互作用检验F=0.789 4,P=0.502 4,认为不同时点与组别间不存在交互作用,组别间方差分析结果无统计学差异,F=2.046,P=0.134 2,即组间处理因素对血压改变率影响差异无统计学意义。第2周MBP改变率,太冲穴组与模型对照组比较,差异有统计学意义(P < 0.05)。见表 6、表 7。
|
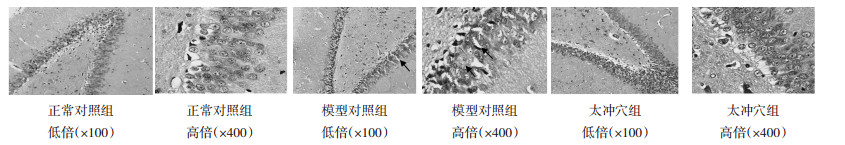
正常对照组:脑各层结构存在,锥体神经细胞排列规则,局部紊乱,散在细胞变性、坏死,胞浆尼氏体着色清晰,胞核淡染,核仁清楚,局部间质水肿。模型对照组:脑各层结构存在,锥体神经细胞排列紊乱,胞体肿胀,局部细胞坏死,间质水肿,血管扩张充血。太冲穴组:脑各层结构存在,锥体神经细胞排列规则,胞浆尼氏体着色清晰,胞核淡染,核仁清楚。见图 1。
|
| 图 1 光镜下各组大鼠脑组织形态学变化 Fig. 1 Histomorphological changes of brain tissue in rats under light microscope |
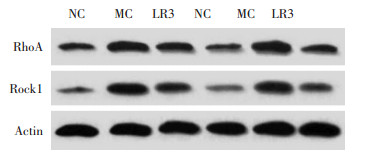
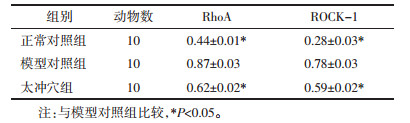
RhoA:正常对照组与模型对照组比较,差异有统计学意义;太冲穴组与模型对照组比较,差异有统计学意义。ROCK-1:正常对照组与模型对照组比较,差异有统计学意义(P < 0.05);太冲穴组与模型对照组比较,差异有统计学意义(P < 0.05)。结果见图 2和表 8。
|
| 图 2 RhoA、ROCK-1在各组的的表达 Fig. 2 Expression of RhoA and ROCK-1 in each group |
|
高血压病以动脉血压升高为主要特点,病久或可伴有心、肾、眼、脑等靶器官损害。天津中医药大学第一附属医院石学敏院士根据多年临床经验创立了以太冲穴、人迎穴为主穴,具有明确规范手法量学标准和量效关系的针刺法。临床研究表明,针刺可显著改善高血压患者血压的昼夜节律及变异性,拥有良好的即刻及远期效应,针刺降压的同时对心、肾、眼、脑等靶器官起到保护作用,发挥针刺降压的优势[5-7]。实验也证实针刺太冲穴可降低SHR大鼠血压,并且针刺后脑部细胞排列规则,水肿减轻,脑损害得以改善。
ROCK又称Rho激酶,Rho/ROCK通路介导抑制性信号阻断中枢细胞再生,是普遍存在于中枢神经系统中的一条信号通路。研究表明Rho/ROCK通路诱导应力纤维形成、细胞迁移和细胞骨架重组,与组织收缩和生长、血管和组织通透性等生理功能有关。Rho/ROCK通路异常是高血压病、心脏病、神经损伤性疾病产生的重要因素[8]。
ROCK主要通过激活肌球蛋白轻链磷酸酯酶的抑制蛋白CPI-17和磷酸化肌球蛋白轻链、钙离子(Ca2+)增敏、引起非依赖于Ca2+浓度的血管收缩3条途径引起血管收缩,进而导致外周阻力增加,血压升高;ROCK还可抑制内皮一氧化氮合酶的活性,使血管内一氧化氮(NO)减少,血管舒张功能下降,血压升高[9-10];存在于中枢神经系统内的ROCK含量下降亦可使SHR的血压持续下降,提示ROCK还可通过中枢系统调节血压水平[11]。基础研究表明在肾性高血压大鼠、L-NAME诱导的高血压大鼠和SHR ROCK抑制剂Y-27632后,血压能够明显降低,且能抑制心肌细胞的凋亡[12],提示RhoA/ROCK通路激活在很大程度上参与了高血压的发生发展及靶器官的损害。
Rho/ROCK通路在脑损伤的发生发展过程中也起到了重要的作用。有研究提示抑制Rho/ROCK信号通路,可阻止神经轴突变性,明显减少大鼠脊髓神经元的空泡样变性坏死率,加强脊髓神经元损伤后的再生[13]。临床研究提示阻断Rho/ROCK信号通路,可促进脑外伤、脊髓损伤和阿尔茨海默病(AD)等导致的中枢神经系统(CNS)损伤后的神经细胞再生[14-15]。因此临床和基础研究均显示Rho/ROCK通路参与神经细胞的凋亡和再生,是重要的调节通路。
ROCK分布于全身组织,包含ROCK1和ROCK2两种亚型。既往研究显示ROCK1在非神经组织(脾、肝、肺和睾丸)中有更高表达,而ROCK2在心脏、脑和肌肉中有更高表达[8]。有研究表明ROCK1在损伤的脑组织中也有明显表达,和抗凋亡因子Bcl-2呈负相关[16],作为Rho的效应物,通过Caspase-3介导的ROCK1分裂和激活来调节凋亡过程中空泡的形成[17],表明ROCK1可能参与了脑细胞凋亡。
实验中模型对照组和正常对照组相比,前者RhoA和ROCK1的表达要明显高于后者,血压的增高和RhoA、ROCK1的表达呈正相关。针刺降压的同时降低了RhoA和ROCK1的表达,表明针刺可能通过降低RhoA和ROCK1的表达进而降低血压。实验中电镜结果显示针刺可以改善脑组织损害,同时Western blot结果显示RhoA、ROCK1的表达降低,表明针刺可能通过抑制RhoA/ROCK1通路起到保护靶器官的作用。
综上所述,针刺能够降低SHR血压,改善脑损害,其机制可能与抑制RhoA/ROCK1信号通路表达有关。因此,针刺作为一种简、便、效、廉的高血压病非药物疗法,对高血压伴随心脑等靶器官损害的患者而言,具有广泛的临床应用前景。实验亦有局限,如应设立非穴组来研究针刺太冲降压的特异性,笔者将在后续研究中不断完善。
| [1] |
COLLINS A J, FOLEY R N, CHAVERS B, et al. United states renal data system 2011 annual data report:atlas of chronic kidney disease&end-stage renal disease in the united states[J]. American Journal of Kidney Diseases, 2012, 59(Suppl 1): A7, e1-420. |
| [2] |
乔木, 王文, 张会东, 等. 普伐他汀对脑卒中易感型自发性高血压大鼠脑损害及内皮细胞功能的影响[J]. 中华老年心脑血管病杂志, 2002, 4(3): 182-186. QIAO M, WANG W, ZHANG H D, et al. Effects of pravastatin on brain damage and endothelial cell function in rats susceptible to stroke and spontaneous hypertension[J]. Editorial Departmert of Chinese Journal of Geriatric Cardiovascular and Cerebrovascular Disease, 2002, 4(3): 182-186. |
| [3] |
王雪, 万征, 孙跃民, 等. 依普利酮对自发性高血压大鼠脑组织醛固酮与脑损害的作用[J]. 中国循证心血管医学杂志, 2009, 1(4): 273-276. WANG X, WAN Z, SUN Y M, et al. Effects of epredone on aldosterone and brain damage in spontaneous hypertensive rats[J]. Chinese Journal of Evidence-Based Cardiovascular Medicine, 2009, 1(4): 273-276. |
| [4] |
李忠仁. 实验针灸学[M]. 北京: 中国中医药出版社, 2003. LI Z R. Experimental acupuncture[M]. Beijing: China Press of Traditional Chinese Medicine, 2003. |
| [5] |
申鹏飞, 石学敏. 针刺治疗原发性高血压病的临床疗效观察[J]. 辽宁中医杂志, 2010, 37(9): 1802-1803. SHEN P F, SHI X M. Clinical observation of acupuncture on primary hypertension[J]. Liaoning Journal of Traditional Chinese Medicine, 2010, 37(9): 1802-1803. |
| [6] |
申鹏飞, 石学敏. 针刺治疗亚急性原发性高血压病30例[J]. 中医杂志, 2010, 51(1): 57-58. SHEN P F, SHI X M. Acupuncture treatment of 30 cases of subacute essential hypertension[J]. Journal of Traditional Chinese Medicine, 2010, 51(1): 57-58. |
| [7] |
张春红, 卞金玲, 杜宇征, 等. 针刺治疗高血压60例[J]. 上海针灸杂志, 2010, 29(8): 490-491. ZHANG C H, BIAN J L, DU Y Z, et al. Acupuncture treatment of 60 cases of hypertension[J]. Shanghai Journal of Acupuncture and Moxibustion, 2010, 29(8): 490-491. |
| [8] |
韩佳寅, 易艳, 梁爱华, 等. Rho/ROCK信号通路研究进展[J]. 药学学报, 2016, 51(6): 853-859. HAN J Y, YI Y, LIANG A H, et al. Advances in Rho/ROCK signaling pathways[J]. Acta Pharmaceutica Sinica, 2016, 51(6): 853-859. |
| [9] |
LI Q, LI X Y, LIU A L. The research progress of Rho associated kinase in physiology and pathophysiology[J]. Chinese Pharmaceutical Journal, 2011, 46(24): 1860-1864. |
| [10] |
严丽梅, 吴建勇, 于潇华, 等. 内含子源性microRNA对内皮型一氧化氮合酶表达及血管内皮细胞增殖的作用[J]. 生物化学与生物物理进展, 2010, 37(7): 747-753. YAN L M, WU J Y, YU X H, et al. Effects of intron-derived microRNA on expression of endothelial nitric oxide synthase and proliferation of vascular endothelial cells[J]. Progress in Biochemistry and Biophysics, 2010, 37(7): 747-753. |
| [11] |
李克嵩.针刺对自发性髙血压大鼠血管内皮RhoA/ROCK通路的影响[D].广州: 广州中医药大学, 2018. LI K S. Effect of acupuncture on RhoA/ROCK access in vascular endothelium of spontaneous high blood pressure rats[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10572-1018274156.htm |
| [12] |
段为钢, 袁胜涛, 廖红, 等. Rho激酶及其抑制剂的研究进展[J]. 药学学报, 2007, 42(10): 1013-1022. DUAN W G, YUAN S T, LIAO H, et al. Advances in the study of Rho kinase and its inhibitors[J]. Acta Pharmaceutica Sinica, 2007, 42(10): 1013-1022. |
| [13] |
FUJIMURA M, USUKI F, KAWAMURA M, et al. Inhibition of the Rho/ROCK pathway prevents neuronal degeneration in vitro and in vivo following methylmercury exposure[J]. Toxicology and Applied Phamacology, 2011, 250(1): 1-9. |
| [14] |
RAAD M, ELTAL T, GUL R, et al. Neuroproteomics approach and neurosystems biology analysis:ROCK inhibitors as promising therapeutic targets in neuro degeneration and neuro totrauma[J]. Electro Phoresis, 2012, 33(24): 3659-3668. |
| [15] |
TAN H, ZHONG Y S, CHENG Y, et al. Rho/ROCK pathway and neural regeneration:a potential therapeutic target for central nervous system and optic nerve damage[J]. Int J Ophthalmol, 2011, 4(6): 652-657. |
| [16] |
蒋国红, 王长明, 徐平, 等. ROCK1在大鼠脑缺血再灌注致细胞凋亡中的作用[J]. 中国老年学杂志, 2018, 38(2): 295-298. JIANG G H, WANG C M, XU P, et al. Effects of ROCK1 on apoptosis induced by cerebral ischemia reperfusion in rats[J]. Chinese Journal of Gerontology, 2018, 38(2): 295-298. |
| [17] |
张红艳, 翟丽, 王婷婷, 等.胡黄连苷Ⅱ通过抑制Cytc/Caspase-3/Rock1通路发挥神经保护作用[A].第八届全国中西医结合营养学术会议论文资料汇编[C].中国中西医结合学会营养学专业委员会, 2017: 7. ZHANG H Y, ZHAI L, WANG T T, et al. Rhizoma coptidis hu glycosides Ⅱ by inhibiting Cytc/Caspase-3/Rock1 pathways play a role of neuroprotection[A]. The eighth national conference on integrated traditional Chinese and western medicine nutrition[C]. Chinese Association of Integrated Traditional Chinese and Western Medicine Nutrition Professional Committee, 2017: 7. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGZP201707002014.htm |
2. National Clinical Medicine Research Center of Traditional Chinese Medicine, Department of Acupuncture, First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2020, Vol. 37
2020, Vol. 37