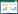文章信息
- 刘甜甜, 王擎擎, 姚魁武, 刘友明, 段锦龙
- LIU Tiantian, WANG Qingqing, YAO Kuiwu, LIU Youming, DUAN Jinlong
- 活血温通方对缺氧心肌细胞氧化应激和凋亡的影响
- Effect of Huoxue Wentong Formula on oxidative stress and apoptosis of cardiomyocyte induced by hypoxia
- 天津中医药, 2020, 37(3): 322-325
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(3): 322-325
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.03.20
-
文章历史
- 收稿日期: 2019-10-23
心肌梗死严重威胁人类生命健康,其发病率和病死率已居各类心血管疾病之首[1]。心肌梗死是由于冠状动脉闭塞引起局部心肌严重而持久的缺血缺氧导致心肌细胞坏死的一种病症[2],其损伤机制复杂。已知心肌细胞的氧化损伤、凋亡和坏死是影响急性心肌梗死后心脏功能恢复的关键因素[3],因此抗氧化治疗和抑制心肌凋亡对防控心肌梗死等缺血性心脏病具有重要意义。
中医认为心肌梗死发病多与阳微阴弦、心阳不振、瘀血滞脉有关。活血温通方是由导师姚魁武教授在传承国医大师薛伯寿教授学术思想基础上研发的中药方剂。该方由丹参、桂枝、川芎、鸡血藤、赤芍、党参6味中药组成,具有活血化瘀、益气温阳、通脉止痛的功效,临床用于治疗心肌缺血具有一定疗效,但活血温通方疗效的科学机制尚未明确。本研究拟采用缺氧无血清刺激诱导心肌细胞损伤,模拟体内心肌缺血过程,验证活血温通方对心肌细胞缺氧损伤的保护作用,为防治缺血性心脏病提供选择性药物治疗。
1 材料 1.1 动物健康成年雄性Wistar大鼠10只,体质量220~240 g,购自北京华阜康生物科技股份有限公司,实验动物合格证号:SCXK(京)2014-0004,动物实验由中国中医科学院广安门医院实验动物使用与管理委员会批准(伦理批号:IACUC-GAMH-2019-005)。
1.2 细胞H9c2大鼠心肌细胞(广州吉妮欧生物科技有限公司)。
1.3 药品和试剂活血温通方组成:丹参30 g,桂枝10 g,川芎9 g,鸡血藤10 g,赤芍10 g,党参10 g,由中国中医科学院广安门医院中药房经提取、浓缩制成颗粒剂。DMEM高糖培养基(Gibco,批号8119034),活性氧(ROS)检测荧光探针-DHE(江苏凯基生物技术有限公司),噻唑蓝(MTT)(Solarbio,批号1123A0510),细胞凋亡-Hoechst染色试剂盒(碧云天生物技术,批号022519190320),Caspase 3活性测定试剂盒(Solarbio,批号20190404),Caspase 8活性测定试剂盒(Solarbio,批号20190404),丙二醛(MDA)测试盒(南京建成生物工程研究所,批号20190401),过氧化氢酶(CAT)测试盒(南京建成生物工程研究所,批号20190402),超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所,批号20190313)。
1.4 仪器SpectraMax M2型酶标仪(Molecular Devices,美国),化学发光凝胶成像FluorChemTMFC3 system(Protein Simple,美国),二氧化碳细胞培养箱(Thermo Fisher Scientific,美国),低氧细胞培养箱(Thermo Fisher Scientific,美国),eppendorf高速冷冻离心机,台式恒温振荡器(太仓市实验设备厂),Leica DM 2LLED倒置显微镜,Nicon TI-U倒置荧光显微镜。
2 方法 2.1 含药血清制备Wistar大鼠随机分为空白组和活血温通方组,每组5只。活血温通方组按840 mg/kg剂量灌胃(按人体表面积折算的等效剂量),空白组给予等体积纯水灌胃,每日2次,连续灌胃5 d。于末次灌胃1 h后,采用6%水合氯醛麻醉,腹主动脉取血,3 500 r/min,离心15 min,取上清,经灭活和0.22 μm微孔滤膜过滤除菌后,将含药血清及空白血清保存于-80 ℃冰箱,备用。实验时用培养基配置终浓度为10%的含药血清。
2.2 细胞缺氧模型建立及分组接种合适密度的H9c2心肌细胞于DMEM高糖完全培养基中(含10%胎牛血清和1%青霉素-链霉素混合液),然后将培养好的H9c2用磷酸缓冲盐溶液(PBS)洗2次,培养于Hanks buffer缓冲液中(无胎牛血清),缺氧组(给予空白血清)和活血温通方组(给予活血温通方血清)的H9c2置于37 ℃低氧培养箱中培养4 h(95% N2,5% CO2),对照组的H9c2置于37 ℃常氧培养箱中(95% O2,5% CO2)培养相同的时间。
2.3 指标检测 2.3.1 细胞活力测定使用MTT法评价细胞活力情况。采用0.25%胰酶消化不同组细胞,按每孔5×104个细胞接种于96孔板,于37 ℃,5% CO2孵箱中孵育,同时加MTT溶液(5 mg/mL)20 μL,再孵育4 h,然后弃上清,每孔加入150 μL二甲基亚砜(DMSO),振荡10 min,使结晶物充分溶解,酶标仪测定490 nm波长处A值。计算公式如下:细胞活力(%)=(A处理组-A空白组)/(A对照组-A空白组)×100%。
2.3.2 Caspase活性测定收集细胞蛋白,测定细胞裂解液中Caspase 3和Caspase 8活性,按试剂盒说明书进行测定。
2.3.3 抗氧化酶活性和MDA含量测定收集细胞蛋白裂解液评价SOD、CAT活性及MDA含量的改变,按照试剂盒说明书进行检测。
2.3.4 活性氧ROS检测利用荧光探针二氢乙啶(DHE)检测细胞内活性氧ROS的产生。接种合适密度心肌细胞于6孔板内,用PBS洗涤细胞,在含5 μmol/L DHE的PBS中37 ℃孵育30 min。然后,用PBS再次清洗细胞,于倒置荧光显微镜观察各组红色细胞核数目改变,观察各组心肌细胞ROS含量。
2.3.5 细胞凋亡检测接种合适密度心肌细胞于12孔板内,细胞融合约80%进行Hoechst染色,按试剂盒说明书进行操作。倒置荧光显微镜观察细胞核形态变化,观察各组心肌细胞凋亡情况。
2.4 统计学方法使用SPSS 21.0软件进行统计,所有数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD法,P < 0.05为差异有统计学意义。
3 结果 3.1 心肌细胞活力与对照组相比,缺氧组H9c2细胞活力明显降低(P < 0.05)。而与缺氧组比较,活血温通方含药血清组细胞活力明显上升(P < 0.01)。活血温通方对缺氧H9c2细胞活力的影响。见表 1。
|
与对照组相比,缺氧组H9c2细胞中Caspase 3和Caspase 8活性显著升高(P < 0.01)。与缺氧组相比,活血温通方含药血清组中细胞Caspase 3和Caspase 8活性显著降低(P < 0.01)。活血温通方对缺氧H9c2细胞Caspase活性的影响。见表 1。
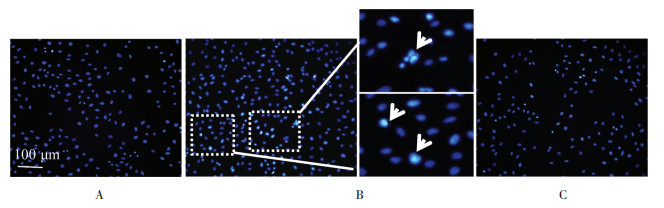
3.3 心肌细胞凋亡数目对照组心肌细胞的细胞核呈正常蓝色,而缺氧会导致H9c2细胞凋亡,所以Hoechst染色后,缺氧组多数细胞核会呈现致密浓染,或呈碎块状致密浓染,颜色发白(白色箭头指示)。与缺氧组比较,活血温通方组的浓染细胞核数目明显减少,多数细胞核呈正常蓝色。见图 1。
|
| 注:A.对照组;B.缺氧组;C.活血温通方含药血清组。 图 1 活血温通方对缺氧H9c2细胞凋亡的影响(Hoechst染色,×200) Fig. 1 Effect of Huoxue Wentong Formula on apoptosis in hypoxic H9c2 cells (Hoechst staining, ×200) |
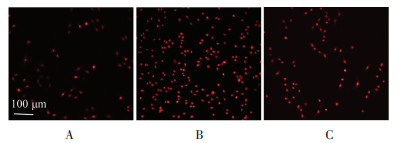
DHE是反映活性氧ROS含量的指标,采用DHE染色可使被ROS氧化的细胞核呈现明亮的红色荧光。与对照组比较,缺氧组心肌细胞中红色荧光细胞核数目显著增多,而与缺氧组相比,活血温通方组的细胞核呈红色荧光的数目明显减少,见图 2。
|
| 注:A.对照组;B.缺氧组;C.活血温通方含药血清组。 图 2 活血温通方对缺氧H9c2细胞ROS的影响(DHE染色,×200) Fig. 2 Effect of Huoxue Wentong Formula on ROS in hypoxic H9c2 cells (DHE staining, ×200) |
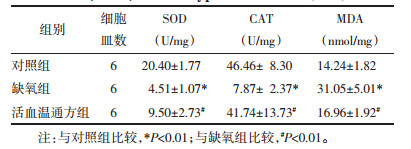
与对照组相比,缺氧组H9c2细胞中SOD、CAT活性明显降低(P < 0.01),而MDA含量显著增加(P < 0.01)。与缺氧组相比,活血温通方组细胞中SOD、CAT活性明显回升(P < 0.01),同时MDA含量显著降低(P < 0.01)。见表 2。
|
心肌细胞氧化损伤、坏死和凋亡参与了缺血性心脏病的发展进程,包括冠心病、心绞痛、心肌梗死、心肌缺血再灌注损伤和心力衰竭等[2]。因此,最大程度减轻氧化损伤和抑制心肌凋亡已成为治疗缺血性心脏病的潜在新策略。研究结果显示活血温通方可以通过增加细胞活力、抑制心肌细胞凋亡,并且增强抗氧化酶活性,减轻过氧化损伤,从而保护心肌细胞免受缺氧损伤。
凋亡是组织细胞内稳态调节和器官发育的调控机制,在心肌梗死过程中,心肌细胞凋亡是造成心肌损伤和功能障碍的重要因素之一[4]。因此,心肌细胞凋亡作为基本的病理变化在心肌损伤中发挥着重要的作用。以往的研究表明,缺氧可引起过氧化物累积,激活Caspase 3,导致心肌细胞凋亡[5-6]。细胞凋亡的特征是染色质凝聚、DNA断裂和蛋白质分解[7]。目前已知有2个经典的凋亡信号传导通路,即外源性膜受体调节凋亡通路和内源性线粒体调节凋亡通路,这2条通路均存在于心肌细胞凋亡过程中。一方面,与死亡受体配体(如Fas)相互作用导致Fas相关死亡结构域(Fadd)形成,进一步激活Caspase 8活性,然后再激活Caspase 3,最终引发细胞凋亡,这是外源性凋亡通路。另一方面,凋亡信号引起线粒体激活,然后释放线粒体膜空间蛋白形成凋亡小体,并激活Caspase 9,最终触发细胞凋亡,这是内源性凋亡通路[8]。因此,明确心肌细胞凋亡机制有助于寻找合适的治疗药物,从而减少缺血性心脏病的发病率和致死率。研究证实了活血温通方可以通过降低Caspase 3和Caspase 8活性而抑制心肌细胞凋亡。
氧化应激反应与心肌细胞损伤密切相关,是缺血性心脏病发生发展的关键因素[9]。氧化应激包括氧化产物生成的增加和抗氧化酶活性的降低。心肌损伤可由ROS引起,正常情况下,体内产生的少量ROS能被清除,但是ROS生成过多,机体不能及时有效清除,长期贮存体内能与脱氧核糖核酸(DNA)、蛋白质和脂质相互作用,进而导致过氧化损伤[10-11]。因此,抗氧化治疗对于减轻心肌损伤至关重要。本研究结果表明,通过提高细胞内抗氧化酶SOD、CAT活性,抑制ROS的产生和MDA的生成,活血温通方可以有效抵抗缺氧诱导的氧化应激损伤。
中医认为阳微阴弦是缺血性心脏病发病的基本病机,心阳不振,阴邪瘀阻,生物学机制上可见氧化损伤、坏死和凋亡。活血温通方针对缺血性心脏病阳微阴弦病机,结合临证经验组方,具有抗心肌缺血的功效。研究结果显示心肌细胞缺氧之后,细胞活力降低,凋亡增加,抗氧化酶活性降低,ROS增加,致使心肌细胞损伤加重。活血温通方能增加细胞活力,抑制凋亡发生,增强抗氧化酶活力,减轻活性氧产生,显示活血温通方具有保护心肌缺氧损伤的作用。活血温通方活血化瘀、益气温阳、通脉止痛,通过抑制细胞凋亡和减轻氧化损伤,提高机体抗氧化酶活力阻断心肌缺氧损伤进程,为进一步研究活血温通方的保护作用机制奠定基础。
| [1] |
INFANTE T, FPRTE E, SCHIANO C, et al. An integrated approach to coronary heart disease diagnosis and clinical management[J]. American Journal of Translational Research, 2017, 9(7): 3148-3166. |
| [2] |
MONTECUCCO F, CARBONE F, SCHINDLER T H. Pathophysiology of ST-segment elevation myocardial infarction:novel mechanisms and treatments[J]. European Heart Journal, 2015, 37(16): 1268-1283. |
| [3] |
ZHANG T, ZHANG Y, CUI M, et al. CaMKⅡ is a RIP3 substrate mediating ischemia-and oxidative stress-induced myocardial necroptosis[J]. Nature Medicine, 2016, 22(2): 175-182. DOI:10.1038/nm.4017 |
| [4] |
LIU M H, LIN X L, GUO D M, et al. Resveratrol protects cardiomyocytes from doxorubicin-induced apoptosis through the AMPK/P53 pathway[J]. Molecular Medicine Reports, 2016, 13(2): 1281-1286. DOI:10.3892/mmr.2015.4665 |
| [5] |
YANG Y, YAN X, XUE J, et al. Connexin 43 dephosphorylation at serine 282 is associated with connexin43-mediated cardiomyocyte apoptosis[J]. Cell Death and Differentiation, 2019, 26(7): 1332-1345. DOI:10.1038/s41418-019-0277-x |
| [6] |
WANG Z, YU J, WU J, et al. Scutellarin protects cardiomyocyte ischemia-reperfusion injury by reducing apoptosis and oxidative stress[J]. Life Sciences, 2016, 157(7): 200-207. |
| [7] |
SHI Z, FU F, YU L, et al. Vasonatrin peptide attenuates myocardial ischemia-reperfusion injury in diabetic rats and underlying mechanisms[J]. American Journal of Physiology-Heart and Circulatory Physiology, 2014, 308(4): 281-290. |
| [8] |
HENGARTNER M O. The biochemistry of apoptosis[J]. Nature, 2000, 407(6805): 770-776. DOI:10.1038/35037710 |
| [9] |
JIN J K, BLACKWOOD E A, AZIZI K, et al. ATF6 decreases myocardial ischemia/reperfusion damage and links ER stress and oxidative stress signaling pathways in the heart[J]. Circulation Research, 2017, 120(5): 862-875. DOI:10.1161/CIRCRESAHA.116.310266 |
| [10] |
NEWSHOLME P, HABER E P, HIRABARA S M, et al. Diabetes associated cell stress and dysfunction:role of mitochondrial and non-mitochondrial ROS production and activity[J]. The Journal of Physiology, 2007, 583(1): 9-24. DOI:10.1113/jphysiol.2007.135871 |
| [11] |
陈雪, 沈楠, 安英, 等. 丹酚酸B对氧化应激损伤乳鼠心肌细胞的保护作用及其机制[J]. 吉林大学学报(医学版), 2018, 44(5): 974-978. CHEN X, SHEN N, AN Y, et al. Protective effect of salvianolic acid B on cardiomyocytes of suckling rats with oxidative stress injury and its mechanism[J]. Journal of Jilin University (Medicine Edition), 2018, 44(5): 974-978. |
 2020, Vol. 37
2020, Vol. 37