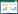文章信息
- 邓楠, 樊姝宁, 徐甜, 程发峰, 王雪茜, 王庆国
- DENG Nan, FAN Shuning, XU Tian, CHENG Fafeng, WANG Xueqian, WANG Qingguo
- 基于网络药理学探讨红花治疗非酒精性脂肪肝的可能性
- To explore the possibility of Carthamus tinctorius in the treatment of non-alcoholic fatty liver based on the network pharmacology
- 天津中医药, 2020, 37(3): 326-331
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(3): 326-331
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.03.21
-
文章历史
- 收稿日期: 2019-11-20
非酒精性脂肪肝(NAFLD)是指以除外酒精和其他明确的损肝因素所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,与肥胖、高血糖、高脂血症关系密切,是造成慢性肝病、肝功能异常的主要原因之一[1]。目前全球流行病学调查表明,NAFLD在全球的发病率为10%~30%,亚洲国家平均为11%~16%,中国的患病率约15%,且逐步呈低龄化趋势[2-3]。尽管近年来NAFLD的发病率持续增加,但临床上仍缺乏公认的对NAFLD具有明显疗效的药物治疗。目前的主要治疗方法是以调节血脂作为辅助治疗,同时改变生活方式、健康饮食和规律运动,从而促进脂肪减少以减缓NAFLD病程进展,然而效果并不理想[4]。
中医药治疗NAFLD结合辨证与辨病的特点,治疗方法多样,在一定程度上可以有效阻止病情的发展。红花为菊科植物红花的干燥花,性温,味辛,归心、肝经,具有活血通经,祛瘀止痛的功效。实验研究表明红花注射液的使用提高了高脂血症的治疗有效率,缩短了治疗时间[5]。同时,红花提取物可以降低血浆黏度,减少氧自由基,降低脂蛋白对血管内皮细胞损伤程度从而提高其抗氧化能力[6]。表明红花具有降血脂、减轻氧化应激的作用。因此,笔者推论红花可以治疗NAFLD。研究利用网络药理学研究方法,筛选出红花的活性成分,挖掘出其治疗NAFLD的多靶点与多通路,为阐明红花治疗NAFLD提供参考。
1 方法 1.1 红花所含化学成分的收集与筛选本研究采用中药系统药理数据库和分析平台TCMSP(http://lsp.nwu.edu.cn/tcmsp.php),以“红花”为关键词,检索红花的化学成分共计189个。生物利用度是药物吸收、分布、代谢、排泄(ADME)特性中最重要的药物代谢动力学参数之一。口服是中药在胃肠道发挥作用的最主要途径,因此本研究主要以红花中化合物口服生物利用度筛选阈值均≥30%,化合物类药性筛选阈值均≥0.18,以此得到符合条件的候选化合物。
1.2 红花靶点预测基于TCMSP数据库结果,通过蛋白质数据库(http://www.uniprot.org/)获得与化合物相对应的化学结构式,利用Swiss靶点预测数据库(http://swisstargetprediction.ch/)找到该化合物的预测靶点。
1.3 挖掘已知的NAFLD相关靶点从目前可用的DisGeNET数据库(http://www.disgenet.org/2019版v6.0)和OMIM数据库(https://omim.org/)中,以“非酒精性脂肪肝”为关键词,获取NAFLD的已知靶点。
1.4 GO与通路富集分析GO分析包括:生物过程(BP)、细胞组分(CC)和分子功能(MF)。KEGG通路富集分析是描述候选靶点特征的常用方法,本研究以P < 0.05作为假定值,利用数据库对GO和KEGG信号通路分析。
1.5 成分-靶点-信号通路网络构建将红花的有效活性成分与其治疗NAFLD的潜在作用靶标关系及以P<0.05的KEGG通路中前10位信号通路导入Cytoscape软件中,构建出成分-靶点-信号通路网络。
2 结果 2.1 红花的活性化合物通过TCMSP数据库中获取红花中OB≥30%,DL≥0.18的化合物共18个。见表 1。
根据筛选出的红花预测靶点及已知NAFLD靶点,利用omicshare软件画出维恩图,分析出交集靶点38个。见图 1。
|
| 图 1 红花和NAFLD交互的38个常见靶点 Fig. 1 The 38 common targets for interaction between Carthamus tinctorius and nonalcoholic fatty liver disease |
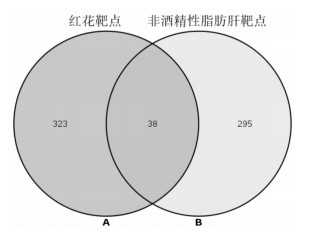
利用STRING软件构建了红花治疗NAFLD交互靶点间的蛋白关系网络。网络包含38个蛋白质节点,140条相互作用关系(连线)。见图 2。
|
| 图 2 基于STRING的药物-疾病靶标相互作用图 Fig. 2 Drug-disease target interaction map based on STRING treatment of nonalcoholic fatty liver disease |
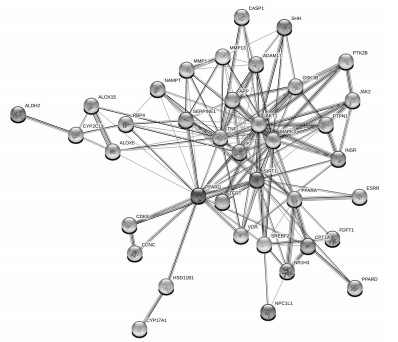
利用DAVID数据库,将交互靶点的GO生物过程富集分析结果按照P由低到高排序,选择排名前10的数据结果,得到生物过程结果如图 3A所示:分别为RNA聚合酶Ⅱ启动子转录的正调控、RNA聚合酶Ⅱ启动子的转录起始、类固醇激素介导的信号通路、蛋白质磷酸化的正调控、一氧化氮生物合成过程的正向调控、RNA聚合酶Ⅱ启动子转录的负调控、调控细胞增殖、蛋白质磷酸化、胆固醇储存负调控、细胞内受体信号通路。细胞成分的分析结果如图 3B所示,靶点主要涉及核、细胞质、质膜、受体和胞浆等。分子功能如图 3C所示,靶点主要涉及类固醇激素受体活性、药物结合、酶结合、锌离子结合、蛋白质结合、铁离子结合、受体结合等。
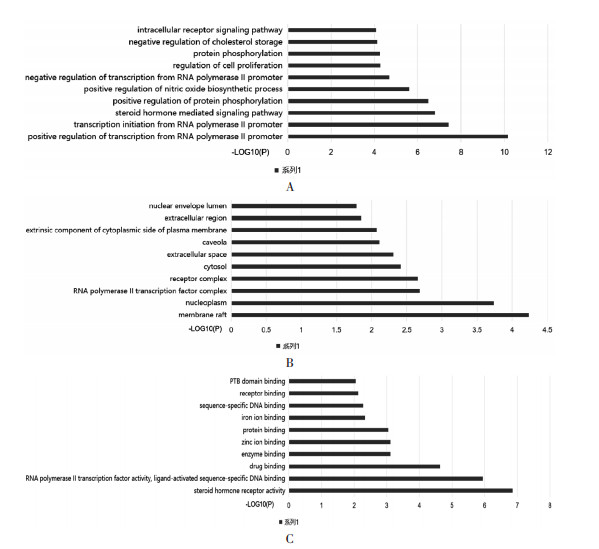
|
| 注:A.生物学过程;B.细胞成分;C.分子功能;P<0.05的前10项。 图 3 对交互的基因进行GO分析 Fig. 3 GO analysis of interacting genes |
该网络共包括节点61个,边134条。不同节点有不同的意义,其中菱形节点代表活性成分,正方形节点代表作用交集靶标,圆形代表信号通路,而边则代表成分、靶标及信号通路的关系。不同靶标可对应相同的活性成分及信号通路,同一靶标也可与不同的活性成分及信号通路相对应,可见红花治疗NAFLD具有多成分、多靶点、多信号通路的特点。见图 4。
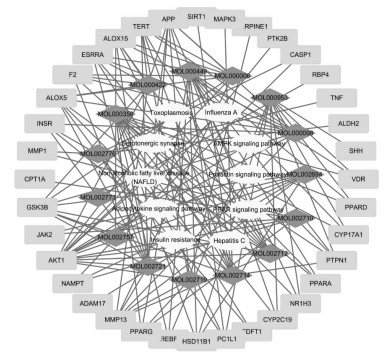
|
| 图 4 红花成分-靶点-信号通路网络 Fig. 4 Carthamus tinctorius constituents-target-signal pathway network |
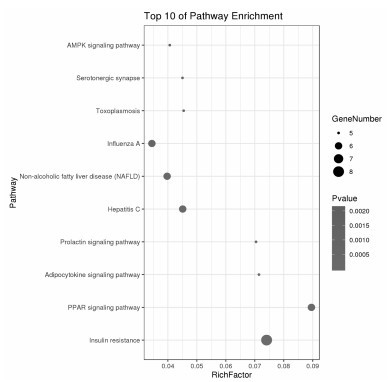
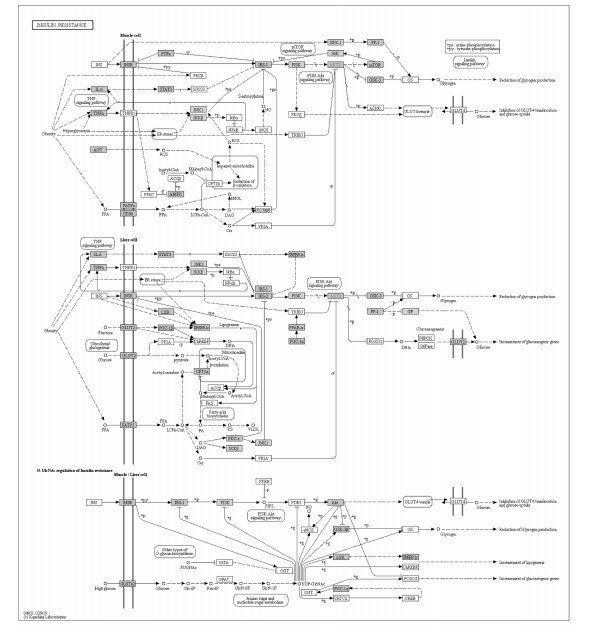
将基因名称导入DAVID数据库,构建KEGG通路富集分析,以P<0.05判断具有显著性进行筛选,共获得33条富集通路,其中前10条KEGG通路分别为胰岛素抵抗、PPAR信号通路、脂肪细胞因子信号通路、泌乳素信号通路、丙型肝炎、NAFLD、甲型流感、弓形虫病、血清素的神经突触、AMPK信号通路。见图 5。表明红花的有效成分可能通过作用以上通路来治疗NAFLD。根据以上分析,基于P值,选择胰岛素抵抗通路进一步了解红花治疗NAFLD的可能性。概念图包含了胰岛素抵抗通路中红花的靶点和NAFLD靶点,基于这些数据,假设红花通过调节胰岛素抵抗通路治疗NAFLD。概念图见图 6。
|
| 图 5 活性靶点KEGG代谢通路气泡图 Fig. 5 Bubble diagram of active target KEGG metabolic pathway |
|
| 图 6 红花在胰岛素抵抗通路中的KEGG富集分析 Fig. 6 KEGG enrichment analysis of Carthamus tinctorius in insulin resistance pathway |
中医药治疗NAFLD的优势已逐渐显现,单味药或诸药合用都能调节肝脏脂质代谢,促进吸收和排泄,且可避免长期服用西药带来的不良反应。红花具有明显的降脂、抗氧化的作用,且能有效治疗高脂血症。
研究采用网络药理学方法,通过TCMSP数据库共发现红花化学成分189个,进一步筛选获得主要活性成分18个,为红花的研究提供了更多可能性。
通过构建靶点维恩图,共获得红花治疗酒精性脂肪肝相关靶点38个。分析交集靶点KEGG通路富集得到P<0.05通路共33条,其中胰岛素抵抗通路P值最小,富集靶点最多,分别为Akt,PPARA,TNF-α,GSK3B,PTP1B,INSR,CPT1A,LXR-α,提示红花最有可能通过调节胰岛素抵抗通路治疗NAFLD。其中,Akt磷酸化减少,可以降低下游葡萄糖转运蛋白4(GLUT4)表达,抑制葡萄糖的跨膜转运,增加胰岛素抵抗[7]。PPARA能有效诱导脂肪酸摄取、细胞内脂肪酸活化与结合、脂肪酸延伸和去饱和、三酰甘油(TG)和脂滴的形成与分解等多种脂质代谢途径的基因表达[8]。TNF-α是胰岛素抵抗调节过程中的重要因子,加快脂肪细胞分解,释放大量游离脂肪酸(FFA)的同时抑制脂质转运,导致肝脏脂质积累,从而诱发NAFLD。TNF-α促进释放的FFA可以介导胰岛素抵抗,反之胰岛素抵抗与NAFLD的发生发展会导致FFA的升高,而FFA又可促使TNF-α升高,从而加重胰岛素抵抗和NAFLD[9]。GSK3B是P13K/AKT通路的一个主要基质,胰岛素刺激的AKT磷酸化GSK3B丝氨酸,从而使GSK3B失活,而GSK3B活性降低导致糖原合成酶磷酸化水平降低,从而导致糖原合成酶活性升高,糖原合成增加[10]。PTP1B在胰岛素抵抗(IR)发生时表达显著升高,通过作用于胰岛素受体及其底物,减弱或终止胰岛素信号传导,产生IR[11]。CPT1A对脂肪细胞中的游离脂肪酸诱导的IR起保护作用,且可以抑制JNK因子从而阻断游离脂肪酸引起的IR效应及炎症反应。同时CPT1A表达增加可显著降低TG的含量[12-13]。LXR-α可以激活脂肪细胞生成大量超过体内代谢能力的脂肪酸,导致脂肪堆积于肝脏引起肝细胞脂肪变性[14]。
西医学研究认为IR、氧化应激及脂质过氧化可能是NAFLD发病过程中的重要环节。“二次打击”学说认为IR是引起肝细胞脂质积累并诱导机体对内源性损害因子敏感性增加从而导致NAFLD的第一次打击[15]。因此IR是NAFLD的主要致病机制,是脂肪变性向脂肪性肝炎、肝硬化发展的触发因素并贯穿该病全过程[16]。它减弱胰岛素对脂肪代谢的调节,脂肪组织分解加强,促进游离脂肪酸在肝细胞内的沉积,导致肝细胞线粒体氧化超载,加重脂肪变性[17]。此外,增多的游离脂肪酸通过抑制胰岛素信号传导,减少胰岛素清除,从而加重IR[18]。基于红花对IR通路的调节作用及IR通路在NAFLD发病机制中的重要作用,提示了红花治疗NAFLD的可能性。
4 结论研究通过网络药理学研究策略对红花进行化学成分数据库构建、靶点预测,为红花的进一步研究提供了更多可能性。构建了红花成分-靶点-信号通路图,展示了红花治疗NAFLD具有多成分、多靶点、多信号通路的特点。分析了GO生物过程和KEGG通路富集,提示红花治疗NAFLD的作用可能与胰岛素抵抗相关。对全面、深入探索红花治疗NAFLD的可能性具有重要的参考意义。研究仅是借用网络药理学的方法对红花治疗NAFLD进行了数据库的分析研究,其研究结果仍需要进一步的实验验证。
| [1] |
RUSSO G I, CIMINO S, CASTELLI T, et al. Benign prostatic hyperplasia, metabolic syndrome and non-alcoholic fatty liver disease:is metaflammation the link?[J]. Prostate, 2016, 76(16): 1528-1535. DOI:10.1002/pros.23237 |
| [2] |
FORBES S, TAYLOR-ROBINSON S D, PATEL N, et al. Increased prevalence of non-alcoholic fatty liver disease in European women with a history of gestational diabetes[J]. Diabetologia, 2011, 54(3): 641-647. DOI:10.1007/s00125-010-2009-0 |
| [3] |
FARRELL G C, WONG W S, CHITTURI S. NAFLD in Asia-as common and important as in the West[J]. Nature Reviews Gastroenterology&Hepatology, 2013, 10(5): 307-318. |
| [4] |
SAROSIEKJEZNACH-STEINHAGEN A, OSTROWSKA J, CZER-WONOGRODZKA-SENCZYNA A, et al. Non-alcoholic liver disease-diagnosis and treatment][J]. Polski Merkuriusz Lekarski Organ Polskiego Towarzystwa Lekarskiego, 2017, 43(257): 237-242. |
| [5] |
高茜, 赵磊磊, 黄燕涛. 红花注射液联合辛伐他汀治疗高脂血症的临床观察[J]. 中药药理与临床, 2016, 32(6): 220-222. GAO Q, ZHAO L L, HUANG Y T. Clinical efficacy of Safflower Injection combined with simvastatin in the treatment of hyperlipidemia[J]. Pharmacology and Clinics of Chinese Materia Medica, 2016, 32(6): 220-222. |
| [6] |
成龙, 梁日欣, 杨滨, 等. 红花提取物对高脂血症大鼠降脂和抗氧化的实验研究[J]. 中国实验方剂学杂志, 2006, 12(9): 25-27. CHENG L, LIANG R X, YANG B, et al. Experimental study on regulation of lipid metabolism and antioxidation by extract of crthamus tinctorius in hyperlipidemia rat[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2006, 12(9): 25-27. DOI:10.3969/j.issn.1005-9903.2006.09.013 |
| [7] |
张韶君, 遆红燕, 郭亚莉, 等. 锌α2糖蛋白通过调节脂肪细胞自噬增强胰岛素信号通路表达的作用及机制研究[J]. 中国药物与临床, 2018, 18(12): 2120-2122. ZHANG S J, TI H Y, GUO Y L, et al. Effect of zinc α2 glycoprotein in enhancing expression of insulin signaling pathway by regulating autophagy of adipocytes and its mechnism[J]. Chinese Remedies&Clinics, 2018, 18(12): 2120-2122. |
| [8] |
程艳洁. PPARA诱导miR-181a2表达减轻自身过度激活引起的肝细胞毒性及miR-126-5p靶向GSK3B调节肝星形细胞上皮-间质转化[D].武汉: 华中农业大学, 2018: 3-5. CHENG Y J. Alleviation of hepatotoxicity caused by overactivation PPARA through PPARA-inducible miR-181a2 and regulation of epithelial-mesenchymal transition by miR-126-5p targeting GSK3B in hepatic stellate cells[D]. Wuhan: Huazhong Agricultural University, 2018: 3-5. http://cdmd.cnki.com.cn/Article/CDMD-10504-1018206896.htm |
| [9] |
巫翠玲.基于IKKβ/NF-κB通路探讨祛湿化痰逐瘀法抗非酒精性脂肪肝机制[D].厦门: 福建中医药大学, 2017: 28. WU C L. Discussing expelling damp, resolving phlegm and promoting blood circulation for nonalcoholic fatty liver disease based on IKKβ/NF-κB signaling[D]. Xiamen: Fujian University of Traditional Chinese Medicine, 2017: 28. http://cdmd.cnki.com.cn/Article/CDMD-10393-1017086041.htm |
| [10] |
GE D, Dauchy R T, LIU S, et al. Insulin and IGF1 enhance IL-17-induced chemokine expression through a GSK3B-dependent mechanism:a new target for melatonin's anti-inflammatory action[J]. Journal of Pineal Research, 2013, 55(4): 377-387. |
| [11] |
廖向彬, 李常青, 李小翚, 等. 荔枝核有效部位群改善3T3-L1脂肪细胞胰岛素抵抗作用及机制[J]. 中药材, 2014, 37(7): 1247-1250. LIAO X B, LI C Q, LI X H, et al. The effective site group of litchi kernel improved the insulin resistance of 3t3-l1 fat cells and its mechanism[J]. Journal of Chinese Medicinal Materials, 2014, 37(7): 1247-1250. |
| [12] |
李佳, 白振忠, 格日力. PTEN、CPT1A、COX4在高原鼠兔脂代谢相关组织中的表达和意义[J]. 中国高原医学与生物学杂志, 2018, 39(2): 79-82, 88. LI J, BAI Z Z, GE R L. The expression and significance of PTEN, CPT1A and COX4 in lipid metabolism related tissues of plateau pika[J]. Chinese High Altitude Medicine and Biology, 2018, 39(2): 79-82, 88. |
| [13] |
GAO X, LI K, HUI X, et al. Carnitine palmitoyltransferase 1A prevents fatty acid-induced adipocyte dysfunction through suppression of c-Jun N-terminal kinase[J]. Biochemical Journal, 2011, 435(3): 723-732. DOI:10.1042/BJ20101680 |
| [14] |
陈丽如, 张立平. 柴芪汤对非酒精性脂肪性肝病大鼠肝组织LXR-α蛋白表达的影响[J]. 中华中医药杂志, 2017, 32(8): 3443-3446. CHEN L R, ZHANG L P. Effects of Chaiqi Decoction on the protein expression of LXR-α in the liver tissue of non-alcoholic fatty liver disease rats[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(8): 3443-3446. |
| [15] |
苏剑锋, 江伟. "二次打击"对非酒精性脂肪肝的影响[J]. 华夏医学, 2015, 28(2): 141-144. SU J F, JIANG W. Impact of the"two hit theory"on nonalcoholic fatty liver disease[J]. Acta Medicinae Sinica, 2015, 28(2): 141-144. |
| [16] |
Oseini A M, Sanyal A J. Therapies in non-alcoholic steatohepatitis (NASH)[J]. Liver International, 2017(37): 97-103. |
| [17] |
喻茂文, 黄淑彬, 舒月, 等. 非酒精性脂肪肝患者血清25-羟维生素D水平与胰岛素抵抗的相关性分析[J]. 国际检验医学杂志, 2019, 40(14): 1699-1704, 1708. YU M W, HUANG S B, SHU Y, et al. Correlation between serum 25-hydroxy-vitamin D and insulin resistance in patients with nonalcoholic fatty liver disease[J]. International Journal of Laboratory Medicine, 2019, 40(14): 1699-1704, 1708. DOI:10.3969/j.issn.1673-4130.2019.14.009 |
| [18] |
VAN WAGNER L B, RINELLA M E. The role of insulin-sensitizing agents in the treatment of nonalcoholic steatohepatitis[J]. Therapeutic Advances in Gastroenterology, 2011, 4(4): 249-263. DOI:10.1177/1756283X11403809 |
 2020, Vol. 37
2020, Vol. 37