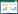文章信息
- 李希凡, 韩红梅, 王志强, 郑文超, 李天祥
- LI Xifan, HAN Hongmei, WANG Zhiqiang, ZHENG Wenchao, LI Tianxiang
- 5产区不同产地半夏主要化学组分含量测定及整体质量评价
- Evaluation of main chemical components and overall quality of Pinellia ternate from 5 production areas
- 天津中医药, 2020, 37(3): 332-337
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(3): 332-337
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.03.22
-
文章历史
- 收稿日期: 2019-10-28
2. 河北生之谷农业科技有限公司, 石家庄 050200
半夏为天南星科植物半夏[Pinellia ternate(Thunb.)Breit.]的干燥块茎。其味辛、温,有毒。归脾、胃、肺经。具有燥湿化痰,降逆止呕,消痞散结等功效。本品是中国传统的名贵中药材,至今有达两千多年的用药历史[1]。通过对常用588个中药处方分析可知,半夏出现频率位于第22位;在日本210个汉方中有半夏者46个,占22%;在300个常用痰嗽方中用半夏者有142个,约占46%,半夏为最广泛应用的30种中药之一[2]。西医学研究表明,半夏主要含有机酸、生物碱、半夏蛋白、挥发油、氨基酸、多糖和无机元素等化学成分,其中有机酸为半夏祛痰止咳成分,生物碱类具有镇吐效果,多糖类有扶正祛邪、增强免疫力的作用[3-5]。2015版《中华人民共和国药典》以琥珀酸作为指标成分,但中药以多成分、多靶点、多层次发挥治疗作用。因此,本研究基于半夏的药效物质基础,以总浸出物、多糖类、有机酸、生物碱为考察指标,采用多组分对半夏进行整体质量评价,来全面反映不同产地以及野生与栽培半夏整体质量特征,为其临床运用提供参考。
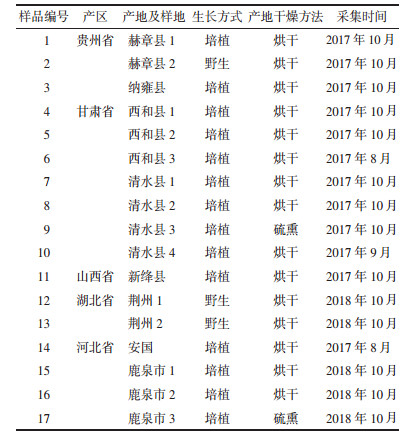
1 材料、仪器与试剂 1.1 药材来源为了客观反映不同产地半夏药材,对不同产区的主要产地,收集多个样地的样品。药材来源于5个产区17个产地及样地,样品去除泥沙与杂质,干燥,粉碎,过4号筛,备用。样品信息见表 1(栽培年限为1年)。
|
自动电位滴定仪(上海禾工科学仪器有限公司),紫外可见光分光光度计(上海美普达有限公司),远红外快速干燥箱(上海贺德实验设备有限公司),电子天平(上海舜宇恒平科技仪器有限公司),二列四孔智能水浴锅(河南省巩义市仪器有限责任公司),调温电热套(山东省鄄城永兴仪器厂),超声波清洗器(宁波新芝生物科技股份有限公司),旋转蒸发仪(郑州长城科工贸有限公司),循环水式多用真空泵(同上),无油空气泵(天津市津分分析仪器制造有限公司),移液枪(赛默飞世尔科技有限公司)。
1.3 试剂硫酸(分析纯,天津市化学试剂五厂),蒽酮(分析纯,上海科丰化学试剂有限公司),无水乙醇(分析纯,天津市富宇精细化工有限公司),娃哈哈纯净水(天津娃哈哈宏振饮料有限公司),正丁醇(分析纯,天津市江天化工技术有限公司),氯仿(分析纯,同上),甲醇(色谱纯,天津市科密欧化学试剂有限公司),乙腈(色谱纯,天津市康科德科技有限公司),氢氧化钠标准滴定液(浓度:0.1015 mol/L,GB/T601-2016,同上)、盐酸标准滴定液(浓度:0.1026 mol/L,GB/T601-2016,同上)。标准品:无水葡萄糖(批号:MUST-11020603,北京鼎国昌盛技术有限公司)、盐酸麻黄碱(批号:171241-201508,中国食品药品检定研究院)。
2 方法 2.1 总有机酸含量的测定 2.1.1 供试品溶液的制备精密称定半夏粉末约5 g,置锥形瓶中,加乙醇50 mL,加热回流1 h,同上操作,再重复提取2次,放冷,滤过,合并滤液,蒸干,残渣精密加入氢氧化钠滴定液(0.1 mol/L)10 mL,超声处理(功率500 W、频率40 kHz)30 min,转移至50 mL量瓶中,加新沸过的冷水至刻度,摇匀,即得。
2.1.2 测定方法精密量取25 mL供试品溶液,照电位滴定法(2015版《中华人民共和国药典》四部通则0701)测定,用盐酸滴定液(0.1 mol/L)滴定,并将滴定的结果用空白实验校正。每1 mL氢氧化钠滴定液(0.1 mol/L)相当于5.904 mg的琥珀酸(C4H4O4)。
滴定终点确定:自动电位滴定仪根据实验得到的电位E值和滴定体积V值绘制一级微商ΔE/ΔV曲线,曲线峰值对应的体积即为滴定终点。
2.1.3 样品含量测定取半夏样品按“2.1.1”项下方法制备样品,按“2.1.2”项下方法进行测定,计算半夏有机酸的含量,重复3次,结果取算术平均值。
2.2 总生物碱和多糖含量的测定 2.2.1 供试品溶液的制备总生物碱精密称定半夏样品粉末约0.25 g,置50 mL锥形瓶中,加浓氨水0.5 mL,湿润后,加氯仿10 mL,称定质量。冷浸3 h后超声提取1 h,加氯仿补质量,过滤,残渣以氯仿10 mL分3次洗涤,合并滤液与洗液,60 ℃以下旋转蒸发回收氯仿至干。加入氯仿8.0 mL溶解并转移至分液漏斗中,依次加入0.1 mol/L柠檬酸-柠檬酸钠缓冲液10 mL和溴麝香草酚蓝标准液1.0 mL,充分振摇,静置20 min,分取氯仿层,水层再用氯仿同法萃取2次,每次8 mL。合并氯仿层,用氯仿定容于25 mL量瓶中,即得总生物碱供试品溶液。
溴麝香草酚蓝标准液配制方法:取0.1 g溴麝香草酚蓝,精密称定,溶于50%乙醇,定容至100 mL容量瓶即得。
多糖[6-8]精密称定半夏药材干燥粉末0.5 g,置于150 mL圆底烧瓶中,加入95%乙醇50 mL,水浴回流2次,每次0.5 h,过滤,弃去两次滤液,回收滤渣,滤渣加蒸馏水50 mL,回流2次,每次1 h,过滤,合并两次滤液,活性炭脱色后转移定容至100 mL容量瓶中,取0.4 mL溶液稀释至10 mL容量瓶中,取2 mL加入至25 mL具塞试管中,冰水浴中缓慢滴入5 mL质量分数0.2%的硫酸蒽酮,摇匀,置于沸水浴中10 min,取出,冰水浴冷却后即得多糖供试品溶液。
2.2.2 对照品溶液的制备取盐酸麻黄碱对照品约4.0 mg,精密称定,置25 mL量瓶中,加蒸馏水溶解并稀释至刻度,摇匀,即得盐酸麻黄碱浓度为0.16 mg/mL的对照品溶液。
取无水葡萄糖标准品精密称定1.7 mg,加入蒸馏水定容至25 mL容量瓶中,即得浓度为0.68 mg/mL葡萄糖对照品溶液。
2.2.3 检测条件取总生物碱、多糖供试品溶液于紫外413、625 nm波长处测定吸光度,并根据吸光度计算总生物碱及多糖含量。
2.2.4 方法学考察线性关系考察分别精密吸取1.5、1.8、2.1、2.4、2.7、3.0、3.3、3.5 mL的盐酸麻黄碱对照品溶液至分液漏斗中,加蒸馏水至2.0 mL,加氯仿8.0 mL,再依次加入柠檬酸-柠檬酸钠缓冲液10 mL和溴麝香草酚蓝标准液1.0 mL,充分振摇,静置15 min,分取氯仿层,水层再用氯仿同法萃取2次,每次8 mL。合并氯仿层,用氯仿定容于25 mL量瓶中,即得。以相应的试剂同法制作空白。在波长413 nm处测定吸光度。绘制标准曲线,得线性回归方程:Y=4.349 4X-0.360 5,R2=0.999 3,表明盐酸麻黄碱含量在0.120 0~0.280 0 mg范围内线性关系良好。
分别精密取对照品溶液0.05、0.15、0.30、0.45、0.60、0.75、0.90、1.00、1.10 mL,蒸馏水定容至10 mL,配制成浓度为0.003 4、0.010 2、0.020 4、0.030 6、0.040 8、0.051 0、0.061 2、0.068 0、0.074 8 mg/mL的葡萄糖系列对照品溶液。在“2.2.3”项方法下分别测定吸光度,以吸光度(Y)对浓度(X)做曲线,得线性回归方程Y=10.89 3X-0.005 1,R2=0.999 8,表明葡萄糖浓度在0.003 4~0.074 8 mg/mL范围内线性关系良好。
2.2.5 重复性考察按“2.2.1”项下总生物碱和多糖供试品溶液的制备方法分别取同一样品各制备6份供试品溶液,按“2.2.3”项下检测条件测定吸光度,RSD值分别为2.86%和2.56%,表明重复性良好。
2.2.6 精密度考察精密量取总生物碱和多糖的对照品溶液,按“2.2.3”项下检测条件测定吸光度,分别连续测量6次,RSD值分别为0.069%和0.059%,表明仪器精密度良好。
2.2.7 稳定性考察取一样品,按“2.2.1”项下方法分别制备总生物碱和多糖的供试品溶液,按“2.2.3”项下检测条件于0、0.5、1、1.5、2、2.5 h测定吸光度,RSD值分别为0.14%和0.16%,表明样品至少在2.5 h内稳定性良好。
2.2.8 加标回收率考察精密称量已知总生物碱和多糖含量的样品粉末0.5 g,各6份,分别加入对照品适量,按“2.2.1”项下方法制备供试品溶液,测定吸光度,计算两者加标回收率。平均加标回收率分别为100%、98.8%,RSD分别为2.65%、3.87%。
2.2.9 样品含量的测定取半夏样品按“2.2.1”项制备样品,在“2.2.3”项方法下测定吸光度,按回归方程计算总生物碱和多糖含量,各重复3次,结果取算术平均值。
2.3 浸出物含量的测定 2.3.1 浸出物的制备方法取供试品约4 g,精密称定,置250 mL的锥形瓶中,精密加水100 mL,密塞,称定重量,静置1 h后,连接回流冷凝管,加热至沸腾,并保持微沸1 h。放冷后,取下锥形瓶,密塞,再称定重量,用水补足失重,摇匀,用干燥滤器滤过,精密量取滤液25 mL,置已干燥至恒重的蒸发皿中,在水浴上蒸干后,于105 ℃干燥3 h,置干燥器中冷却30 min,迅速精密称定重量。
2.3.2 样品含量测定取半夏样品按“2.3.1”项下方法制备样品,计算半夏浸出物的含量,重复3次,结果取算术平均值。
2.4 统计学方法运用SPSS 21.0软件进行统计学分析。主要是方差分析和主成分分析。
3 结果与分析 3.1 不同产地半夏各成分含量及方差分析见表 2。
|
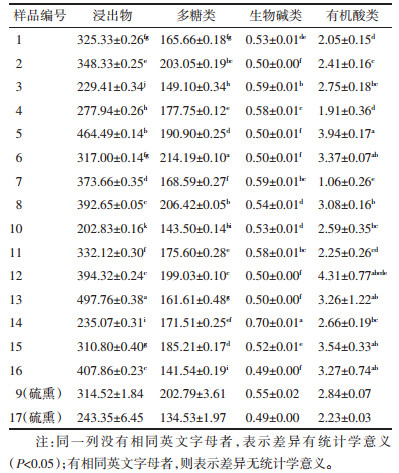
由表 2可知,不同产地半夏(除去硫熏的样品)各化学组分含量有较大差异。1)基于药典指标成分琥珀酸的含量(2.5 mg/g),12号湖北荆州样品含量最高,为4.31 mg/g;在15个样品中5个样品的含量低于药典限量标准,各产地样品琥珀酸的含量在1.06~4.31 mg/g之间,最高者是最低者约3倍以上,说明当前市场流通的半夏药材质量参差不齐,并存在一定量的不合格药材。2)基于生物碱类含量,约在0.49~0.70 mg/g之间,14号河北安国样品含量最高,为0.70 mg/g,但与其他产地相比,无显著性差异,各产地含量水平相当,波动不大。3)各产地的浸出物的含量差异较大,其中13号湖北荆州样品为497.76 mg/g,远高于其他产地样品含量,且具有显著性差异。4)各产地样品多糖类的含量差异较大,甘肃产区平均含量整体较高,最高者6号甘肃西和样品含量为214.19 mg/g。
3.2 不同产地半夏(无硫熏)各药效活性成分主成分分析主成分分析是利用降维思想,把多个指标转化成少数几个综合指标的一种统计学方法。其目的之一是在尽可能减少损失的基础上得到几个综合因子来代表原来众多变量。半夏是多组分的复合体,因此,采用主成分分析法对本实验中测定的4类化学成分进行评价,综合考察半夏药材的品质特征。
除去硫熏样品的干扰,将不同产地半夏化学组分数据进行标准化处理后,利用SPSS对表 2数据进行分析。SPSS分析结果显示,KMO=0.686,巴特利球性检验Sig值为0.000<0.05,数据适宜进行主成分分析。
主成分载荷的大小表明主成分能解释原始变量的程度,结合表 3中的数据可知:第一主成分与浸出物、生物碱、有机酸的相关性较强,基本能够代表半夏中此3种化学组分的综合水平,贡献率为53.33%;第二主成分主要与生物碱存在较强的相关性,贡献率为21.11%,因此这两个主成分基本反映了原始数据的大部分信息,可以体现半夏药效成分的整体水平。
以F1和F2的贡献率与两者累计贡献率的比值作为权数,并以F =0.716F1+0.284 F2求出综合得分值。由表 4、表 5结果可知,基于第一主成分和综合主成分得分:1)湖北荆州、甘肃西和半夏浸出物、生物碱、有机酸化学组分含量丰富,整体水平较高,说明湖北荆州和甘肃西和两地作为半夏优质产地具备一定的合理性。2)3个产地野生药材样品整体水平较高。将贵州省赫章县的野生和栽培样品进行比较,并结合湖北荆州2个野生样品,野生半夏的浸出物、多糖类、有机酸类含量均高于栽培半夏,生物碱类的含量略低于栽培半夏。说明野生品半夏各化学组分含量总体水平较高,野生品质优于栽培半夏。见表 6。
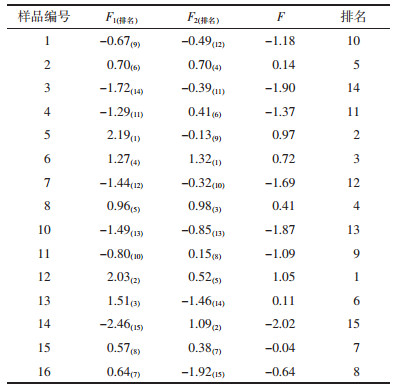
|
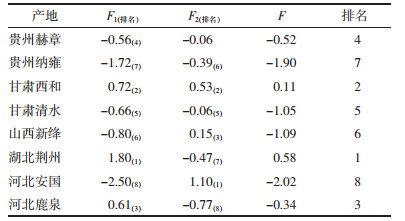
|
| mg/g | |||||||||||||||||||||||||||||
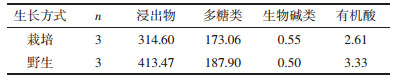
| |||||||||||||||||||||||||||||
基于半夏硫熏的加工方法,对比了同一产地甘肃清水县和河北鹿泉硫熏后的样品,结果显示,硫熏半夏浸出物、多糖类、有机酸类成分均下降,其中浸出物下降最多,两样品平均下降30%,有机酸也降低20%,生物碱类成分基本保持不变。可见,硫熏过程使半夏各活性成分含量下降,见表 7。
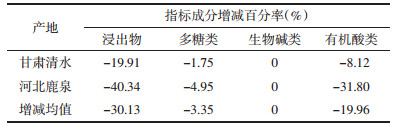
|
半夏为中国历史悠久的传统中药材,其道地产区和主产地出现过较大变迁。唐代以前,半夏以陕西一带所产为主,逐渐移至山东、江苏等地,而后以湖北、河南、山东一带为主产区,经历了一个由西到东,又由东至西的历史变迁过程。目前,半夏主要栽培于甘肃、湖北、贵州、山西、河北等地[9],文章通过对不同产地半夏样品各药效成分含量的测定和主成分分析,湖北荆州、甘肃西和半夏具有丰富的药效物质基础,其药材整体质量较高,两地作为半夏的优质产地是有一定道理的。这也与古代本草中“产湖北荆州为最”和相关文献中的描述相一致[10]。
4.2 半夏化学成分累积的影响因素优质药材的形成依赖于三大成因条件,即特定的生境(道地产区)、遗传因素(优良品种)、人为因素(栽培、采收、炮制加工技术)。湖北荆州和甘肃西和属于丘陵或山林地带,地势相对较陡峭,利于疏水,土壤类型以壤土为主,气候较温暖,年均气温相对较低,符合半夏喜阴的习性。通过调查发现,这两地的半夏种源相对较纯正,但通过实验发现,优质产地也有不合格品的存在,这可能是由于大田多年种植,产生连作障碍以及土壤微生物失衡的结果。半夏忌旱怕涝,适宜的栽培、采收与加工技术对高品质半夏的形成,至关重要,湖北荆州和甘肃西和作为半夏的主要产地,在生产技术上相对比较成熟,为优质药材的形成提供了坚定的基础。
4.3 野生半夏与栽培半夏目前,半夏以培植为主,本研究收集野生样品较少,但通过对野生与栽培半夏药效成分含量考察,发现野生半夏各药效成分含量均高于栽培品。这可能是因为野生半夏在自然环境下生长时间长而缓慢,次生代谢产物积累丰富,而栽培品半夏水肥条件优越,土壤营养充足,在整个生长过程中,生物量增加较快,块茎体积较大,次生代谢产物累积却相对较少。同时,观察野生与栽培半夏性状特征,发现野生半夏块茎较小,多数呈规则的类圆形,而栽培半夏块茎较大,且多侧生小块茎。因此,营养因素是造成栽培半夏品质低于野生半夏的主要原因之一,这与张绿明[11]的研究结果一致。
4.4 硫熏对半夏品质的影响硫熏是利用硫磺燃烧时产生的二氧化硫蒸制药材的加工方法,有利于药材的干燥和保存,同时二氧化硫的还原性可以保持半夏药材原有的色泽,有效抑制霉变和褐变反应。文章考察了硫熏对半夏药效成分的影响,实验结果表明硫熏会使半夏药材各活性成分减少,同时,过量的硫熏还会使砷、汞等元素进入药材中[12]。因此半夏的产地加工中不宜采用硫熏。
5 结论研究从不同产地采集样品,基于半夏3大功效成分及浸出物含量,全面而系统考察了不同产地半夏药材整体质量特征。湖北荆州、甘肃西和两地药材各化学组分总体水平较高,各产地药材质量参差不齐;半夏由野生变家种,品质降低;硫熏造成了半夏有效成分含量降低和二氧化硫的残留,影响临床疗效和用药安全。
| [1] |
李婷, 李敏, 贾君君, 等. 全国半夏资源及生产现状调查[J]. 现代中药研究与实践, 2009, 23(2): 11-13. LI T, LI M, JIA J J, et al. Survey of national resources and production status of Pinellia ternata in China[J]. Research and Practice of Chinese Medicines, 2009, 23(2): 11-13. |
| [2] |
楼之岑, 秦波. 常用中药材品种整理和质量研究[M]. 北京: 北京医科大学、中国协和医科大学联合出版社, 1995: 920. LOU Z C, QIN B. Study on the quality and variety arrangement of traditional Chinese medicine[M]. Beijing: Peking University Medical, China Union Medical University Press, 1995: 920. |
| [3] |
杨冰月, 李敏, 敬勇, 等. 半夏及其炮制品化学成分及功效的差异研究[J]. 中草药, 2018, 49(18): 4349-4355. YANG B Y, LI M, JING Y, et al. Difference of chemical constituents and efficacy between crude and processed Pinelliae Rhizoma[J]. Chinese Traditional and Herbal Drugs, 2018, 49(18): 4349-4355. DOI:10.7501/j.issn.0253-2670.2018.18.020 |
| [4] |
胡文斌, 王瀚, 张少飞, 等. 半夏的化学成分及其药性、毒性研究进展[J]. 中国资源综合利用, 2016, 34(10): 57-59. HU W B, WANG H, ZHANG S F, et al. Research progress of chemical composition, medicinal properties and toxicity of Pinellia[J]. China Resources Comprehensive Utilization, 2016, 34(10): 57-59. DOI:10.3969/j.issn.1008-9500.2016.10.027 |
| [5] |
李坤, 李明花, 秦文杰, 等. 基于高效液相指纹图谱及聚类分析对不同产地半夏质量评价研究[J]. 中南药学, 2018, 16(12): 1750-1754. LI K, LI M H, QIN W J, et al. Quality evaluation and cluster analysis of Pinellia ternata from different origins based on HPLC fingerprints[J]. Central South Pharmacy, 2018, 16(12): 1750-1754. |
| [6] |
刘玲, 周立, 师健友, 等. 黔半夏多糖含量测定[J]. 贵阳中医学院学报, 2009, 31(5): 81-82. LIU L, ZHOU L, SHI J Y, et al. Determination of polysaccharide content of Pinellia ternate in Guizhou[J]. Journal of Guiyang College of Traditional Chinese Medicine, 2009, 31(5): 81-82. |
| [7] |
张绿明, 卢先明, 兰志琼, 等. 不同采收时间半夏浸出物及粗多糖的含量测定[J]. 成都中医药大学学报, 2009, 32(2): 72-74. ZHANG L M, LU X M, LAN Z Q, et al. Contents of water-solwble extract and polysaccharide in pinellia ternata derived from different harvesst time[J]. Journal of Chengdu University of Traditional Chinese Medicine, 2009, 32(2): 72-74. |
| [8] |
王雪媛, 肖波, 张治峰, 等. 不同采收期肉苁蓉中松果菊苷、毛蕊花糖苷、半乳糖醇、甜菜碱及可溶性多糖量的测定及其道地性研究[J]. 中草药, 2017, 48(18): 3841-3846. WANG X Y, XIAO B, ZHANG Z F, et al. Study on five efficacy components, geoherbalism of Cistanche deserticola from genuine producing area in different collecting seasons[J]. Chinese Traditional and Herbal Drugs, 2017, 48(18): 3841-3846. DOI:10.7501/j.issn.0253-2670.2017.18.027 |
| [9] |
石青, 赵宝林. 半夏的本草考证[J]. 陕西中医学院学报, 2013, 36(2): 90-92. SHI Q, ZHAO B L. Herbal textual of Pinellia Tuber[J]. Journal of Shaanxi College of Traditional Chinese Medicine, 2013, 36(2): 90-92. |
| [10] |
陈仁山. 药物出产辨[M]. 北京: 新医药出版社, 1930. CHEN R S. Identification of drug production[M]. Beijing: New Medicine Press, 1930. |
| [11] |
张绿明.半夏栽培实验及野生半夏与栽培半夏的对比研究[D].成都: 成都中医药大学, 2009. ZHANG L M. Research on the Pinellia Tuber cultivation and the comparison between the wild Pinellia Tuber and the cultivated Pinellia Tuber[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10633-2010077601.htm |
| [12] |
蒋以号, 刘伟, 曹晖, 等. 中药硫磺薰蒸研究概况[J]. 中国医药指南, 2010, 8(33): 38-40. JIANG Y H, LIU W, CAO H, et al. A survey of sulfur fumigation of traditional Chinese medicine[J]. Guide of China Medicine, 2010, 8(33): 38-40. DOI:10.3969/j.issn.1671-8194.2010.33.020 |
2. Hebei Shengzhigu Agricultural Technology Co. Ltd., Shijiazhuang 050200, China
 2020, Vol. 37
2020, Vol. 37