文章信息
- 李韵歆, 汤轶波, 郑燕飞, 李月, 于雪, 张巧慧, 陈亚飞, 白雪, 马茹, 刘振权
- LI Yunxin, TANG Yibo, ZHENG Yanfei, LI Yue, YU Xue, ZHANG Qiaohui, CHEN Yafei, BAI Xue, MA Ru, LIU Zhenquan
- 从PI3K/Akt和MAPK/Erk信号通路探讨复方当归注射液对拟缺血神经元的作用
- Exploration of the mechanism of Compound Angelica Injection on mimicischemic neurons from PI3K/Akt and MAPK/Erk signal pathways
- 天津中医药, 2020, 37(4): 442-449
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(4): 442-449
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.04.20
-
文章历史
- 收稿日期: 2019-11-30
2. 北京中医药大学中药学院, 北京 100029
脑血管疾病是中老年人的常见病之一, 占死因构成率20%以上, 为中国三大高病死率疾病[1]。脑血管疾病以中风为主, 其中缺血性中风占中风患者总发病数量的70%, 且发病率呈持续上升趋势[2], 在临床上急性治疗以及后续患者恢复均是医学一大难题。缺血性中风病理机制复杂, 中枢神经系统(CNS)各组织、细胞均发生一系列复杂的缺血损伤反应, 至今尚未完全研究彻底, 神经血管单元的提出为缺血性中风治疗机制研究提供了新靶点, 它让中风的研究不仅仅着眼于单一的某细胞, 而更全面地考虑到在生理、病理的条件下, 细胞与细胞之间以及细胞与胞外环境之间复杂的相互作用, 更注重整体观[3]。大脑微血管内皮细胞(BMECs)是组成中枢神经系统的第一道防线血脑屏障(BBB)的关键细胞。在神经血管单元整体微环境中, 内皮细胞通过其紧密连接及潜在的分泌功能, 精密调节着脑部微环境[4]。当药物入血以后进入CNS, 首先接触到的就是内皮细胞, 故从细胞层面研究药物对缺血性中风的作用机制时, 除观测神经元外, 更不能忽略内皮细胞的存在。
中药活血通络方药常对中风具有较好的疗效[5], 课题组前期实验发现由当归、川芎、红花3味活血中药组成的复方当归注射液(CAI)对大脑中动脉栓塞(MCAO)模型大鼠具有保护作用[6]。它在后续的离体实验研究进一步发现CAI可明显抑制BMECs因拟缺血损伤引起的炎症因子肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)含量增加, 显著下调丙二醛(MDA)含量, 具有抗炎、抗氧化的作用[7]。现已有研究证实拟缺血内皮细胞条件液对可降低正常神经元活性, 并能进一步加重已受损神经元[8], 可见内皮的状态会影响神经元。本实验在考虑内皮细胞与神经元之间联系的基础上用BMECs条件液作用于神经元, 这样更接近于离体的共培养体系并符合实际情况, 并用氧糖剥夺法(OGD)模拟缺血性中风发生时内皮细胞和神经元缺血性损伤的多种生理病理过程, 制备BMECs及神经元拟缺血损伤离体模型, 从磷脂酰肌醇-3激酶(PI3K)/丝氨酸/苏氨酸激酶(Akt)、丝裂原活化蛋白激酶(MAPK)/细胞外信号调节激酶(Erk)信号通路为切入点, 探究CAI通过BMECs干预神经元拟缺血损伤的可能机制。
1 材料与方法 1.1 实验动物SPF级雄性SD大鼠7 d龄6只, 体质量(20±5) g; SPF级雄性SD乳鼠1 d龄10只, 均购于北京维通利华实验动物公司, 许可证号:SC-XK(京)2016-0006。
1.2 药品与试剂CAI购于福建古田药业有限公司, 生产批号:1710102;胎牛血清、DMEM/F-12培养基干粉、双抗购于美国Gibco公司; 明胶、胰蛋白酶、乙二胺四乙酸(EDTA)、胶原酶购于美国Sigma公司; 氯化钠(NaCl)、氯化钾(KCl)、磷酸二氢钾(KH2PO4)、碳酸氢钠(NaHCO3)、十二水磷酸氢二钠(Na2HPO4·12H2O)、氯化钙(CaCl2)、氯化镁(MgCl2)购于国药集团化学试剂有限公司; 胰岛素注射液购于江苏万邦生化医药股份有限公司, 生产批号:4349503;肝素注射液购自常州千红生化制药股份有限公司, 生产批号:1516110294;内皮细胞生长因子(ECGS)购自北京中科迈晨科技有限公司; L-多聚赖氨酸购于北京博奥拓达公司; NEUROBASAL、B-27、GLUTAMAX均购于美国invitrogen公司; CD31相关抗体购于英国Abcam公司; CCK8试剂盒购于日本同仁化学研究所; RIPA裂解液、5×蛋白上样缓冲液、一抗稀释液、分离胶缓冲液、浓缩胶缓冲液、通用显影液、酸性定影液购于北京普利莱基因技术有限公司; 磷酸酶抑制剂混合物购于江苏凯基生物技术股份有限公司; 脱脂奶粉购于美国BD公司; 4', 6-二脒基-2-苯基吲哚二盐酸盐(DAPI)、过硫酸铵(APS)、四甲基乙二胺(TEMED)购于美国AMERSCO公司; 10×TBST、10×电泳转移缓冲液、膜再生液、5×Tris-甘氨酸电泳缓冲液购于中国solaibio公司; ECL发光液、PVDF膜购于美国millipore公司; 神经元特异性烯醇化酶(NSE)多克隆抗体、异硫氰酸荧光素(FITC)荧光标记抗兔IgG、兔GAPDH单克隆抗体购于proteintech公司; 兔抗大鼠Akt(C67E7)、磷酸化Akt(p-Akt)(Ser473)、Erk1/2(137F5)、磷酸化Erk(p-Erk)(Thr202/Tyr204)抗体购于美国CST公司; FITC荧光标记抗小鼠IgG、辣根过氧化物酶(HRP)标记山羊抗小鼠IgG、山羊抗兔IgG购于北京中杉金桥生物技术有限公司。
1.3 脑微血管内皮细胞的分离培养取7 d龄雄性SD大鼠, 冰上断头处死, 置于预冷的75%乙醇浸泡3~5 min, 无菌条件下沿大鼠脑正中线剪开颅骨, 剔除硬脑膜, 取出两侧大脑半球, 用预冷的D-Hank's液(NaCl 8 g, KCl 0.4 g, KH2PO4 0.06 g, NaHCO3 0.35 g, Na2HPO4·12H2O 0.134 g/1 000 mL蒸馏水)漂洗2次, 在含有胎牛血清的内皮细胞冲洗液中仔细剔除软脑膜、大血管以及大脑髓质部分, 收集大脑皮质, 剪碎至1 mm3后匀浆。然后依次通过200 μm和76 μm滤网过滤, 收集76 μm滤网上的微血管段, 1 000 r/min, 离心半径15.8 cm, 离心5 min。弃上清, 加入0.2%Ⅱ型胶原酶溶液37℃消化20 min, 1 000 r/min, 离心半径15.8 cm, 离心5 min。将下层沉淀用内皮细胞冲洗液漂洗离心2次。所得沉淀用配制的内皮细胞培养液悬浮后, 接种于明胶覆盖的25 cm2培养瓶中, 37℃, 5%的CO2培养箱培养, 2~3 d后第1次换液, 7~8 d细胞生长成致密单层, 出现"铺路石"征象后可进行传代培养, 以第3代细胞用于实验。
1.4 免疫荧光鉴定脑微血管内皮细胞将原培养液延边缘轻柔吸去, 加入预热至37℃的磷酸缓冲盐溶液(PBS)漂洗3次, 5 min/次; 4%的多聚甲醛室温固定20 min; 吸去多聚甲醛固定液, PBS洗3遍, 10 min/次; 加入0.2%的Triton X100透化5 min; PBS洗3遍, 5 min/次; 37℃ 5%山羊血清封闭45 min; 去除封闭液, 滴加CD31相关抗原(1:100)湿盒内4℃ 2 h; 复温1 h后, 用PBS冲洗3次, 加入二抗(1:400), 4℃过夜孵育; PBS洗3遍, 5 min/次; 加入DAPI避光孵育5~10 min; PBS洗3遍, 5 min/次; 荧光显微镜取随机视野观察并拍照。
1.5 BMECs拟缺血损伤模型与条件培养液的制备将第3代BMECs调整细胞密度为5×104~1×105/mL, 接种于细胞培养器中, 置培养箱中继续培养, 24 h后细胞出现"铺路石"征象后, 分为5组:正常组、模型组、药物低、中、高剂量组(浓度分别为1.25、2.5、5 μL/mL CAI)。正常组、模型组不行任何处理; CAI低、中、高剂量组分别给予含各浓度CAI的内皮完全培养液并放置在37℃含5%CO2恒温培养箱中培养12 h。经过12 h药物处理后, 将各组原培养液吸出, 用D-Hank's溶液轻轻洗涤2遍, 正常组换完全培养液, 模型组与给药组给予无糖kreb's溶液及含不同浓度CAI的kreb's溶液, 并在含1%O2、5%CO2、94%N2的恒温三气培养箱中培养6 h。造模结束后收集各组条件培养液:正常条件培养液(N-CM)、模型条件培养液(I-CM)、CAI低、中、高剂量干预后条件培养液(IC-CML、IC-CMM、IC-CMH)。
1.6 大鼠皮层神经元的原代培养将出生24 h内的新生鼠于-20℃预冻20 min左右取出, 浸泡于75% 4℃预冷的乙醇中, 浸泡消毒。无菌条件下, 先沿后囟门剪开皮肤, 再沿大鼠脑正中线剪开颅骨, 小心剥除硬脑膜和血管, 取出两侧大脑半球放于D-Hank's液的玻璃平皿中冲洗。随后在冰盘上用眼科弯镊剥离大血管及大脑髓质, 最终收集大脑皮质于装有D-Hank's液的小烧杯中, 用眼科剪剪成大小约1 mm3的小块后, 移入15 mL的离心管。用浓度为0.125%胰酶, 37℃恒温箱消化20 min。用含10%胎牛血清的维持液终止消化后弃上清。加入神经元接种液重悬, 用吸管轻轻反复吹打成均匀的细胞悬液。用74 μm滤网过滤, 收集滤液, 调整细胞密度为1×106/mL, 接种于已用L-多聚赖氨酸包被的孔板中纯化培养24 h后, 将培养液更换为无血清的神经元维持培养液(97%NEUROBASAL+2%B-27+l% GLUTAMAX), 以后每2~3 d半量换液, 实验用培养7~9 d左右的细胞。
1.7 免疫荧光鉴定神经元荧光鉴定操作方法同内皮细胞, 采用NSE多克隆抗体(1:200)湿盒内常温2 h孵育。
1.8 神经元分组、BMECs条件液干预并建立拟缺血损伤模型将原培养液吸出, 用D-Hank's溶液轻轻洗涤2遍后分为N-CM处理组、I-CM处理组及给各IC-CM处理组。N-CM作用于正常神经元(在原培养箱中培养6 h); I-CM、IC-CML、IC-CMM、IC-CMH作用于各组拟缺血损伤神经元(在含1%O2、5%CO2、94%N2的恒温三气培养箱中培养6 h)。
1.9 观察指标 1.9.1 神经元存活率测定采用CCK8方法检测:吸弃96孔培养板中细胞上清液, 每孔加入NEURALBASAL 100 μL, CCK8溶液10 μL, 置37℃、5%CO2培养箱中孵育2 h。全自动酶标仪(选择λ=450 nm波长)测定各孔吸光度(A)值。
1.9.2 蛋白免疫印迹(Western Blot)法检测PI3K、MAPK信号通路磷酸化水平(p-Akt、Akt、p-Erk、Erk)造模后收集各组细胞并裂解提取蛋白, SDS聚丙烯酰胺凝胶电泳, PVDF膜转膜, 5%脱脂奶粉封闭, 然后分别加入一抗, 4℃过夜。次日以TBST洗膜后再加入HRP标记的二抗, 置室温1 h, ECL显色。以GAPDH作内参对照, Image J分析灰度值进行计算灰度系数比。
1.10 统计学处理采用SAS 9.2软件进行统计学分析和GraphPad Prism8作图, 计量资料釆用均数±标准差(
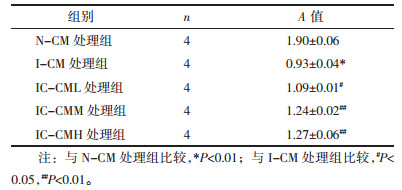
如图 1所示, 培养至第3代BMECs形态呈长梭型(1a, 200×), 通过免疫荧光染色检测, 其中绿色荧光代表CD31阳性细胞(1b, 400×), 蓝色荧光代表DAPI染色的细胞核(1c, 400×), 绿、蓝色重合代表CD31阳性内皮细胞(1d, 400×), 培养的内皮细胞纯度达95%以上, 可以用于后续实验。
|
| 图 1 大鼠BMECs形态及荧光鉴定 Fig. 1 Morphology and fluorescence identification of rats' brain microvascular endothelial cells |
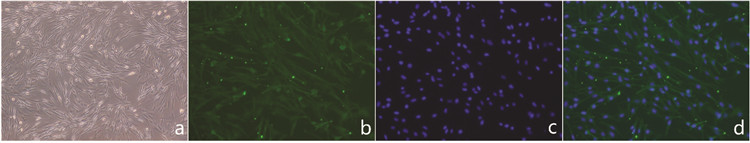
在倒置显微镜下观察, 见图 2, 接种后的皮层神经元24 h(图 2a, 400×)后基本全部贴壁, 形态呈圆形或卵圆形, 细胞数量多, 体积小; 接种后3 d(图 2b, 400×)的细胞间隙增大, 部分细胞有突起长出; 培养至5 d(图 2c, 400×), 神经元胞体变大, 相互交织成网, 基本铺满视野; 培养至7 d(图 2d, 400×), 视野下神经元形态清晰, 胞体透亮。
|
| 图 2 大鼠皮层神经元细胞形态 Fig. 2 Morphology of rats' cortical neurons |
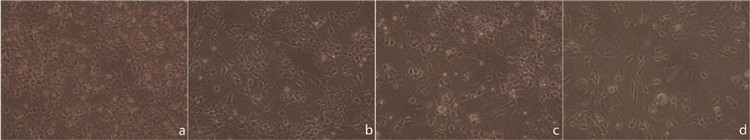
如图 3所示, 培养至7~9 d NSE鉴定, 其中绿色荧光代表NSE阳性细胞(图 3a, 400×), 蓝色荧光代表DAPI染色的细胞核(图 3b, 400×), 蓝、绿色重合代表NSE阳性神经元(图 3c, 400×), 免疫荧光显示其纯度达到后续实验要求。
|
| 图 3 神经元荧光鉴定 Fig. 3 Neuron fluorescence identification |
如表 1所示, I-CM处理后OGD造模神经元活性较N-CM处理组显著降低(P < 0.01)。所有剂量IC-CM处理的OGD造模神经元活性均高于I-CM处理组(P < 0.05或(P < 0.01), 其中IC-CMM、IC-CMH处理组神经元活性升高显著(P < 0.01)。
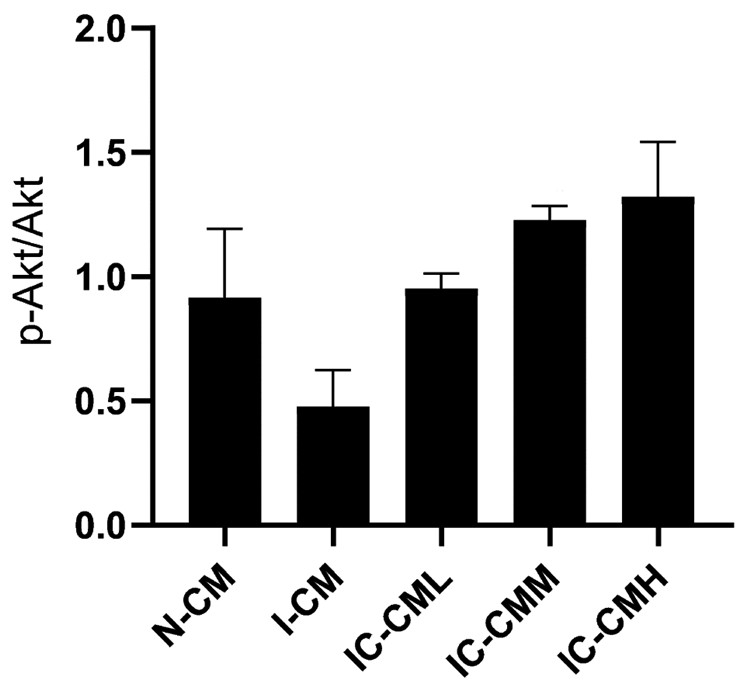
经统计各组Akt组间差异无统计学意义(P>0.05);I-CM处理组神经元p-Akt/Akt较N-CM处理组显著降低(P < 0.01), 相对于I-CM处理组, 各IC-CM处理组神经元p-Akt/Akt均显著升高(P < 0.05或P < 0.01), 并呈现一定剂量依赖性升高趋势。见图 4、5。

|
| 图 4 各组神经元Akt和p-Akt的表达 Fig. 4 Akt and p-Akt expression of neuron of each group |
|
图 5 各组神经元p-Akt/Akt比较(  |
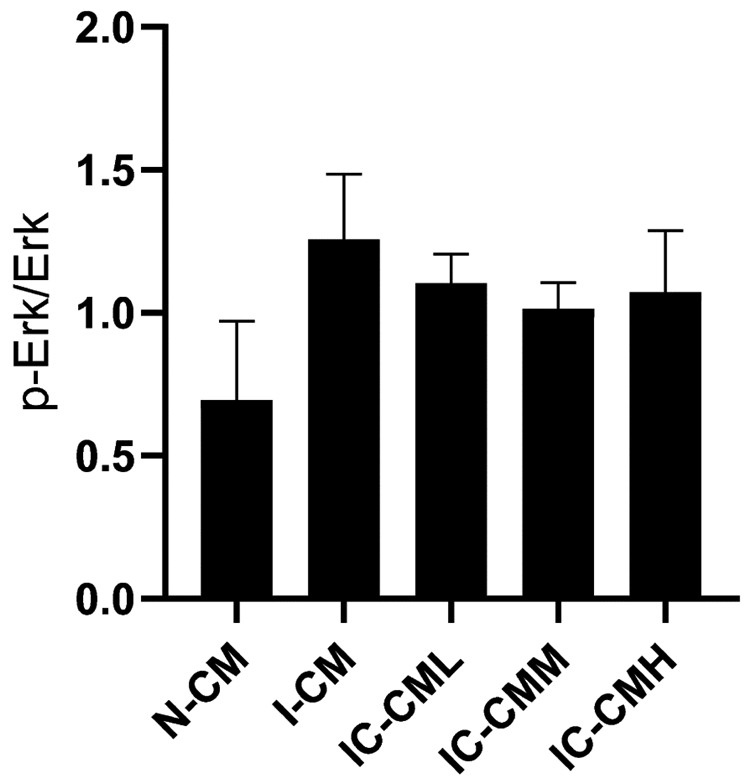
如下所示, 经统计各组Erk组间比较无统计学差异(P>0.05);I-CM处理组神经元p-Erk/Erk较N-CM处理组显著升高(P < 0.01), 但相对于I-CM处理组, 各IC-CM处理组神经元p-Erk/Erk差异无统计学意义(P>0.05), 但从均值比较可看出IC-CM各处理组较I-CM处理组有所降低, 并且在IC-CMM处理组最低。见图 6、7。

|
| 图 6 各组神经元Erk和p-Erk的表达 Fig. 6 Erk and p-Erk expression of neuron of each group |
|
图 7 各组神经元p-Erk/Erk比较(  |
神经元之间的电化学信号调节大脑的认知、新陈代谢和肢体协调等多方面, 早期研究报道, 脑缺血梗死灶中心的大多数凋亡细胞被鉴定为神经元[9], 因此靶向治疗并防止神经元凋亡是挽救缺血性中风后脑梗死面积的有效途径。现阶段在对缺血性中风的机制研究中对于神经元研究的角度丰富, 用OGD法造拟缺血损伤模型能很好模拟大脑实质中O2和营养物质的供应中断:Chen等[10]发现用白细胞介素-10(IL-10)处理培养的神经元OGD损伤后9~24 h, 可获得最佳的抗凋亡作用。Lin等[11]确定IL-10在20 ng/mL剂量时保护作用最好。Gaidin等[12]使神经元中的选择性脑源性神经营养因子(BDNF)过表达保护神经元免受OGD和谷氨酸诱导的兴奋性毒性。Zhang等[13]用miR-7a-2-3p能明显减少OGD神经元凋亡, 考虑与波形蛋白的调节有关。
另外维持大脑精确且平衡的微环境离不开BBB的作用, BBB能调节血液和脑腔之间的物质交换, 控制大脑所需的离子、O2和营养物质进入, 限制毒素和病原体的入侵保护CNS[14]。为了维持这种强大的屏障, BMECs通过高电压紧密连接(TJ)和相邻细胞的细胞骨架黏附连接形成血浆与脑之间的渗透屏障, 保证了BBB的功能[15]。BMECs在生理病理状态下与神经元关系密切, 可分泌BDNF帮助神经元迁移与分化[16]及血管内皮生长因子(VEGF)抗神经元凋亡、促进新生[17-19]。BMECs损伤后导致其分泌功能紊乱还会进一步导致神经元的损伤[20]。鉴于内皮细胞不容忽视的作用, 实验以内皮细胞条件培养液来探讨药物对神经元的干预, 兼顾考虑了内皮细胞的分泌作用, 内皮细胞与神经元的相互作用, 也更注重了整体性。
此次实验所用的CAI具有活血通络、祛瘀止痛的作用, 其中所含的川芎、当归和红花近年来被广泛应用于临床及实验研究, 当归、川芎中的有效成分多糖及挥发油以及红花中的黄酮类对脑损伤均有保护作用[21-25]。在1977年便曾有过首次用CAI尝试治疗脑动脉硬化, 也取得了一定的疗效[26]。在夹脊穴穴位注射治疗短暂性脑缺血发作患者中发现能降低血管内阻力, 增加脑灌注, 从而改善脑缺血及缺氧状态[27]。诸多的离体与在体实验也均证实了CAI对心脑血管疾病具有防治作用[28]。
本次实验结果显示通过CCK8活性检测可知道CAI干预后的内皮条件培养液对拟缺血神经元具有直接的保护作用。IC-CM处理组神经元的p-Akt/Akt较I-CM处理组明显升高; 并且, 对比I-CM处理组p-Erk/Erk明显升高, IC-CM各处理组p-Erk/Erk与I-CM处理组相比有所降低, 但无明显的差异。PI3K/Akt和MAPK/Erk在脑缺血研究中是两条经典的信号通路, 他们调节多种细胞功能:细胞生长、分裂、增殖、分化、凋亡和自噬。
大量研究证实PI3K/Akt信号通路对于神经元经历脑缺血损伤后的存活和抗凋亡至关重要:Jin等[29]通过康复训练发现激活PI3K/Akt信号通路从而抑制神经细胞凋亡可促进缺血性中风大鼠神经和运动功能的恢复; Fan等[30]发现激活PI3K/Akt信号通路抑制神经元凋亡是S-奥拉西坦减轻缺血性卒中的重要机制之一; 内源性大麻素通过包括PI3K/Akt在内的多种信号通路在预防缺血性中风和缺血耐受中发挥了重要作用[31]。当PI3K信号通路激活后, Akt的Thr308和Ser473位点被磷酸化, 进而激活多种凋亡途径相关蛋白[32], 例如:p-Akt使B淋巴细胞瘤-2(Bcl-2)相关死亡促进因子(Bad)磷酸化, 从而无法与使抗凋亡蛋白Bcl-2和B淋巴细胞瘤-XL(Bcl-XL)二聚化并使其失活来诱导细胞凋亡[32-33]、作用于含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-9使之灭活从而无法激活凋亡蛋白酶Caspase-3[34]、磷酸化P53从而增加P53的降解而增加细胞存活[35], 使叉头蛋白O1(FKHR)磷酸化并分布于细胞质, 从而阻止其在细胞核中的凋亡进程[32, 36]等。
与PI3K途径不同, Erk介导的细胞信号转导通路对于神经元存活的作用存在争议。细胞外调节蛋白激酶Erk是丝裂原活化蛋白激酶MAPK家族的主要成员之一, 包括Erk1和Erk2, 统称为Erk1/2[37], 现有的研究显示磷酸化Erk在缺血性中风中扮演着重要角色:缺血前3周的跑步机训练可以下调缺血诱导的磷酸化Erk1/2的增加并有效保护神经系统[38]; 抑制中风急性期Erk1/2激活可减少中风后2 d的梗塞面积和神经功能缺损[39]; 大脑中动脉阻塞7 d的大鼠p-Erk1/2有所降低[40]。这种在体实验的双向结果也体现在许多探讨Erk与缺氧神经元的关系中:Zhao等[41]研究发现缺氧6 h大鼠海马神经元细胞p-Erk下降; Jeong等[42]将神经元缺氧6、15 h后p-Erk上升; 王瑞等[43]缺氧培养神经元2 h后发现p-Erk下降; 司玮[44]缺氧1 h培养神经元发现p-Erk上升。有考虑一是缺氧缺血在持续时间与程度存在差异, 二是中度Erk磷酸化介导细胞保护, 而持续的、广泛的Erk磷酸化可能诱导细胞损伤[45], 如持续活化会增加神经元细胞的谷氨酸毒性[38]; 若激活c-Jun氨基末端激酶(JNK), 则继发磷酸化激活包括细胞应激和肿瘤坏死因子在内的多种凋亡因子而使兴奋性毒性神经元凋亡[46]; 磷酸化p38又可起到抗凋亡作用[47]; 还可同p-Akt一样使Bad磷酸化, 两条通路之间有共同活化靶点[31]。
本实验在考虑在体实际内皮细胞与神经元关系密切的基础上, 在细胞水平上通过OGD法对BMECs和神经元造成拟缺血损伤, 探究CAI对缺血性脑损伤离体模型的影响。结果证实CAI可通过干预拟缺血损伤内皮细胞进而干预拟缺血损伤神经元, 改善神经元存活, 且该保护作用可能与活化PI3K/Akt信号通路从而抑制神经元凋亡有一定相关性, 考虑存在上述PI3K/Akt信号通路介导的多条保护途径; 与MAPK/Erk信号通路的关联不大, 但考虑有神经元缺血缺氧程度因素, 此结论限定在此造模条件下, 不可一概而论。后续可研究通路下游蛋白、多个时间点进行猜想验证。
| [1] |
中华人民共和国国家统计局.中国统计年鉴[M].北京: 中国统计出版社, 2018. National Bureau of Statistics of People's Republic of China.China StatisticsPress[M]. Beijing: China Statistics Press, 2018. |
| [2] |
NICHOLAS J K, MEGHA A, RYAN M B. Global, regional, and national disability-adjusted life-years (DALYs) for 315diseases and injuries and healthy life expectancy (HALE), 1990-2015:a systematic analysis for the Global Burden of Disease Study 2015[J]. Lancet, 2016, 388(10053): 1603-1658. DOI:10.1016/S0140-6736(16)31460-X |
| [3] |
李韵歆, 刘振权, 李月, 等. 缺血性脑卒中神经血管单元的研究进展[J]. 中华老年心脑血管病杂志, 2019, 21(2): 217-220. LI Y X, LIU Z Q, LI Y, et al. Research progress of neurovascular unit in ischemic stroke[J]. Chinese Journal of Geriatric Heart Brain and Vessel Diseases, 2019, 21(2): 217-220. DOI:10.3969/j.issn.1009-0126.2019.02.029 |
| [4] |
ROSASHERNANDEZ H, CUEVAS E, LANTZ S M, et al. Isolation and culture of brain microvascular endothelial cells for in vitroblood-brain barrier studies[J]. Methods in Molecular Biology, 2018(1727): 315. |
| [5] |
陈慧亭, 崔应麟. 益气活血通络法在缺血性中风二级预防中的应用[J]. 中国民族民间医药, 2018, 27(11): 4-5. CHEN H T, CUI Y L. Application of Yiqi Huoxue Tongluo Method in secondary prevention of ischemic apoplexy[J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2018, 27(11): 4-5. |
| [6] |
汤轶波, 朱春燕, 袁伟畅, 等. 复方当归注射液对大鼠缺血性脑损伤模型的影响[J]. 中国中医药信息杂志, 2015, 22(2): 68-70. TANG Y B, ZHU C Y, YUAN W C, et al. Effects of Compound Angelica Injection on rats with cerebral ischemia injury[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2015, 22(2): 68-70. DOI:10.3969/j.issn.1005-5304.2015.02.019 |
| [7] |
赵玉青, 刘振权, 白雪, 等. 复方当归注射液对拟缺血损伤大鼠脑微血管内皮细胞的影响[J]. 中西医结合心脑血管病杂志, 2018, 16(8): 1015-1017. ZHAO Y Q, LIU Z Q, BAI X, et al. The influence of Compound Angelica Injection on the brain microvascular endothelial cells in rats with ischemic injury[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2018, 16(8): 1015-1017. |
| [8] |
李卫红, 青雪梅, 华茜, 等. 大鼠脑微血管内皮细胞条件培养液对皮层神经元活性的影响以及通络救脑注射液的干预作用[J]. 中华中医药杂志, 2006, 21(6): 334-337. LI W H, QING X M, HUA Q, et al. Influence of conditioned medium of rat brain microvascular endothelial Cells on activity of cortical neurons and protective effect of Tong Luo Jiu Nao Injection[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2006, 21(6): 334-337. |
| [9] |
LI Y, CHOPP M, JIANG N, et al. Temporal profile of in situ DNA fragmentation after transient middle cerebral artery occlusion in the rat[J]. Journal of Cerebral Blood Flow and Metabolism, 1995, 15(3): 389-397. DOI:10.1038/jcbfm.1995.49 |
| [10] |
CHEN H, LIN W, LIN P, et al. IL-10 produces a dual effect on OGD-induced neuronal apoptosis of cultured cortical neurons via the NF-κB pathway[J]. Aging, 2019, 11(23): 10796-10813. DOI:10.18632/aging.102411 |
| [11] |
LIN L, CHEN H, ZHANG Y, et al. IL-10 protects neurites in oxygen-glucose-deprived cortical neurons through the PI3K/Akt pathway[J]. PLOS ONE, 2015, 10(9): e0136959. DOI:10.1371/journal.pone.0136959 |
| [12] |
GAIDIN S G, TUROVSKAYA M V, GAVRISH M S, et al. The selective BDNF overexpression in neurons protects neuroglial networks against OGD and glutamate-induced excitotoxicity[J]. International Journal of Neuroscience, 2019(68): 1-25. |
| [13] |
ZHANG Z, TAN Y, ZHAO Q, et al. miRNA-7a-2-3p inhibits neuronal apoptosis in oxygen-glucose deprivation (OGD) model[J]. Frontiers in Neuroscience, 2019(13): 16. |
| [14] |
KEANEY J, CAMPBELL M. The dynamic blood-brain barrier[J]. FEBS Journal, 2015, 282(21): 4067-4079. DOI:10.1111/febs.13412 |
| [15] |
DANEMAN R, PRAT A. The blood-brain barrier[J]. Cold Spring Harbor perspectives in Biology, 2015, 7(1): a020412. DOI:10.1101/cshperspect.a020412 |
| [16] |
SNAPYAN M, LEMASSON M, SAGHATELAYN A. Vasculature guides migrating neuronal precursors in the adult mammalian forebrain[J]. International Journal of Developmental Neuroscience, 2008, 26(8): 1. |
| [17] |
JIN K, ZHU Y, SUN Y, et al. Vascular endothelial growth factor (VEGF) stimulates neurogenesis in vitro and in vivo[J]. Proceedings of the National Academy of Sciences, 2002, 99(18): 11946-11950. DOI:10.1073/pnas.182296499 |
| [18] |
JIN K, MAO X O, GREENBERG D A. Vascular endothelial growth factor stimulates neurite outgrowth from cerebral cortical neurons via Rho kinase signaling[J]. Journal of Neurobiology, 2006, 66(3): 236-242. |
| [19] |
ZHANG Y, MA L, SU Y, et al. Hypoxia conditioning enhances neuroprotective effects of aged human bone marrow mesenchymal stem cell-derived conditioned medium against cerebral ischemia in vitro[J]. Brain Research, 2019, 146432. |
| [20] |
盖聪, 李澎涛, 孙红梅, 等. 通心络干预的脑微血管内皮细胞条件液对大鼠脑皮层神经元的影响[J]. 中医学报, 2014, 29(6): 845-847, 861. GAI C, LI P T, SUN H M, et al. Effect of Tongxinluo intervened brain microvascular endothelial cells conditioned medium on cortical neuron of rats[J]. Acta Chinese Medicine, 2014, 29(6): 845-847, 861. |
| [21] |
方针, 廖维靖, 雷涛, 等. 当归多糖与川芎嗪配伍对大鼠脑缺血再灌注后血管生成的影响[J]. 中国康复医学杂志, 2014, 29(11): 1006-1009, 1015. FANG Z, LIAO W J, LEI T, et al. Effects of compatibility of angelica polysaccharide and tetramethylpyrazine on angiogenesis in cerebral ischemia-reperfusion rats[J]. Chinese Journal of Rehabilitation Medicine, 2014, 29(11): 1006-1009, 1015. DOI:10.3969/j.issn.1001-1242.2014.11.002 |
| [22] |
朱丽娟, 罗建云, 张安平, 等. 当归挥发油通过激活Erk信号通路以减轻缺血再灌注神经细胞凋亡的作用[J]. 中国临床药理学杂志, 2017, 33(17): 1679-1682, 1686. ZHU L J, LUO J Y, ZHANG A P, et al. Function of essential oils from Angelica sinensis reduce apoptosis on the neural cells of damaged by ischemia-reperfusion like injury through up-regulation of ERK pathway[J]. The Chinese Journal of Clinical Pharmacology, 2017, 33(17): 1679-1682, 1686. |
| [23] |
盛艳梅, 孟宪丽, 李春雨, 等. 川芎挥发油对大鼠大脑皮层神经细胞体外存活及脑缺血再灌注损伤的影响[J]. 时珍国医国药, 2012, 23(3): 536-539. SHENG Y M, MENG X L, LI C Y, et al. Effects of Aetherolea from Chuanxiong on ischemical reperfusion injury in rats and the survival of cerebral cortex neurons in vitro[J]. Lishizhen Medicine and Materia Medica Research, 2012, 23(3): 536-539. DOI:10.3969/j.issn.1008-0805.2012.03.011 |
| [24] |
赵玉, 陆连第, 甄晓晗. 川芎多糖对大鼠脑缺血再灌注损伤及高迁移率族蛋白B1表达的影响[J]. 中国老年学杂志, 2017, 37(12): 2878-2880. ZHAO Y, LU L D, ZHEN X H. Effects of Ligusticum Chuanxiong polysaccharide on cerebral ischemia-reperfusion injury and expression of high mobility group protein B1 in rats[J]. Chinese Journal of Gerontology, 2017, 37(12): 2878-2880. DOI:10.3969/j.issn.1005-9202.2017.12.007 |
| [25] |
易善勇, 官丽莉, 杨晶, 等. 红花药理作用及其开发与应用研究进展[J]. 北方园艺, 2015, 39(5): 191-195. YI S Y, GUAN L L, YANG J, et al. Research advances in pharmacological function and development and application of Carthamus tinctorius L[J]. Northern Horticulture, 2015, 39(5): 191-195. |
| [26] |
沈阳军区总医院神经科. 复方当归注射液治疗脑动脉硬化52例初步观察[J]. 新医学, 1977, 9(1): 23-24. Department of Neurology Shenyang Military Command General Hospital. Preliminary observation on 52 cases of cerebral arteriosclerosis treated by Compound Angelica Injection[J]. Journal of New Medicine, 1977, 9(1): 23-24. |
| [27] |
王凌云, 黄国付. 穴位注射对后循环系统短暂性脑缺血患者脑血流的影响[J]. 上海针灸杂志, 2014, 33(7): 602-603. WANG L Y, HUANG G F. Effect of acupoint injection on the cerebral blood flow in patients with transient ischemic attack of posterior circulation[J]. Shanghai Journal of Acupuncture and Moxibustion, 2014, 33(7): 602-603. |
| [28] |
汤轶波, 杜庆红, 李卫红, 等. 复方当归注射液在心脑血管缺血性疾病中的临床应用及现代医学研究进展[J]. 中医药导报, 2017, 23(20): 115-117. TANG Y B, DU Q H, LI W H, et al. Research progress of clinical application and medical research of Compound Angelica Injection in cardio-cerebral vascular ischemic diseases[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2017, 23(20): 115-117. |
| [29] |
JIN X F, WANG S, SHEN M, et al. Effects of rehabilitation training on apoptosis of nerve cells and the recovery of neural and motor functions in rats with ischemic stroke through the PI3K/Akt and Nrf2/ARE signaling pathways[J]. Brain Research Bulletin, 2017(134): 236-245. |
| [30] |
FAN W, LI X, HUANG L, et al. S-oxiracetam ameliorates ischemic stroke induced neuronal apoptosis through up-regulating α7 nAChR and PI3K/Akt/GSK3β signal pathway in rats[J]. Neurochemistry International, 2018(115): 50-60. |
| [31] |
ZHUANG Q, DAI C, YANG L, et al. Stimulated CB1 cannabinoid receptor inducing ischemic tolerance and protecting neuron from cerebral ischemia[J]. Central Nervous System Agents in Medicinal Chemistry (Formerly Current Medicinal Chemistry-Central Nervous System Agents), 2017(17): 141-150. |
| [32] |
HAKRYUL J, SUBHANJAN M, DEWAR T, et al. Small molecule-induced cytosolic activation of protein kinase Akt rescues ischemia-elicited neuronal death[J]. Proceedings of the National Academy of Sciences, 2012, 109(26): 10581-10586. DOI:10.1073/pnas.1202810109 |
| [33] |
SHE Q B, SOLIT D B, YE Q, et al. The BAD protein integrates survival signaling by EGFR/MAPK and PI3K/Akt kinase pathways in PTEN-deficient tumor cells[J]. Cancer Cell, 2005, 8(4): 287-297. |
| [34] |
陈昱文, 李花, 刘旺华, 等. 健脾补土组方对体外神经元低氧/复氧后PI3K、Akt、Caspase-3表达的影响[J]. 湖南中医药大学学报, 2017, 37(10): 1063-1069. CHEN Y W, LI H, LIU W H, et al. Effect of Jianpi Butu Formula on the expression of PI3K, Akt, Caspase-3 and apoptosis in neurons in vitroinduced by Hypoxia/Reoxygenation[J]. Journal of Hunan University of Chinese Medicine, 2017, 37(10): 1063-1069. |
| [35] |
MAYO L D, DONNER D B. A phosphatidylinositol3-kinase/Aktpathway promotes translocation of MDM 2fromthe cytoplasm to the nucleus[J]. Proceedings of the National Academy of Sciences, 2001, 98(20): 11598-11603. DOI:10.1073/pnas.181181198 |
| [36] |
SHIODA N, HAN F, MORGUCHI S, et al. Constitutively active calcineurin mediates delayed neuronal death through Fas-ligand expression via activation of NFAT and FKHR transcriptional activities in mouse brain ischemia[J]. Journal of Neurochemistry, 2007, 102(5): 1506-1517. DOI:10.1111/j.1471-4159.2007.04600.x |
| [37] |
BOULTON T G, NYE S H, ROBBINS D J, et al. ERKs:a family of protein serine/threonine kinases that are activated and tyrosine phosphorylated in response to insulin and NGF[J]. Cell, 1991, 65(4): 663-675. DOI:10.1016/0092-8674(91)90098-J |
| [38] |
FENG Z, YI W, JIE J, et al. Pre-ischemic treadmill training induces tolerance to brain ischemia:involvement of glutamate and ERK1/2[J]. Molecules, 2010, 15(8): 5246-5257. DOI:10.3390/molecules15085246 |
| [39] |
MOSTAJERAN M, EDVINSSON L, WARFVINGE K, et al. Inhibition of mitogen-activated protein kinase 1/2 in the acute phase of stroke improves long-term neurological outcome and promotes recovery processes in rats[J]. Acta Physiologica, 2015, 219(4): 814-824. |
| [40] |
LIU B, LUO C, ZHENG Z, et al. Shengui Sansheng San extraction is an angiogenic switch via regulations of AKT/mTOR, ERK1/2 and Notch1 signal pathways after ischemic stroke[J]. Phytomedicine, 2018(44): 20-31. |
| [41] |
ZHAO B, ZHENG Z. Insulin growth factor 1 protects neural stem cells against apoptosis induced by hypoxia through Akt/Mitogen-activated protein Kinase/Extracellular Signal-Regulated Kinase (Akt/MAPK/ERK) pathway in hypoxia-Ishchemic encephalopathy[J]. Medical Science Monitor International Medical Journal of Experimental & Clinical Research, 2017, 23: 1872-1879. |
| [42] |
JEONG J E, PARK J H, KIM C S, et al. Neuroprotective effects of erythropoietin against hypoxic injury via modulation of the mitogen-activated protein kinase pathway and apoptosis[J]. Korean Journal of Pediatrics, 2017, 60(6): 181. DOI:10.3345/kjp.2017.60.6.181 |
| [43] |
王瑞, 李玉, 王波, 等. β-羟基丁酸对糖氧剥夺原代神经元的保护作用及其机制研究[J]. 国际神经病学神经外科学杂志, 2018, 45(1): 58-64. WANG R, LI Y, WANG B, et al. Protective effect of β-hydroxybutyrate on primary neurons with glucose-oxygen deprivationand related mechanism[J]. Journalof International Neurology and Neurosurgery, 2018, 45(1): 58-64. |
| [44] |
司玮.促红细胞生成素通过PI3K/Akt和Erk1/2信号通路对缺氧缺糖诱导神经元凋亡的保护作用[D].遵义: 遵义医学院, 2017. SI W. The study on protective effect and the mechanism oferythropoietin on oxygen-glucose deprivation neurons viaPI3K/Akt and Erk1/2 pathway[D]. Zunyi: Zunyi Medical University, 2017. |
| [45] |
ZHOU J, DU T, LI B, et al. Crosstalk between MAPK/ERK and PI3K/Aktsignal pathways during brain ischemia/reperfusion[J]. ASN Neuro, 2015, 7(5): 1-16. |
| [46] |
LAI T W, ZHANG S, WANG Y T. Excitotoxicity and stroke:identifying novel targets for neuroprotection[J]. Progress in Neurobiology, 2014(115): 157-188. |
| [47] |
XING Y, YANG S D, WANG M M, et al. Electroacupuncture alleviated neuronal apoptosis following ischemic stroke in rats via midkine and ERK/JNK/p38 signaling pathway[J]. Journal of molecular neuroscience, 2018(66): 26-36. |
2. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China
 2020, Vol. 37
2020, Vol. 37