文章信息
- 孙彬栩, 蔡启亮, 李小江, 贾英杰
- SUN Binxu, CAI Qiliang, LI Xiaojiang, JIA Yingjie
- 基于IGF/MMP信号通路研究健脾利湿化瘀方有效拆方对前列腺癌细胞侵袭、迁移的影响
- Influence of the effective decomposed in Nourishing Spleen Removing Dampness and Eliminating Blood-stasis Decoction on the invasion, migration and apoptosis of the human prostate cancer cells based on the IGF/MMP signaling pathway
- 天津中医药, 2020, 37(4): 450-456
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(4): 450-456
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.04.21
-
文章历史
- 收稿日期: 2019-12-15
2. 天津医科大学第二医院, 天津 300211
前列腺癌是一类从不需要治疗的非侵袭性、生长缓慢的疾病到需要治疗的侵袭性、生长迅速的疾病。据2019年最新数据显示, 在美国, 前列腺癌是常见的肿瘤疾病之一, 也是美国男性肿瘤死亡的第二大原因; 预计将有174 650例男性被诊断出患有前列腺癌, 31 620例患者将死于这种疾病[1], 从1993年到2016年, 美国的前列腺癌病死率下降了51%, 这主要是由于早期发现和改进的治疗[2]。在中国, 前列腺癌的发病率虽远远低于欧美国家, 但其发病呈快速上升趋势[3]。中国大多数前列腺癌患者在初诊时就已经出现转移, 目前晚期转移性前列腺癌患者的一线治疗方案仍然为内分泌治疗, 但经过中位时间为18~24个月的内分泌治疗, 几乎所有患者都将进展为去势抵抗性前列腺癌(CRPC)[4], 而其中86%的CRPC最终会转变为转移性CRPC。患者一旦进入CRPC阶段, 预后一般较差。因此, CRPC的诊治一直是临床与基础研究的热点与难点[5]。
目前, 西医学治疗转移性CRPC患者的方案包括:雄激素合成抑制剂-醋酸阿比特龙联合低剂量醋酸泼尼松、抗雄激素药-恩杂鲁胺、多西他赛等[4]。国际多中心随机双盲试验(COU-AA-302)结果也显示阿比特龙作为一线药物可显著延长未化疗转移性CRPC患者的中位生存期, 延缓患者的疾病进展, 改善患者的生活质量, 且具有良好的安全性[6]。但是醋酸阿比特龙的使用也为患者带来了巨大的经济负担[7], 另外, 亦有研究数据显示阿比特龙和恩杂鲁胺具有交叉耐药性[8]。另外, 现在患者关注的不仅仅是延长肿瘤患者的生命期, 更为关心的是肿瘤对患者自身疼痛和生活质量的影响。因此, 如何利用中医学的治疗特色为CRPC患者制定最佳的治疗方案, 成为当下治疗的研究重点。
贾英杰教授[9]分析前列腺癌中医证候相关文献得出, 前列腺癌的病变脏腑主要责之肾与膀胱, 并涉及肝、脾、肺。基于多年临床经验[10], 总结出前列腺癌病机为脾虚湿困、气虚毒瘀, 将治疗前列腺癌的临床验方进行加减化裁, 创立健脾利湿化瘀方, 基础方由黄芪、大黄、姜黄、王不留行等中药组成。此外, 在实验研究中均证实健脾利湿化瘀方及其各拆方组对人前列腺癌PC-3细胞荷瘤小鼠具有抑瘤作用[11], 并能抑制人前列腺癌C4-2细胞雄激素非依赖性生长作用[12], 为健脾利湿化瘀方的机制研究方面提供依据。多种实体肿瘤细胞均可分泌多种蛋白酶, 如基质金属蛋白酶(MMP)类, 在组织重塑中发挥重要作用, 并与形态发生、血管生成等多种生理过程相关; 这些酶类可有效降解细胞外基质, 从而有助于肿瘤转移[13]。为进一步明确该复方的作用机制[14], 在前期动物实验的基础上, 运用各拆方组含药血清进行前列腺癌DU-145、PC-3细胞的增殖与迁移影响研究, 并选出细胞增殖率最佳的拆方组进行基于胰岛素样生长因子(IGF)/MMP信号通路的分子机制研究, 以更好地证实复方的部分作用机制。
1 材料与仪器 1.1 实验细胞株实验所应用的PC-3、DU-145、CAF细胞株购自ATCC公司, 批号CRL-1435, 由南开大学生命科学院分子研究所长期冻存。
1.2 试剂与药品健脾利湿化瘀方各拆方组含药血清[11]由天津中医药大学第一附属医院中医肿瘤研究所冻存。其中, 健脾扶正组药物由黄芪、刺五加、补骨脂组成, 化瘀散结组药物由姜黄、大黄、王不留行组成, 清热解毒组药物由白英、蛇六谷、车前草组成。
青霉素、链霉素、胎牛血清、L-谷氨酰胺、DMEM培养基、磷酸缓冲盐溶液(PBS)、四甲基噻唑蓝(MTT)试剂盒(Chemicon, 美国)等。
1.3 主要仪器超净工作台(苏州净化设备有限公司)、倒置荧光显微镜(美国BIGCO公司)及细胞培养皿(上海晶睿生物科技有限公司)等。
2 方法 2.1 细胞培养人前列腺癌细胞株PC-3、DU-145、CAF常规培养于含10%胎牛血清培养液中, 置于37℃、5% CO2、饱和湿度的条件下培养。待细胞长满瓶底85%~90%, 弃去已用培养液, 以0.25%胰蛋白酶消化, 隔2~3 d分瓶传代、培养。
2.2 MTT法检测细胞生长抑制和最适药物浓度将各组细胞制成单细胞悬液, 按5 000/孔分别接种于96孔培养板, 每孔200 μL, 24 h后除去培养液, 分别将健脾扶正组、化瘀散结组、清热解毒组含药血清用培养基稀释10、50、100倍加入96孔板中, 每孔200 μL, 37℃, 5% CO2培养; 24 h后加入八肽胆囊收缩素(CCK-8)溶液20 μL, 继续孵育4 h后, 测量各孔450 nm处的光密度值。每组设6个复孔, 取各组值的均数表示细胞的增殖情况。
2.3 Transwell实验检测细胞侵袭能力在Matrigel Invasion Chamber上室和下室各加入500 μL预热的无血清高糖DMEM培养液, 置于37℃, 5% CO2培养箱中水化2 h; 吸弃上下室中的无血清培养基, 常规制备无血清1%双抗DMEM单细胞悬液, 调整细胞密度为2×104/mL。
DU-145细胞和PC-3细胞各分两组:对照组和药物组。对照组每孔上室中加入500 μL正常DMEM细胞悬液, 药物组每孔上室中加入500 μL化瘀散结组含药血清培养基稀释液, 下室中加入750 μL完全高糖DMEM培养基, 每种细胞设3个复孔, 置于37℃, 5% CO2培养箱培养24 h。固定、结晶染色, 倒置显微镜下计数、拍照。
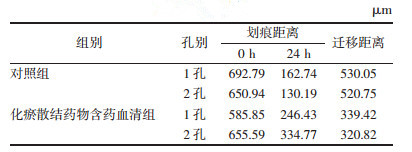
2.4 划痕实验检测细胞迁移能力细胞消化成单细胞悬液, 接入6孔板, 数量以贴壁后铺满板底为宜; 细胞铺满板底后用200 μL枪头制造细胞划痕; PBS漂洗; 加入化瘀散结组含药血清培养基稀释液继续培养24 h, 倒置显微镜下拍照记录, 计算划痕愈合率。
2.5 实时荧光定量聚合酶链式反应(Real-Time PCR)检测前列腺癌细胞样本中目的基因表达量的变化化瘀散结药物含药血清设正常剂量组、低剂量组(稀释100倍)、中剂量组(稀释50倍)、高剂量组(稀释10倍), 每组3个样本量。引物设计:SDF-1-F、SDF-1-R、IGF-1-F、IGF-1-R、MMPS-F、MMPS-R、FN-F、FN-R、Actin-F、Actin-R。用超纯RNA提取试剂(TaKaRa Code D9108B)提取经化瘀散结组含药血清培养基稀释液处理的CAF细胞样本中总RNA, RNA质量检测、电泳、消化; 用反转录试剂盒(TaKaRa code DRRO47A)进行反转录。用ABI 7500型荧光定量PCR仪, 采用2-ΔΔCT法进行数据的相对定量分析。
2.6 蛋白免疫印迹(Western Blot)法检测相关蛋白表达取化瘀散结药物组(含药血清培养基稀释液)处理前列腺活化间质细24 h, 收集、破碎细胞, 提取总蛋白, 测定蛋白浓度。制备SDS-PAGE胶, 蛋白样品变性、电泳, 凝胶转膜及检测。将一抗用封闭液稀释(IGF-1抗体稀释度均为1:500, 内参抗体稀释度为1:1 000)。将封闭后的膜直接放入一抗工作液中, 4℃反应过夜; 二抗室温反应1 h, 曝光及洗片。测定各个条带和内参(β-肌动蛋白)的灰度值, 并计算比值。
2.7 统计学分析使用SPSS 23.0统计软件处理, 计量资料以均数±标准差(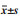
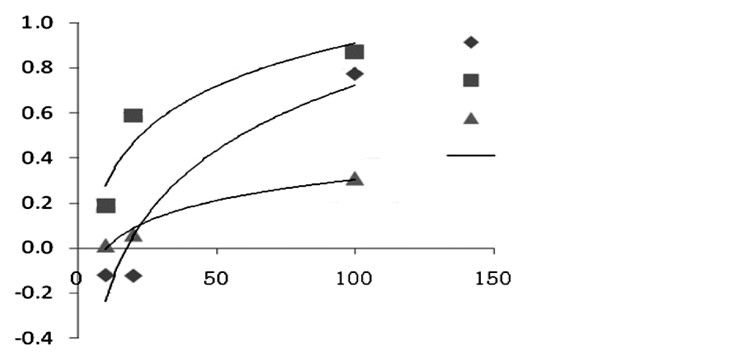
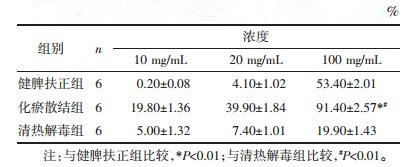
含药血清设置不同浓度(浓度分别为10、20、100 mg/mL), 经过作用DU-145、PC-3细胞24 h后, 与健脾扶正组、清热解毒组相比, 化瘀散结组抑制率高(P < 0.01), 差异具有统计学意义, 且呈一定的剂量依赖性抑制作用。见表 1、2及图 1、2。

|
| 图 1 不同浓度药物对DU-145细胞的抑瘤率(n=6) Fig. 1 Comparison of tumor inhibition rates of the different concentrations of drugs on DU-145 cells(n=6) |
|
| 图 2 不同浓度药物对PC-3细胞的抑瘤率(n=6) Fig. 2 Comparison of tumor inhibition rates of the different concentrations of drugs on PC-3 cells(n=6) |
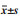
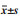
|
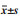
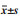
|
研究结果显示, 健脾利湿化瘀方的各有效拆方组中, 化瘀散结组药物的抑瘤率最高, 为进一步细化复方的研究机制, 从化瘀散结组药物入手进一步深化研究其可能的分子机制。
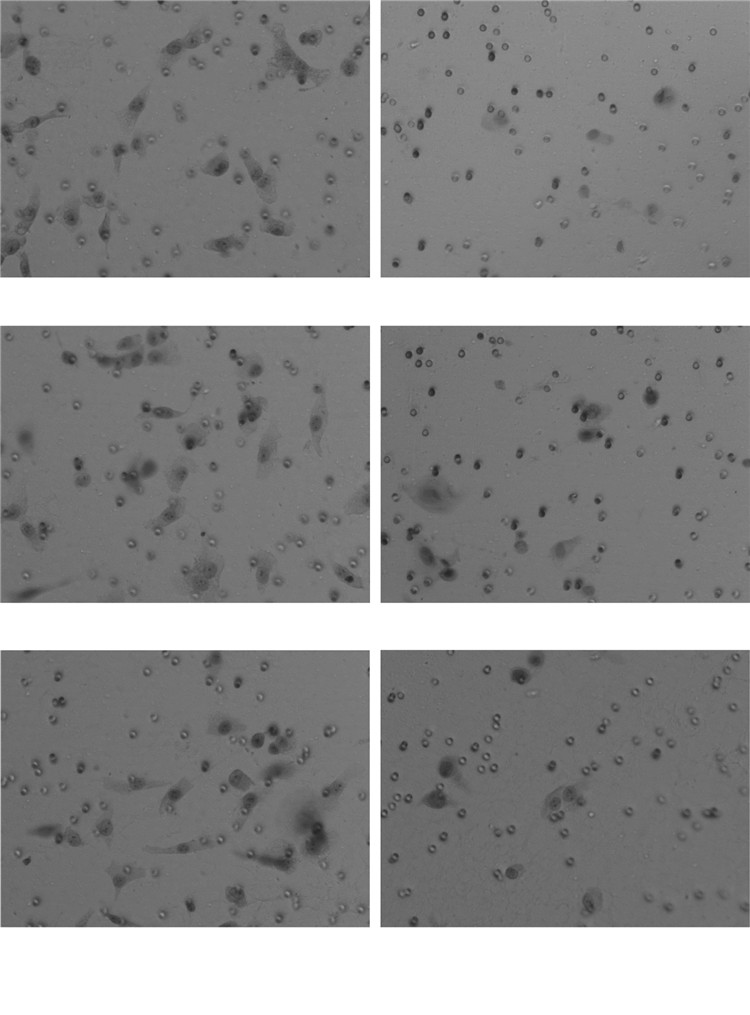
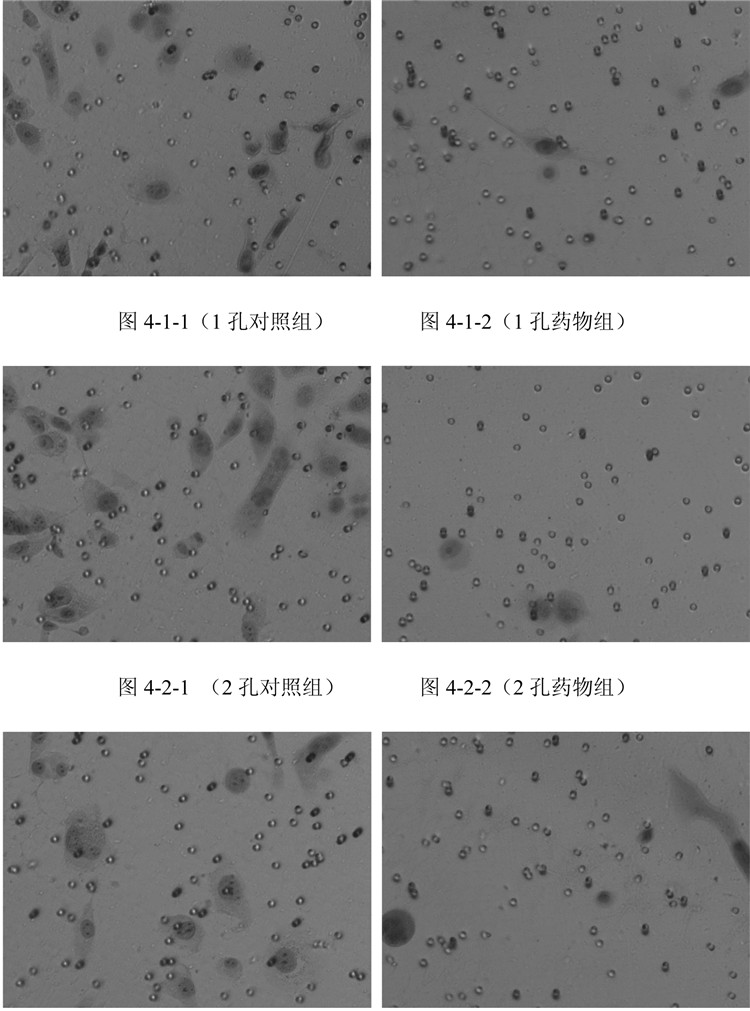
3.2 Transwell实验评估细胞的侵袭能力与空白对照组相比, 化瘀散结组含药血清作用后的各组DU-145和PC-3细胞实验组漏入下室细胞数分别为(7.33±2.51)个和(3.67±0.58)个, 显著少于对照组(22.00±2.65)个和(22.67±7.77)个, 差异均具有统计学意义(P < 0.05)。提示化瘀散结药物能抑制PC-3、DU-145细胞的侵袭能力。见表 3-6和图 3-4。
|
| 图 3 DU-145细胞各组之间侵袭细胞情况 Fig. 3 Situation of invading cells of DU-145 cells of each group |
|
| 图 4 PC-3细胞各组之间侵袭细胞情况 Fig. 4 Situation of invading cells of PC-3 cells of each group |
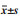
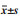

|
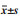
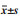

|
与阴性对照组相比, 化瘀散结药物作用后的DU-145、PC-3细胞实验组的细胞迁移能力受到抑制, 差异均有统计学意义(P < 0.05)。实验结果显示化瘀散结药物含药血清组能显著抑制DU-145、PC-3细胞的迁移能力。见表 7-10、图 5-6。

|
| 图 5 两组DU-145细胞不同孔划痕图 Fig. 5 Illustration the different scratches of DU-145 cells of two group |

|
| 图 6 两组PC-3细胞不同孔划痕图 Fig. 6 Illustration the different scratches of PC-3 cells of two group |
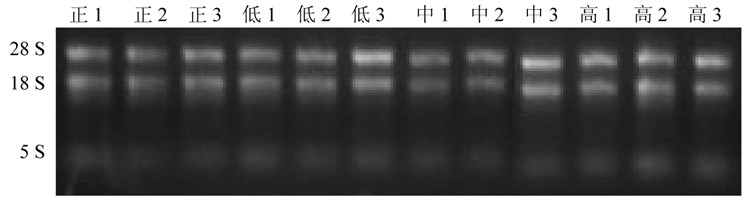
研究结果显示不同剂量组的前列腺活化间质细胞系CAF中的SDF-1基因在低剂量组中表达较低, 随浓度增加其表达量亦逐渐增加。见图 7、表 11。
|
| 注:正:正常组;低:低剂量组;中:中剂量组;高:高剂量组。 图 7 RNA电泳 Fig. 7 RNA electrophoresis |
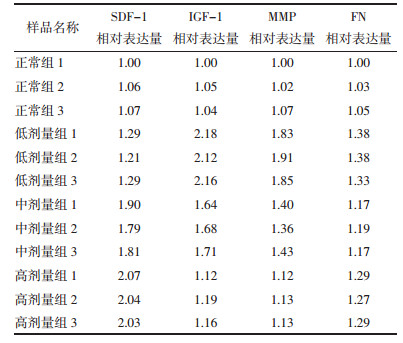
|
研究结果显示经化瘀散结药物作用CAF细胞后, SDF-1、IGF、MMP蛋白表达与阴性对照组相比显著降低, 差异均有统计学意义(P < 0.05)。见图 8。
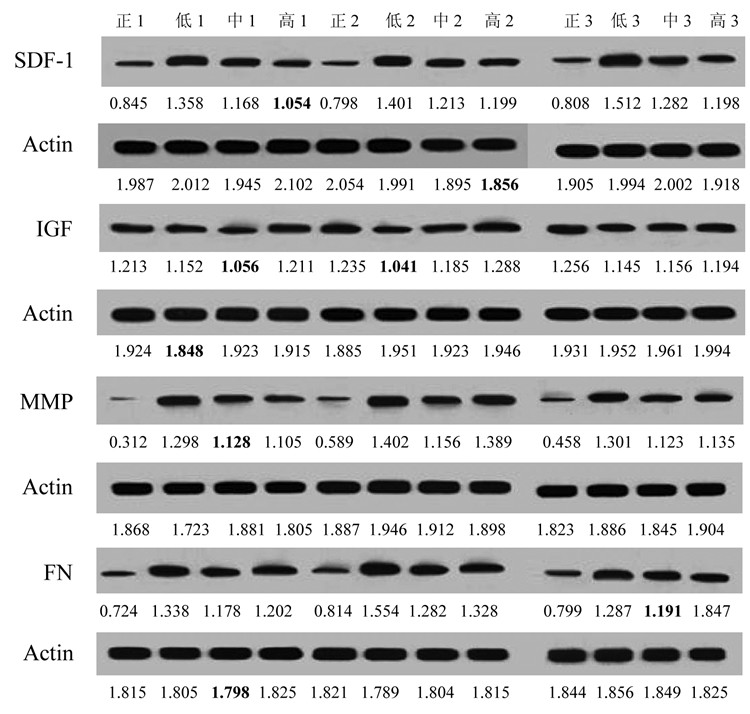
|
| 图 8 化瘀散结组药物对SDF-1、IGF、MMP、FN蛋白表达的影响 Fig. 8 Effect of protein expression in SDF-1, IGF, MMP and FN by the drugs of Huayu Sanjie group |
近20年来, 中医药治疗前列腺癌已经引起了广泛的重视, 临床研究也在不断地进行[15]。中医药在增效减毒、提高生活质量、延长生存时间等方面的独特优势, 使得在CRPC治疗中占据了非常重要的位置[16]。
中医药注重辨证论治, 谨守病机, 抓住病理产物, 对肿瘤的治疗主要从扶正固本、培补正气、化瘀解毒、祛痰散结、攻补兼施、虚实兼顾等方面入手[17]。贾英杰教授提出本元虚衰是癌病之根, 邪浊(浊毒、瘀浊)内生, 久蕴不解, 发为肿块, 胶结难化, 克伐脏腑经络, 阻碍气机升降, 影响气血运行, 形成浊邪瘀塞局部为肿瘤之核心病机。贾教授基于多年临床经验, 总结出前列腺癌病机为脾虚浊困、气虚毒瘀, 瘀、毒与浊邪胶着和合, 发为浊毒、瘀浊, 共同致病。因此, "浊"是形成前列腺癌的核心病机要素。"黜浊"辨治的核心总不离脾胃, 脾胃位居中州, 纳运相合, 升降相因, 互为舟楫, 治浊需重视脾胃升降功能, 燮理中焦, 斡旋气机, 兼顾肝肾, 使得升降有序, 化生精微, 充养五脏, 使浊邪得化, 即"治脾胃者即可以安五脏"[18]。
在健脾利湿化瘀方治疗脾虚瘀浊互结证晚期CRPC患者取得较好临床疗效的基础上, 本团队通过动物实验研究证实复方及其各拆方组均具有一定的抑瘤作用。为进一步从细胞和分子通路上对复方的作用机制进行明确, 本研究首先分析健脾扶正组、化瘀散结组、清热解毒组对前列腺癌PC-3和DU-145细胞的增殖抑制率, 并筛选出抑瘤最佳的化瘀散结组, 从拆方对前列腺癌PC-3和DU-145细胞的侵袭和迁移研究进一步证实大黄、姜黄、王不留行的抑瘤作用。并通过研究证实大黄、姜黄、王不留行药物对前列腺癌CAF细胞系IGF/MMP通路相关的IGF-1、MMP、FN、SDF-1基因的相对表达量影响均有所不同。其中, IGF-1是一种促有丝分裂剂, 在肿瘤的发生发展中发挥着作用, 国内外学者越来越关注其与前列腺癌的关系; IGF-1表达的升高, 与前列腺癌的细胞增殖相关, 而在本研究中化瘀散结药物具有降低IGF-1表达的作用, 并呈剂量相关性。MMP家族在肿瘤的血管新生、肿瘤细胞的侵袭和转移灶的形成等过程中扮演着重要的角色。研究结果显示化瘀散结组药物含药血清作用后的前列腺间质细胞分泌的SDF-1、IGF、MMP与上皮细胞增殖存活相关的活性因子表达情况下降。本研究探讨了复方健脾利湿化瘀方整体临床疗效的作用机制, 从一个方面进行阐述, 也为进一步的深入研究提供基础。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA:A Cancer Journal for Clinicians, 2019(69): 7-34. |
| [2] |
NEGOITA S, FEUER E J, MAROTTO A, et al. Annual report to the nation on the status of cancer, part I:recent changes in prostate cancer trends and disease characteristics[J]. Cancer, 2018(124): 2801-2814. |
| [3] |
朱刚, 张凯. 中国前列腺癌筛查的现状和挑战[J]. 山东大学学报(医学版), 2019, 57(1): 11-15. ZHU G, ZHANG K. Chinese prostate cancer screening:current situation and challenges[J]. Journal of Shandong University (Health Sciences), 2019, 57(1): 11-15. |
| [4] |
中国抗癌协会泌尿肿瘤专业委员会. 中国去势抵抗性前列腺癌诊治专家共识[J]. 中华外科杂志, 2016, 54(7): 481-484. Expert Consensus on the Diagnosis and Treatment of Castration-resistant Prostate Cancer, Urologic Oncology Committee. Assessment of updated guidelines for castration-resistant prostate cancer[J]. Chinese Journal of Surgery, 2016, 54(7): 481-484. |
| [5] |
宋文斌. Eur Urol:对转移性去势抵抗性前列腺癌患者中实施根治性前列腺切除术的可行性、安全性以及术后生活质量的探讨[J]. 现代泌尿外科杂志, 2018, 23(11): 870. SONG W B. Eur Urol:radical prostatectomy for metastatic castration-resistant prostate cancer:the feasibility, safety and postoperative quality of life were discussed[J]. Journal of Modern Urology, 2018, 23(11): 870. |
| [6] |
RYAN C J, SMITH M R, FIZAZI K, et al. Abiraterone acetate plus prednisone versus placebo plus prednisone in chemotherapy-naive men with metastatic castration resistant prostate cancer (COU-AA-302):final overall survival analysis of a randomised, double blind, placebo-controlled phase 3 study[J]. Lancet Oncology, 2015(16): 152-160. |
| [7] |
吴开杰, 王禾, 袁建林, 等. 陕西地区阿比特龙治疗去势抵抗型前列腺癌早期疗效及安全性的初步分析[J]. 现代泌尿外科杂志, 2017, 22(1): 12-16. WU K J, WANG H, YUAN J L, et al. Preliminary analysis of early clinical efficacy and safety of abiraterone treatment in castration-resistant prostate cancer in Shaanxi area[J]. Journal of Modern Urology, 2017, 22(1): 12-16. |
| [8] |
张君席. 恩杂鲁胺和阿比特龙耐药机制及其耐药后新型临床治疗方案的研究进展[J]. 国际泌尿系统杂志, 2019, 39(2): 363-366. ZHANG J X. Advances in research on the mechanism of drug resistance of enxarutamide and abiraterone and novel clinical treatment regimens after drug resistance[J]. International journal of Urology and Nephrology, 2019, 39(2): 363-366. |
| [9] |
贾英杰, 陈军, 李小江, 等. 前列腺癌中医证候研究的文献分析[J]. 辽宁中医杂志, 2014, 41(9): 1850-1852. JIA Y J, CHEN J, LI X J, et al. Literature analysis of TCM syndromes in prostate cancer[J]. Liaoning Journal of Traditional Chinese Medicine, 2014, 41(9): 1850-1852. |
| [10] |
赵林林, 陈亮, 李小江, 等. 贾英杰治疗前列腺癌经验管窥[J]. 辽宁中医杂志, 2013, 40(8): 1539-1540. ZHAO L L, CHEN L, LI X J, et al. Glimpse at professor JIA Yingjie's academic experience in treatment of prostatic cancer[J]. Liaoning Journal of Traditional Chinese Medicine, 2013, 40(8): 1539-1540. |
| [11] |
孙彬栩, 贾英杰, 李小江, 等. "健脾利湿化瘀方"对人前列腺癌PC-3细胞荷瘤小鼠的抑瘤作用研究[J]. 中华中医药学刊, 2016, 34(10): 2468-2471. SUN B X, JIA Y J, LI X J, et al. Nourishing Spleen and Removing Dampness and Eliminating Blood Stasis Decoction on anti-tumor effect of tumor-bearing by human prostate cancer PC-3 cells[J]. Chinese Archives of Traditional Chinese Medicine, 2016, 34(10): 2468-2471. |
| [12] |
牟睿宇, 贾英杰, 孙彬栩, 等. 健脾利湿化瘀方对人前列腺癌C4-2细胞雄激素非依赖性生长的影响[J]. 中医杂志, 2019, 60(11): 964-968. MOU R Y, JIA Y J, SUN B X, et al. Effects of Jianpi Lishi Huayu Recipe on androgen-independent growth of human prostate cancer C4-2 cells[J]. Journal of Traditional Chinese Medicine, 2019, 60(11): 964-968. |
| [13] |
陈玉乐, 吕伟, 杨文杰, 等. 肥大细胞通过TGFβ/MMP2信号通路促进肾癌细胞侵袭迁移的研究[J]. 现代泌尿外科杂志, 2019, 7(10): 1-6. CHEN Y L, LYU W, YANG W J, et al. Mastcells promote invasion and migration of renal carcinoma cells through TGFβ/MMP2 signaling pathway[J]. Journal of Modern Urology, 2019, 7(10): 1-6. |
| [14] |
GONG Y X, UMA D, OH W K. Roles of matrix metalloproteinases and their natural inhibitors in prostate cancer progression[J]. Cancers (Basel), 2014, 6(3): 1298-1327. |
| [15] |
周俊德, 陈柯, 周建甫, 等. 中医药治疗前列腺癌的文献计量学分析[J]. 光明中医, 2019, 34(6): 811-815. ZHOU J D, CHEN K, ZHOU J F, et al. Bibliometric analysis of traditional Chinese medicine in the treatment of prostate cancer[J]. Guangming Journal of Chinese Medicine, 2019, 34(6): 811-815. |
| [16] |
李小江, 牟睿宇, 邬明歆, 等. 中医药治疗去势抵抗性前列腺癌的研究进展[J]. 中草药, 2019, 50(4): 1007-1011. LI X J, MU R Y, WU M X, et al. Research progress on traditional Chinese medicine in treatment of castration-resistant prostate cancer[J]. Chinese Traditional and Herbal Drugs, 2019, 50(4): 1007-1011. |
| [17] |
陈磊, 曹宏文, 高人杰, 等. 周氏芪凌汤联合艾迪注射液治疗去势抵抗性前列腺癌的临床疗效研究[J]. 安徽医药, 2019, 23(5): 1001-1005. CHEN L, CAO H W, GAO R J, et al. Study on clinical effect of Zhou Qi Ling decoction combined with Aidi injection in the treatment of castration resistant prostate cancer[J]. Anhui Medical and Pharmaceutical Journal, 2019, 23(5): 1001-1005. |
| [18] |
李海燕, 陈磊, 汤杰, 等. 浊邪致病及论治初探[J]. 上海中医药大学学报, 2015, 29(5): 19-23. LI H Y, CHEN L, TANG J, et al. On the theory of Zhuo Xie causing disease and the treatment[J]. Academic Journal of Shanghai University of Traditional Chinese Medicine, 2015, 29(5): 19-23. |
2. The Second Hospital of Tianjin Medical University, Tianjin 300211, China
 2020, Vol. 37
2020, Vol. 37