文章信息
- 耿韦华, 楼姣英, 张静, 王莹, 李美
- GENG Weihua, LOU Jiaoying, ZHANG Jing, WANG Ying, LI Mei
- 清毒栓提取物通过调节Foxp3影响β-catenin通路从而抑制SiHa细胞活性的研究
- Study on the inhibition of SiHa cell activity by regulating Foxp3 and affecting the β-catenin pathway with the extract of Qingdushuan
- 天津中医药, 2020, 37(4): 457-461
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(4): 457-461
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.04.22
-
文章历史
- 收稿日期: 2019-11-09
2. 北京中医药大学东方医院, 北京 100078
宫颈癌的发病率和病死率均居全球女性恶性肿瘤第4位[1], 严重威胁女性身体健康和生命安全。人乳头瘤病毒(HPV)持续感染是目前国内外公认的宫颈癌致病因素之一[2], 机体免疫力尤其是宫颈局部免疫微环境对于HPV感染的清除至关重要。调节性T细胞(Treg)是一类具有独特免疫调节功能的T细胞亚群, 具有免疫抑制性和免疫无能性, 参与宫颈癌等恶性肿瘤的发生发展, 促进肿瘤的免疫逃逸[3]。Foxp3是天然Treg最可靠的标记物, 是Treg发挥作用的决定因素[4]。有研究表明[5], Treg细胞高表达Foxp3可以显著抑制机体的免疫反应。本课题组前期研究结果显示, 清毒栓可以抑制宫颈癌SiHa细胞活性[6], 通过促进相关免疫因子的表达来提高机体抗肿瘤能力[7], 但是否与Foxp3有关, 具体通过何种途径激活相关基因的表达, 需要深入研究至分子信号通路方面。本研究以宫颈癌SiHa细胞为研究对象, 探讨清毒栓提取物通过Foxp3调控β-连环蛋白(β-catenin)信号通路抑制宫颈癌SiHa细胞活性的机制, 以期为临床靶向治疗宫颈癌提供实验依据。
1 材料与仪器 1.1 细胞株人宫颈癌SiHa细胞, 购自中国医学科学院基础医学研究所。
1.2 实验用药清毒栓主要组成为紫草、莪术、黄柏等, 均购自北京同仁堂药店, 将复方药物分别醇提(紫草)、油提(莪术)、水煎(黄柏), 去渣浓缩后1剂药浓缩至20 mL, 终浓度约为4.2 g/mL, 高温消毒后于4℃冰箱密封保存。
1.3 实验动物C57BL/6小鼠22只, 日龄49 d, 购自三峡大学实验动物中心, 许可证号:SCXX(鄂), 2017-0012。分笼饲养, 温度24~26℃, 相对湿度50%~60%, 通风良好, 每日光照12 h, 昼夜交替。
1.4 主要试剂磷酸缓冲盐溶液(PBS)、胎牛血清(FBS)、DMEM培养基(Gibco公司); pGEM-Foxp3重组质粒(北京义翘神州科技有限公司); 脂质体2000(LipofectamineTM 2000, Thermo Fisher公司); 苯甲基磺酰氟(PMSF, 南京沃宏公司); 聚偏氟乙烯(PVDF)膜(Bio-Rad公司); 裂解液(碧云天公司); Foxp3抗体、G1/S-特异性周期蛋白-D1(cyclin D1)抗体、活化的含半胱氨酸的天冬氨酸蛋白水解酶-3(Caspase-3)抗体、c-Myc抗体、β-连环蛋白抗体(β-catenin antibody, 1:1 000, Affinity公司); 甘油醛-3-磷酸脱氢酶(GAPDH)抗体(1:2 500, Abcam公司); 辣根过氧化物酶(HRP)二抗(1:4 000;Dianova, Hamburg, Germany公司); ECL显影液(Bio-Rad公司); CCK8检测试剂盒(七海生物公司)等。
1.5 主要仪器超净工作台(苏州净化设备有限公司); 电热恒温水浴锅(北京市长风仪器仪表公司); PCR扩增仪(北京东胜创新生物科技有限公司); 水平电泳仪(北京君意东方电泳设备有限公司); MultiskanMK3酶标仪(MD公司)等。
2 方法 2.1 血清制备与提取将22只C57BL/6小鼠随机分为空白组和药物组, 每组各11只; 分别用PBS和中药对两组小鼠进行灌胃, 早晚各1次, 每次灌胃量为0.4 mL, 连续灌胃3 d; 两组小鼠均于最后1次给药后1~2 h摘眼球取血; 将血液静置30 min后, 3 000 r/min, 离心半径14 cm, 离心10 min, 取上清分装到1 mL无菌EP管中, 保存至-80℃冰箱备用。用前56℃水浴30 min, 灭活补体。
2.2 细胞培养和转染SiHa细胞使用含有10%FBS的DMEM培养基在37℃, 5%CO2条件下进行培养。以pGEM-Foxp3为模板扩聚合酶链式反应(PCR)得到目的片段后切胶回收, 将目的片段连接pcDNA3.1载体, 质粒DNA转化DH5α感受态细胞, 筛选阳性克隆后, 提取质粒, 利用LipofectamineTM 2000进行质粒转染, 建立稳定转染高表达Foxp3的HPV感染阳性SiHa细胞, 同时利用pcDNA3.1空载体转染SiHa细胞株, 作为本研究对照组, 具体克隆及转染操作严格按照试剂盒使用说明进行。
2.3 SiHa细胞培养分组空白对照组:空白质粒中加入空白血清, 即0%含药血清进行培养; Foxp3过表达组:Foxp3过表达质粒中加入空白血清进行培养; 空染血清组:空白质粒中加入浓度为15%含药血清进行培养; Foxp3过表达血清组:Foxp3过表达质粒中加入浓度为15%含药血清进行培养。每组各3例。
2.4 蛋白免疫印迹(Western Blot)法检测Foxp3蛋白表达水平分别用空白血清和15%含药血清对Foxp3过表达质粒组及空白质粒组进行血清培养72 h, 之后检测4组SiHa细胞中Foxp3蛋白的相对表达量, 具体步骤如下:1)蛋白提取及浓度测定:细胞用含有PMSF的裂解液裂解后测定浓度, 将10 μg从细胞中获得的细胞裂解液与5×样品缓冲液混合后, 将样品上样至10%的聚丙烯酰胺凝胶中。2)转膜:SDS-聚丙烯酰胺凝胶分离并转移至PVDF膜上。3)封闭:用含0.1%聚山梨酯(Tween)的4%牛奶进行封闭。4)加入Fxop3 antibody和GAPDH antibody抗体, 4℃孵育过夜。5)洗膜:用含0.1%Tween的PBS溶液将膜洗3遍。6)加入二抗:加入含0.1%Tween的4%牛奶以及HRP二抗在室温条件下孵育1 h。7)显影:在膜上滴加ECL显影液并放入GelDoc成像系统(Bio-Rad)进行拍照。8)进行图像采集, 计算目标蛋白与内参GAPDH灰度值的比值。
2.5 CCK8法检测SiHa细胞活性细胞按照要求转染处理后, 取对数生长期SiHa细胞, 经胰酶消化、离心、细胞计数后, 调整细胞悬液密度为1×105个/mL, 接种于规格为96孔的培养板内(150 μL/孔); 然后将培养板置入培养箱内, 待细胞贴壁变形后, 在两组Foxp3过表达质粒组及两组空白质粒组中以150 μL/孔分别加入含药血清和空白血清, 各组设5复孔。而后将培养板置入5%的CO2培养箱中孵育, 于72 h后加入10 μL CCK8试剂, 混匀, 采用酶标仪测定各孔450 nm处的吸光度(A)值。
2.6 Western Blot法检测Foxp3下游信号分子的表达经血清培养后, 用Western Blot法对4组细胞Foxp3下游信号分子β-catenin、c-Myc、cyclinD1、Caspase-3的蛋白水平进行检测, 具体检测方法同上。
2.7 数据处理检测结果应用SPSS 21.0软件分析, 多组间比较采用单因素方差分析, 组间两两比较采用LSD法, P < 0.05为差异具有统计学意义。
3 结果 3.1 Western Blot法检测不同组别SiHa细胞中Foxp3蛋白水平Foxp3过表达组与空白对照组相比、Foxp3过表达血清组与空染血清组相比, SiHa细胞中Foxp3的相对表达量均增加, 差异均具有统计学意义(P < 0.01);空染血清组与空白对照组相比、Foxp3过表达血清组与Foxp3过表达组相比, Foxp3的相对表达量均下降, 差异均具有统计学意义(P < 0.01);Foxp3过表达血清组与空白对照组相比, Foxp3相对表达量无统计学差异(P>0.05)。见图 1。
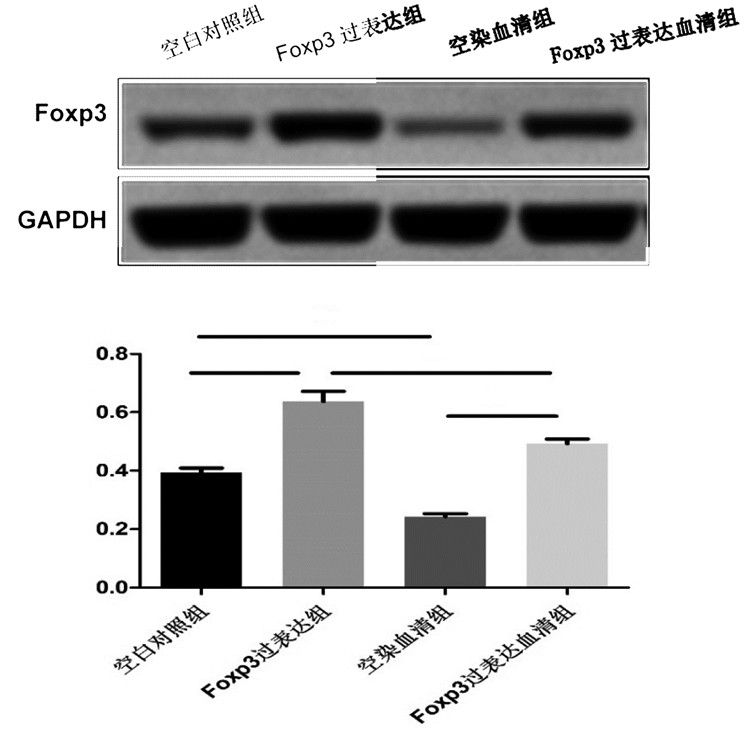
|
注:与空白对照组比较,*P < 0.01;与Foxp3过表达组比较,#P < 0.01;与空染血清组比较,△P < 0.01。
图 1 Western Blot法检测SiHa细胞Foxp3蛋白水平的条带图及灰度统计图(  |
结果显示, Foxp3过表达组与空白对照组相比、Foxp3过表达血清组与空染血清组相比, Foxp3过表达质粒组的A值均增加, 差异均具有统计学意义(P < 0.01);空染血清组与空白对照组相比、Foxp3过表达血清组与Foxp3过表达组相比, 含药血清组的A值较相应的对照组均下降, 差异均具有统计学意义(P < 0.01);Foxp3过表达血清组与空白对照组相比, A值无统计学差异(P>0.05)。见图 2。
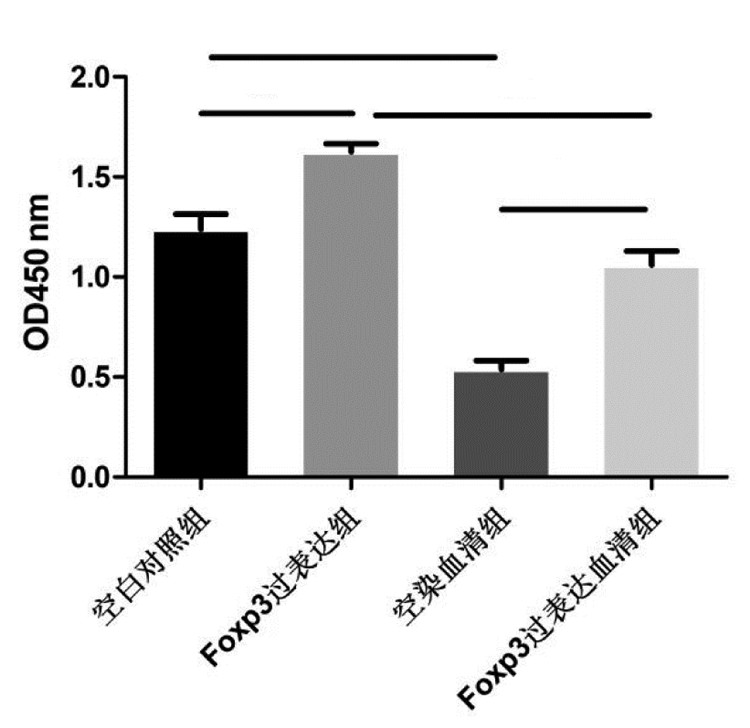
|
注:与空白对照组比较,*P < 0.01;与Foxp3过表达组比较,#P < 0.01;与空染血清组比较,△P < 0.01。
图 2 CCK8法检测细胞活性(  |
Foxp3过表达组与空白对照组相比、Foxp3过表达血清组与空染血清组相比, β-catenin、c-Myc、cyclinD1的蛋白表达量均增加(P < 0.01)而Caspase-3的蛋白表达量均降低(P < 0.05或P < 0.01);空染血清组与空白对照组相比、Foxp3过表达血清组与Foxp3过表达组相比, β-catenin、c-Myc、cyclinD1相对表达量均下降而Caspase-3的蛋白表达量均增高(P < 0.01)。见图 3。
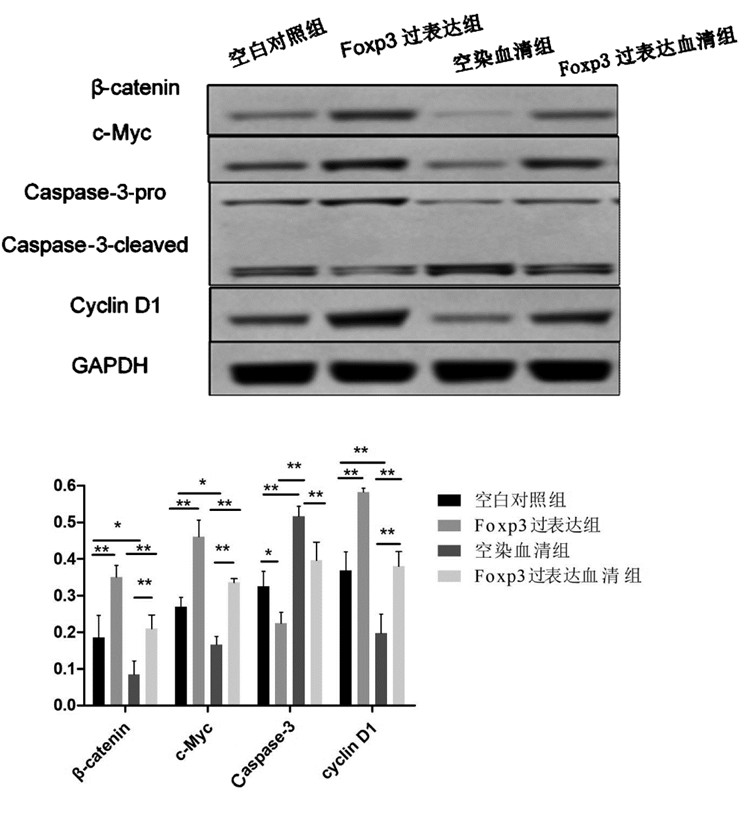
|
注:与空白对照组比较,*P < 0.05,**P < 0.01;与Foxp3过表达组比较,#P < 0.01;与空染血清组比较,△P < 0.01。
图 3 Western Blot法检测Foxp3下游信号分子的表达(  |
Foxp3是调控Treg细胞发育功能的关键转录分子[8-9]。有研究证实[10-11], Foxp3突变可能导致免疫反应受损, 并促进自身免疫疾病发展, 减弱对某些肿瘤和感染的免疫。Huang等[12]发现Foxp3在宫颈癌肿瘤细胞中的表达水平较高, 约为91.56%, 且Foxp3表达水平与肿瘤大小及FIGO分期明显相关, 因此Foxp3可能是预测宫颈癌患者治疗效果的有用生物标志物。
经典Wnt/β-catenin信号通路的异常激活会导致β-catenin不被降解, 在核内堆积, 促进下游靶基因, 如c-Myc和cyclinD1等的转录, 引起细胞增殖/分化失控, 使细胞过度增殖恶化[13-14]。c-Myc和cyclinD1作为重要的细胞周期调控蛋白, 在细胞增殖、细胞周期规则表达中发挥重要作用。Caspase-3则是经典凋亡中的一种重要蛋白, 由内源性(线粒体)和外源性(死亡配体)凋亡通路激活, 参与经典的卵裂后凋亡通路, 他们均与恶性肿瘤的抑制密切相关[15-16]。
金哲教授以"攻毒散结"为法, 研制出中药清毒栓, 在治疗HPV感染引起的宫颈癌及宫颈上皮内瘤变等方面取得了较为满意的临床效果[17]。前期课题研究发现清毒栓可能是通过阻断细胞从G0~G1期向S期分化及促进其凋亡而达到抑制肿瘤的作用[6], 也可能抑制Treg对细胞毒T淋巴细胞(CTL)中相关蛋白的上调来改变局部免疫微环境而达到抑制肿瘤的作用[18]。Foxp3作为Treg重要的转录因子, 对维持其功能起重要作用, 清毒栓的抗肿瘤作用机制是否与其有关, 有待研究。Ghasemi等[19]研究证实, Wnt/β-catenin信号通路异常表达与宫颈癌的发生、发展密切相关, 清毒栓是否通过该通路起作用, 也有待证实。实验检测了不同组别SiHa细胞中Foxp3蛋白水平及其细胞活性, 并对Foxp3下游信号分子进行检测, 目的是研究Foxp3在SiHa细胞中的影响以及在清毒栓诱导的SiHa活性下调中的角色, 进一步阐明清毒栓的作用机制与Treg细胞及Foxp3的关系, 从而为中药预防HPV相关宫颈癌的发生提供更加充足的理论依据。
实验采用Western Blot法检测分别经空白血清及15%含药血清处理的过表达质粒组及空载质粒组的Foxp3及其下游信号分子β-catenin、c-Myc、cyclinD1、Caspase-3的表达, 并用CCK8法检测4组细胞的活性。过表达质粒组与相应的空白质粒组相比, Foxp3的表达量均增高, SiHa细胞的活性均增高, 说明已成功建立稳定的Foxp3过表达SiHa细胞株, 且Foxp3过表达可促进宫颈癌SiHa细胞的增殖。含药血清处理的组别较相应的对照组Foxp3的表达量和SiHa细胞的活性均降低, 说明清毒栓含药血清可抑制SiHa细胞中Foxp3的表达并可抑制SiHa细胞活性。15%含药血清处理的Foxp3过表达质粒组与空白血清处理的空白质粒组两组比较无统计学意义, 表明通过过表达可逆转含药血清导致的Foxp3表达下调, 可改变含药血清的药效, 从而说明含药血清通过Foxp3起到调节作用。对Foxp3下游信号分子的检测发现, Foxp3可以显著增加β-catenin、c-Myc、cyclinD1含量并抑制Caspase-3剪切, 且可以抑制含药血清诱导的β-catenin、c-Myc、cyclinD1含量下调以及Caspase-3剪切增加, 说明清毒栓含药血清是通过调节Foxp3影响β-catenin通路而发挥调节作用的。
综上所述, Foxp3可通过激活β-catenin通路促进细胞增殖和抑制细胞凋亡来增加SiHa细胞活性, 在SiHa细胞中扮演着原癌基因角色, 而清毒栓含药血清可能通过调节Foxp3影响β-catenin通路从而抑制SiHa细胞活性。本研究结果进一步阐明了清毒栓提取物通过调节Foxp3抑制SiHa细胞活性的机制, 为日后研发有效的抗肿瘤中药提供一定的思路及理论依据, 但β-catenin、cyclinD1和c-Myc不能完全解释细胞周期调控的精确机制, 进一步研究细胞周期调控的机制可能会给宫颈癌的治疗带来突破性进展。
| [1] |
王宁, 刘硕, 杨雷, 等. 2018全球癌症统计报告解读[J]. 肿瘤综合治疗电子杂志, 2019, 5(1): 87-97. WANG N, LIU S, YANG L, et al. Interpretation of 2018 global cancer statistics report[J]. Journal of Multidisciplinary Cancer Management(Electronic Version), 2019, 5(1): 87-97. |
| [2] |
李聪聪, 朱莉. 宫颈癌的病因及宫颈癌疫苗现状[J]. 现代肿瘤医学, 2008, 26(20): 3333-3336. LI C C, JU L. Etiology of cervical cancer and status of cervical cancer vaccine[J]. Journal of Modern Oncology, 2008, 26(20): 3333-3336. |
| [3] |
宫志萍, 刘成, 李杰, 等. 调节性T细胞与肺癌的关系研究进展[J]. 世界最新医学信息文摘, 2018, 18(45): 59-63. GONG Z P, LIU C, LI J, et al. Research progress on the relationship between regulatory T cells and lung cancer[J]. World Latest Medical Information, 2018, 18(45): 59-63. |
| [4] |
刘智慧. Foxp3+Treg及免疫抑制因子PD-L1在宫颈病变微环境中的表达[J]. 现代免疫学, 2018, 38(4): 310-314. LIU Z H. Expression of Foxp3+Treg and immunosuppressive factor pd-l1 in the micro environment of cervical lesions[J]. Modern Immunology, 2018, 38(4): 310-314. |
| [5] |
SHOHEI H. Lineage stability and phenotypic plasticity of Foxp3+ regulatory T cells[J]. Immunological Reviews, 2014, 259(1): 159-172. |
| [6] |
楼姣英, 金哲, 李云波. 清毒栓血清药对宫颈癌SiHa细胞凋亡及周期的影响[J]. 北京中医药, 2008, 27(7): 563-565. LOU J Y, JIN Z, LI Y B. Effect of serum antitoxin suppository on apoptosis and cycle of SiHa cells in cervical cancer[J]. Beijing Journal of Traditional Chinese Medicine, 2008, 27(7): 563-565. |
| [7] |
楼姣英, 金哲, 李洋. 中药清毒栓对宫颈癌SiHa细胞产生免疫相关细胞因子的影响[J]. 中国现代医生, 2017, 55(30): 33-36, 40. LOU J Y, JIN Z, LI Y. Effects of qingdu suppositor on the production of immune-related cytokines in SiHa cells of cervical cancer[J]. Modern Chinese Doctor, 2017, 55(30): 33-36, 40. |
| [8] |
DAO T, MUN S S, SCOTT A C, et al. Depleting T regulatory cells by targeting intracellular Foxp3 with a TCR mimic antibody[J]. Oncoimmunology, 2019, 8(7): 1570778. |
| [9] |
WANG X, LANG M, ZHAO T, et al. Cancer-FOXP3 directly activated CCL5 to recruit FOXP3+ Treg cells in pancreatic ductal adenocarcinoma[J]. Oncogene, 2017, 36(21): 3048-3058. |
| [10] |
CEZAR-DOS-SANTOS F, FERREIRA R S, OKUYAMA N C, et al. Foxp3 immuno regulatory gene variants are independent predictors of human papilloma virus infection and cervical cancer precursor lesions[J]. Journal of Cancer Research and Clinical Oncology, 2019, 145(8): 2013-2025. |
| [11] |
韩丽芳, 赵昌林. 肝癌微环境中FOXP3+调节性T细胞对肿瘤免疫抑制作用的研究[J]. 中国现代医药杂志, 2019, 21(2): 9-12. HAN L F, ZHAO C L. Effect of FOXP3+ regulatory T cells on tumor immunosuppression in hepatocellular carcinoma microenvironment[J]. Modern Medicine Journal of China, 2019, 21(2): 9-12. |
| [12] |
HUANG C, ZHOU L, CHANG X, et al. B7-H3, B7-H4, Foxp3 and IL-2 expression in cervical cancer:associations with patient outcome and clinical significance[J]. Oncology Reports, 2016, 35(4): 2183-2190. |
| [13] |
王香青, 马振军, 包洪云, 等. microRNA-145在宫颈癌中的表达及其对Wnt/β-catenin信号通路的抑制作用[J]. 中国肿瘤临床, 2019, 46(3): 117-121. WANG X Q, MA Z J, BAO H Y, et al. Expression of microrna-145 in cervical cancer and its inhibitory effect on Wnt/β-catenin signaling pathway[J]. Chinese Journal of Clinical Oncology, 2019, 46(3): 117-121. |
| [14] |
秦贝贝, 李亚青, 李小丽, 等. Wnt/β-catenin通路关键分子在NK/T细胞淋巴瘤组织中的表达及其临床意义[J]. 吉林大学学报(医学版), 2015, 41(2): 230-234, 438. QIN B B, LI Y Q, LI X L, et al. Expression and clinical significance of Wnt/β-catenin pathway key molecules in NK/t-cell lymphoma[J]. Journal of Jilin University (Medical Edition), 2015, 41(2): 230-234, 438. |
| [15] |
GANG Z, XIN G X. miR-205 promotes proliferation and invasion of laryngeal squamous cell carcinoma by suppressing CDK2AP1 expression[J]. Biological Research, 2015, 48(1): 48-60. |
| [16] |
童佳兵, 张星星, 韩明向, 等. 芪玉三龙方调节Wnt/β-catenin通路下游靶基因表达抑制荷瘤小鼠肺癌生长[J]. 中华中医药杂志, 2018, 33(5): 2014-2017. TONG J B, ZHANG X X, HAN M X, et al. Qiyu Sanlong Formula regulates the expression of Wnt/β-catenin pathway downstream target gene to inhibit the growth of lung cancer in tumorigenesis mice[J]. Chinese Journal of Traditional Chinese Medicine, 2018, 33(5): 2014-2017. |
| [17] |
金哲, 宋爱武, 李仁杰. 清毒栓治疗宫颈人乳头瘤病毒感染的临床研究[J]. 中国中西医结合杂志, 2002, 22(10): 735-737. JIN Z, SONG A W, LI R J. Clinical study on the treatment of cervical human papillomavirus infection with detoxification suppository[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2002, 22(10): 735-737. |
| [18] |
楼姣英, 曹颖, 金哲. 中药对SiHa-CTL-Treg共培养体系中CTL细胞CTLA-4、PD-1蛋白的影响[J]. 北京中医药大学学报, 2014, 37(4): 227-230. LOU J Y, CAO Y, JIN Z. Effects of traditional Chinese medicine on ctl-4 and pd-1 proteins of CTL cells in SiHa-CTL-Treg co-culture system[J]. Journal of Beijing University of Chinese Medicine, 2014, 37(4): 227-230. |
| [19] |
GHASEMI F, SHAFIEE M, BANIKAZEMI Z, et al. Curcumin inhibits NF-kB and Wnt/β-catenin pathways in cervical cancer cells[J]. Pathology-Research and Practice, 2019, 215(10): 152556. |
2. Dongfang Hospital, Beijing University of Chinese Medicine, Beijing 100078, China
 2020, Vol. 37
2020, Vol. 37




