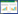文章信息
- 刘娜, 袁金凤, 彭诗涛, 柴冲冲, 王靖越, 张凯, 李欣欣, 李飞
- LIU Na, YUAN Jinfeng, PENG Shitao, CHAI Chongchong, WANG Jingyue, ZHANG Kai, LI Xinxin, LI Fei
- 基于militarine含量结合UPLC指纹图谱的不同产地白及饮片质量分析
- Quality analysis of Bletilae Rhizoma slices from different producing areas based on the militarine content determination and establishment of fingerprint by UPLC
- 天津中医药, 2020, 37(5): 583-589
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(5): 583-589
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.05.20
-
文章历史
- 收稿日期: 2019-12-28
白及为兰科植物白及Bletilla striata(Thunb.)Reichb.f.的干燥块茎,具有收敛止血,消肿生肌的功效[1]。白及的主要成分为白及多糖、联苄类、二氢菲类、菲类、联菲类、黄酮类等[2-5],主要有止血、抗菌、抗肿瘤、抗炎镇痛、促进创伤愈合和抑制黑色素生成等药理作用[6-10]。2015年版《中华人民共和国药典》未对白及的质控成分有所规定。现代研究表明,1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(militarine)具有益智和延缓衰老,防治老年痴呆的功能,且含量较高,是白及中的主要化学成分之一[11-12]。白及主产于华东、中南、西南及甘肃、陕西等地,以贵州产量最大,质量最优,有学者[13-15]对不同产地的白及药材指纹图谱进行了研究,结果表明不同产地的白及药材相似度在0.540~1.000,说明各产地白及药材质量存在明显差异。唐修静等[16]以militarine及浸出物含量为指标,对白及炮制过程中的软化方法进行研究,结果表明蒸透切片militarine及浸出物含量高于煮透切片和润透切片。饶文霞等[17]发现白及蒸制后烘干法干燥的白及饮片多糖含量高于真空冻干法,生切片则相反。现行《中华人民共和国药典》及全国各省市中药饮片炮制规范收载的白及饮片炮制工艺不尽相同,炮制工艺在一定程度上影响饮片质量。中药饮片质量与中医临床疗效密切相关,随着白及在各领域的广泛应用,白及饮片的质量控制和评价方法愈来愈重要。目前关于白及的质量研究多侧重于原药材,饮片的研究较少,中药的疗效是多种成分的综合作用,单一成分往往难以全面反映其内在质量,因此,本研究拟通过测定白及饮片中的militarine含量,结合其指纹图谱检测,采用多元统计方法对收集到的不同产地的24批白及饮片进行分析,为白及饮片质量控制提供参考依据。
1 仪器与试剂药物 1.1 仪器Waters ACQUITY超高效液相色谱仪(UPLC)(美国沃特世科技有限公司,TUV检测器,Empower色谱工作站);SB25-12DTDN型超声波清洗器(宁波新芝生物科技股份有限公司);BT-25S型电子分析天平(北京赛多利斯仪器有限公司);Thermo Sorvall Micro 17R微量离心机[赛默飞世尔科技(中国)有限公司]。
1.2 试剂药物militarine(上海同田生物科技有限公司,批号58139-23-4,纯度≥98%);乙腈为色谱纯(美国Fisher公司);纯净水(杭州娃哈哈集团有限公司);其余试剂均为分析纯(北京化工厂)。共收集到5个产地24批白及市售饮片,各样品来源信息见表 1。由北京中医药大学中药学院杨瑶珺教授鉴定为兰科植物白及干燥块茎的加工品。
ACQUITY UPLCⓇBEH C18色谱柱(2.1 mm×150 mm,1.7 μm)。以乙腈为流动相A,纯水为流动相B,进行梯度洗脱(0~5 min,2%~6%A;5~7 min,6%~10%A;7~8 min,10%~16%A;8~9 min,16%~19%A;9~14 min,19%~23%A;14~17 min,23%~30%A;17~25 min,30%~31%A;25~26 min,31%A;26~29 min,31%~55%A;29~34 min,55%A)。分析时间34 min,流速0.3 mL/min,检测波长270 nm,柱温46 ℃,进样量2 μL,理论塔板数不低于100 000。
2.2 对照品溶液的制备取militarine对照品适量,精密称定,加50%甲醇溶解,摇匀,制成每1 mL含对照品1.6 mg的溶液,即得。
2.3 供试品溶液的制备取白及饮片,粉碎过4号筛,称取粉末1 g,精密称定,置锥形瓶中,精密加入50%甲醇25 mL[18],称定质量,超声处理40 min(功率600 W,频率40 Hz),放置至室温,用50%甲醇补足减失的质量,摇匀,滤过,10 000 r/min离心10 min,即得。
2.4 含量测定方法学考察 2.4.1 线性关系考察精密吸取2.2项下militarine对照品溶液0.1、0.2、0.4、0.8、1.2、1.6、2.0 mL,置2 mL容量瓶中,用50%甲醇稀释至刻度,分别精密吸取上述稀释后的对照品溶液各2 μL,按2.1项下色谱条件进行测定,以峰面积为纵坐标(Y),militarine浓度为横坐标(X),绘制标准曲线,得回归方程。militarine回归方程Y=723 038X-1 883.9,r=0.999 9,militarine在1.617~3.234 μg有良好的线性关系。
2.4.2 精密度实验取S1号样品,按2.3项下方法制备供试品溶液,按2.1项下色谱条件测定,连续进样6次,每次2 μL,测定militarine的峰面积,计算RSD为0.15%,表明仪器精密度良好。
2.4.3 重复性实验取S1号样品6份,按2.3项下方法制备供试品溶液,按2.1项下色谱条件,测定militarine的峰面积,计算RSD为0.15%,表明本方法重复性良好。
2.4.4 稳定性实验取S1号样品,按2.3项下方法制备供试品溶液,按2.1项下色谱条件,分别于0、2、4、8、12、24 h进样2 μL,测定militarine的峰面积,计算RSD为0.29%,表明供试品溶液在24 h内稳定。
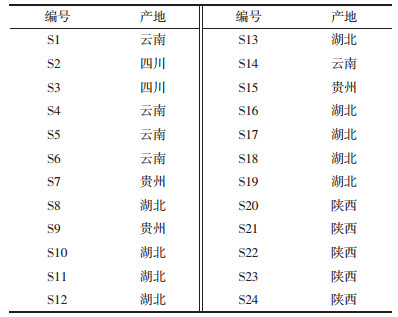
2.4.5 加样回收率实验取已知含量白及饮片粉末6份,每份约0.5 g(militarine含量6.86 mg/g),精密称定,分别精密加入对照品适量,按照2.3项下供试品溶液制备方法制备,2.1项下色谱条件测定militarine的峰面积,计算其含量,结果见表 2,平均回收率为101%,RSD为0.70%,表明该方法准确可靠。
取S1号样品,按2.3项下方法制备供试品溶液,按2.1项下色谱条件测定,连续进样6次,每次2 μL。测得各共有峰相对保留时间RSD小于0.45%,相对峰面积RSD小于3.69%,相似度大于0.999,表明仪器精密度良好。
2.5.2 重复性实验取S1号样品6份,按2.3项下方法制备供试品溶液,按2.1项下色谱条件测定,每次进样2 μL。测得各共有峰相对保留时间RSD小于0.48%,相对峰面积RSD小于4.68%,相似度大于0.989,表明此方法重复性良好。
2.5.3 稳定性实验取S1号样品,按2.3项下方法制备供试品溶液,按2.1项下色谱条件,分别于0、2、4、8、12、24 h进样2 μL,测得各共有峰相对保留时间RSD小于0.97%,相对峰面积RSD小于3.88%,相似度大于0.993,表明供试品溶液在24 h内稳定。
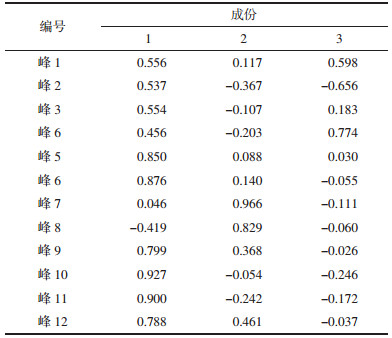
2.6 测定方法取白及饮片样品,按照2.3项下供试品溶液制备方法制备,分别量取对照品溶液和供试品溶液2 μL,按2.1项下色谱条件测定,即得。对照品及样品色谱图见图 1。
|
| 注:A.对照品色谱图,B.样品色谱图,1.militarine。 图 1 对照品及样品的色谱图 Fig. 1 UPLC chromatogram of reference and samples |
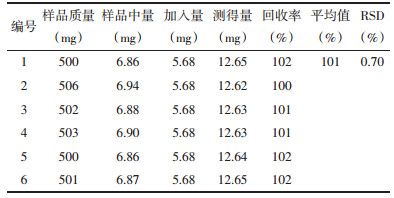
取白及饮片样品,按照2.6项下测定方法测定,计算样品含量,militarine含量测定结果见表 3。
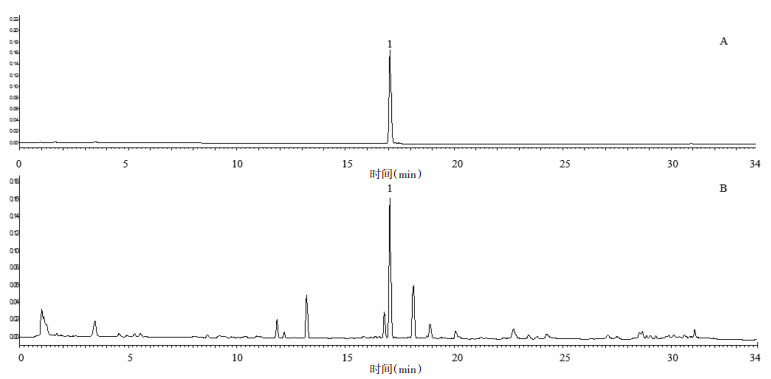
取24批不同产地白及饮片,按照2.3项下方法制备供试品溶液,采用2.1项下色谱条件进行检测。将得到的24个色谱图导入国家药典委员会“中药色谱指纹图谱相似度评价系统”(2012.1版)软件进行处理。由于S1号样品的色谱峰分离度和峰型较好,且基线稳定,故选择S1为参照图谱,时间窗宽度为0.1,选用平均数法,多点校正后进行全谱峰匹配,并生成白及饮片对照图谱(R)。24批白及饮片UPLC指纹图谱和对照指纹图谱分别见图 2、3。

|
| 图 2 24批白及饮片指纹图谱和对照图谱 Fig. 2 The UPLC fingerprintand control map of 24 batches of Bletilae Rhizoma slices |
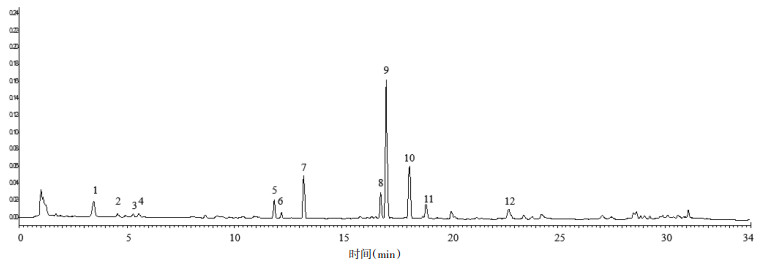
|
| 图 3 白及饮片对照指纹图谱 Fig. 3 Control fingerprint of Bletilae Rhizoma slices |
根据匹配结果得出,24批白及饮片共识别出12个共有峰。其中9号峰(17.111 min)为所有样品共有,且分离度较好,峰位相对居中,峰面积较大,与对照品比对,此峰为白及中联苄类成分之一,1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(militarine),故以此峰作为参照峰计算其余共有峰的相对峰面积和相对保留时间。不同产地白及饮片的各共有峰相对保留时间RSD在0%~3.72%之间,各共有峰相对峰面积RSD在0%~76.96%之间。
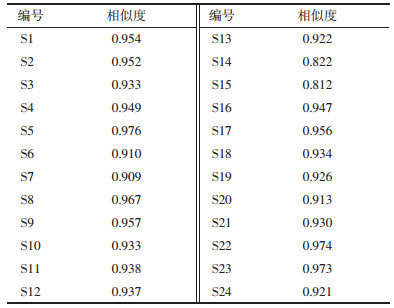
3.3 白及饮片指纹图谱结果分析 3.3.1 相似度分析采用国家药典委员会“中药色谱指纹图谱相似度评价系统”(2012.1版)软件,以平均数法,时间窗为0.1,以S1样品为参照图谱,计算各样品的相似度,结果见表 4。
|
以24批白及饮片指纹图谱中12个共有峰标准化处理后的峰面积作为变量,采用SPSS 22.0统计分析软件,运用组间联接法,选取平方Euclidean距离作为度量标准对样品进行系统聚类,结果见图 4。结果显示24批样品可分为四大类,其中S9、S16、S17、S18、S8、S14等6个样品聚为一类,S20、S21分别独自聚为一类,其余16个样品聚为一类。
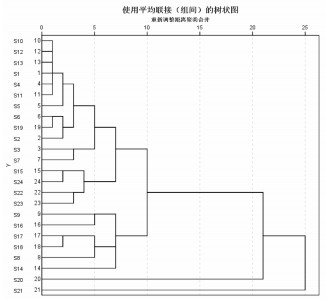
|
| 图 4 24批白及饮片指纹图谱聚类树状关系 Fig. 4 Cluster tree diagram of fingerprint of 24 batches of Bletilae Rhizoma slices |
主成分分析法是一种从众多原始指标之间相互关系入手,寻找少数综合指标以概括原始指标信息的多元统计方法,可以充分利用已有的数据信息进行综合分析。运用SPSS 22.0软件对24批不同产地白及饮片指纹图谱中共有峰的峰面积作为变量进行主成分分析。KMO和Bartlett球形检验结果表明,KMO为0.698,说明数据适合做因子分析。以特征值应大于1为依据,提取了3个主成分,3个主成分的方差贡献率分别是55.108%、19.154%、8.644%,累积方差贡献率是82.907%,3个特征值分别是6.613、2.299、和1.037。
24批白及饮片成分矩阵见表 5。第1主成分的主要信息来自色谱峰10,第2主成分的主要信息来自色谱峰7,第3主成分的主要信息来自色谱峰6,其中9号峰为militarine。主成分结果表明色谱峰6、7、10均为关键成分,而现有市场难以买到白及其他标准品,无法对这3个关键成分进行定性,故采用分别计算其相对mitarine含量的方法进行进一步分析,并计算各批次样品中这3个化合物以及militarine共4个关键成分的总相对含量,结果见表 6。
| mg/g | |||||||||||||||||||||||||||||
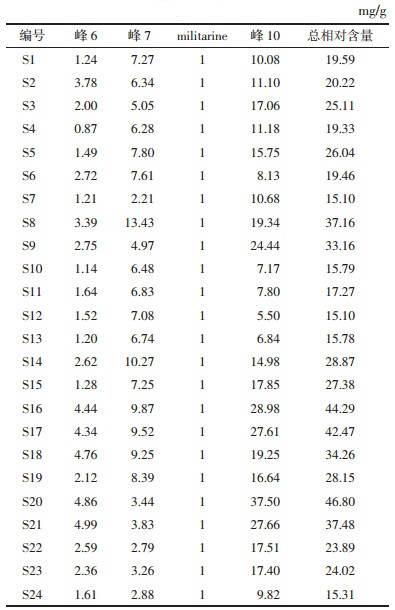
| |||||||||||||||||||||||||||||
根据主成分得分,运用SPSS 22.0软件进行3-D散点图进行分类,分析结果见图 5。主成分分析分类结果表明,S8、S9、S14、S16、S17、S18、S19等6个样品聚为一类,S20、S21分别聚为一类,其余16个样品聚为一类。主成分分析分类结果与聚类分析结果基本一致,从而验证了聚类分析结果的可靠性。
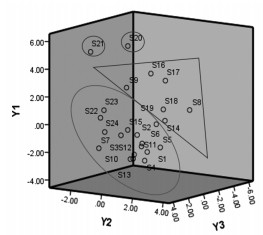
|
| 图 5 主成分分析图 Fig. 5 Principal component analysis diagram |
本研究参照相关文献[18-19]对提取方式和提取溶剂进行考察,发现其供试品溶液的制备均采用回流提取的方式,未对超声提取进行考察,且提取溶剂多为50%甲醇,基于此本研究考察了回流和超声两种提取方式以及不同浓度甲醇(40%、50%、60%、70%)作为提取溶剂对指纹图谱的影响,发现以50%甲醇超声提取方式制备的样品指纹图谱整体峰形较好。同时本实验通过对223 nm[20],270 nm[14]和280 nm[18] 3种吸光度下白及饮片指纹图谱进行对比分析,发现当吸光度为270 nm时,militarine峰形较好,且指纹图谱峰数目较多,能更为全面的反映白及饮片整体信息。
研究表明,24批白及饮片militarine含量在18.98~44.87 mg/g之间,其中S15(贵州)含量低于20.00 mg/g;S8(湖北)与S9(贵州)、S17(湖北)、S21(陕西)4个批次含量高于40.00 mg/g,其余19个批次含量均在20.00~40.00 mg/g之间,表明不同批次的白及饮片militarine含量存在一定的差异。
通过相似度比较,24批白及饮片指纹图谱相似度在0.812~0.976之间,除S14与S15两批样品相似度低于0.9,其余各批次饮片与对照图谱的相似度均在0.9以上,占样品数的92%,表明24批白及饮片的整体质量基本稳定。S14样品militarine含量高达37.25 mg/g,相似度结果仅为0.822,表明单一成分含量高低与相似度大小的分析结果不一致。
以12个共有峰峰面积进行聚类,结果显示24个样本可分为4类,编号为S9、S16、S17、S18、S8、S14的6个批次样品聚为一类,S20、S21分别聚为一类,其余16个批次样品的militarine含量和指纹图谱中4个关键成分的总相对含量均较低,聚为一类。主成分分析结果表明不能以单一成分评价饮片质量,且其分类结果与聚类分析结果一致,与相似度大小关系不大。
5 结论综上,本研究建立了白及饮片中militarine含量的测定方法,同时建立了白及饮片UPLC指纹图谱。通过运用成分测定、指纹图谱结合化学计量学对不同产地的24批白及饮片进行分析,从单一成分到多个成分含量,再到总体相似度,从多维度分析,认为以其主要成分mitarine含量结合指纹图谱对白及饮片质量进行评价,具有一定的科学性和可行性,为白及饮片质量标准的制定提供了参考依据。
| [1] |
国家药典委员会. 中华人民共和国药典(一部)[M]. 北京: 中国医药科技出版社, 2015: 103. Chinese Pharmacopoeia Commission. Chinese pharmacopoeia(Part 1)[M]. Beijing: China Medical Science Press, 2015: 103. |
| [2] |
汤逸飞, 阮川芬, 应晨, 等. 白及属植物化学成分与药理作用研究进展[J]. 中草药, 2014, 45(19): 2864-2872. TANG Y F, RUAN C F, YING C, et al. Research progress on chemical constituents and pharmacological actions of Bletilla striata[J]. Chinese Traditional and Herbal Drugs, 2014, 45(19): 2864-2872. |
| [3] |
寇泽琪, 闫德彪, 冯锋, 等. 天然联苄类化合物研究进展[J]. 海峡药学, 2013, 25(9): 1-6. KOU Z Q, YAN D B, FENG F, et al. Advances in studies on the natural bibenzyls[J]. Strait Pharmaceutical Journal, 2013, 25(9): 1-6. |
| [4] |
Kovács A, VASAS A, HOHMANN J. Natural phenanthrenes and their biological activity[J]. Phytochemistry, 2008, 69(5): 1084-1110. |
| [5] |
戴鸥, 仰莲, 周勤梅, 等. 白及化学成分分离鉴定[J]. 中国实验方剂学杂志, 2018, 24(14): 43-47. DAI O, YANG L, ZHOU Q M, et al. Chemical constituents from tubers of Bletilla striata[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(14): 43-47. |
| [6] |
上官艳妮, 李林, 潘胤池, 等. 白及组织培养及其药理作用的研究进展[J]. 时珍国医国药, 2019, 30(7): 1706-1709. SHANGGUAN Y N, LI L, PAN Y C, et al. Research progress in tissue culture and pharmacological activities of Bletilla striata[J]. Lishizhen Medicine and Materia Medica Research, 2019, 30(7): 1706-1709. |
| [7] |
饶文龙, 张浩, 张熹玮, 等. 白及药理作用研究进展[J]. 上海中医药杂志, 2015, 49(8): 91-93. RAO W L, ZHANG H, ZHANG X W, et al. Research progress of pharmacological actions of Bletillae Rhizoma[J]. Shanghai Journal of Traditional Chinese Medicine, 2015, 49(8): 91-93. |
| [8] |
吕洪乐, 张同华, 李倩. 白及多糖药理作用的研究进展[J]. 中国药房, 2015, 26(28): 4014-4016. LV H L, ZHANG T H, LI Q. Research progress on pharmacological action of Bletilla striata polysaccharide[J]. China Pharmacy, 2015, 26(28): 4014-4016. |
| [9] |
蒋福升, 李美芽, 盛振华, 等. 白及提取物对炎症因子抑制活性的谱效关系分析[J]. 中药材, 2018, 41(11): 2655-2661. JIANG F S, LI M Y, SHENG Z H, et al. Spectrum-effect relationship of extracts from Bletilla striata on inflammatory factors inhibit activities[J]. Journal of Chinese Medicinal Materials, 2018, 41(11): 2655-2661. |
| [10] |
刘佳琪, 可燕, 蒋嘉烨, 等. 白及多糖对酪氨酸酶活性及黑色素生成的影响[J]. 上海中医药大学学报, 2018, 32(5): 50-54. LIU J Q, Ke Y, Jiang J Y, et al. Effects of Bletilla striata polysaccharide on tyrosinase activity and melanin formation[J]. Academic Journal of Shanghai University of Traditional Chinese Medicine, 2018, 32(5): 50-54. |
| [11] |
张晓静, 赵艳霞, 邓雁如, 等. HPLC同时测定白及中3种成分的含量[J]. 中国实验方剂学杂志, 2015, 21(21): 40-42. ZHANG X J, ZHAO Y X, DENG Y R, et al. Simultaneous determination of three components in Bletillae Rhizoma by HPLC[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2015, 21(21): 40-42. |
| [12] |
李敏, 郭顺星, 王春兰, 等. 2-异丁基苹果酸葡萄糖氧基苄酯类化合物在兰科植物中的分布特点及药理活性[J]. 中国药学杂志, 2010, 45(10): 724-726. LI M, GUO S X, WANG C L, et al. Distribution and pharmacological activity of 2-isobutyl malate glucosyl benzyl esters compounds in Orchidaceae[J]. Chinese Pharmaceutical Journal, 2010, 45(10): 724-726. |
| [13] |
刘刚, 丁志山, 刘育辰, 等. 白及药材的HPLC指纹图谱建立及聚类分析[J]. 中国药房, 2018, 29(22): 3050-3053. LIU G, DING Z S, LIU Y C, et al. Establishment on HPLC fingerprint of Bletilla striata and their cluster analysis[J]. China Pharmacy, 2018, 29(22): 3050-3053. |
| [14] |
陈景, 阎婷, 贾景明. 多省区白及高效液相色谱指纹图谱研究[J]. 中国医院用药评价与分析, 2017, 17(2): 218-221. CHEN J, YAN T, JIA J M. Research on HPLC fingerprint of Blerillae Rhizoma from multiple provinces[J]. Evaluation and Analysis of Drug-Use in Hospitals of China, 2017, 17(2): 218-221. |
| [15] |
迟明艳, 黄勇, 李勇军, 等. UPLC结合化学计量学方法的白及指纹图谱分析[J]. 中国实验方剂学杂志, 2016, 22(14): 51-56. CHI M Y, HUANG Y, LI Y J, et al. Fingerprint of Bletilae Rhizoma by UPLC coupled with chemometrics methods[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2016, 22(14): 51-56. |
| [16] |
唐修静, 张羽斌, 文运, 等. 不同炮制方法对白及中militarine及浸出物含量的影响[J]. 中国实验方剂学杂志, 2014, 20(7): 67-69. TANG X J, ZHANG Y B, WEN Y, et al. Different effect with different processing methods on chemical constituents of Bletillae Rhizoma[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(7): 67-69. |
| [17] |
饶文霞, 张敏, 林菁, 等. 白及真空冻干法与烘干法工艺条件优化对比[J]. 黑龙江农业科学, 2019(4): 81-85. RAO W X, ZHANG M, LIN J, et al. Optimising and comparative of vacuum freeze-drying and oven drying method of Bletilla striata[J]. Heilongjiang Agricultural Sciences, 2019(4): 81-85. |
| [18] |
王爱民, 鄢艳, 兰波, 等. UPLC同时测定白及药材中9种指标成分的含量[J]. 中国中药杂志, 2014, 39(11): 2051-2055. WANG A M, YAN Y, LAN B, et al. Simultaneous determination of nine chemical markers of Bletilla striata by ultra performance liquid chromatography[J]. China Journal of Chinese MateriaMedica, 2014, 39(11): 2051-2055. |
| [19] |
梅朝叶, 向文英, 杨武, 等. UPLC-MS/MS同时测定白及中6个指标成分的含量[J]. 天然产物研究与开发, 2016, 28(8): 1233-1237. MEI C Y, XIANG W Y, YANG W, et al. Simultaneous determination of six components in Bletilla striata by UPLC-MS/MS[J]. Natural Product Research and Development, 2016, 28(8): 1233-1237. |
| [20] |
何迅, 王爱民, 李勇军, 等. HPLC测定白及中militarine含量[J]. 中国中药杂志, 2009, 34(16): 2076-2078. HE X, WANG A M, LI Y J, et al. Determination of militarinein Rhizoma striata by HPLC[J]. China Journal of Chinese Materia Medica, 2009, 34(16): 2076-2078. |
 2020, Vol. 37
2020, Vol. 37