文章信息
- 杨剑, 韩立峰, 邵睿, 张鹏, 郝佳, 常艳旭, 高秀梅, 王涛
- YANG Jian, HAN Lifeng, SHAO Rui, ZHANG Peng, HAO Jia, CHANG Yanxu, GAO Xiumei, WANG Tao
- 中成药抑制成纤维细胞胶原沉积的作用研究
- Study of the effect of marketed Chinese patent medicine on inhibiting collagen deposition in fibroblasts models
- 天津中医药, 2020, 37(6): 618-622
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(6): 618-622
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.06.06
-
文章历史
- 收稿日期: 2020-03-06
2020年初新型冠状病毒肺炎(简称新冠肺炎)的突发给中国人民健康和经济发展带来了巨大打击。该疫情被世界卫生组织列为国际关注的公共突发卫生事件。短短两个月事件造成全国7万余人感染,3 000余人死亡,疫情波及30个国家,引起了世界范围的恐慌。
近年世界范围多次出现病毒性呼吸道传播疾病,包括2003年严重急性呼吸综合征(SARS)、2009年H7N9流感、2012年中东呼吸综合征(MERS)等相关疫情。疾病发生频率逐渐加快,病毒变异迅速,从常规抗病毒化学药物、疫苗研发规律来看,临床有效治疗药物缺乏,治疗手段难以及时跟进。如何发挥中医药防疫抗病能力成为中医药研究者的重要课题。
在新型冠状病毒感染后,体液中迅速大量产生多种细胞因子,形成细胞因子风暴,导致人体免疫系统紊乱,引起急性呼吸窘迫综合征、多器官衰竭等症[1]。细胞因子风暴需药物及时干预,以避免过多的组织液肺部渗出,影响呼吸功能[2]。大量临床证据证实,病毒侵染呼吸系统,造成肺损伤后可引起肺纤维化。SARS流行期间,有45%的患者在感染后1个月肺部表现出“毛玻璃”外观。跟踪病例研究显示,有27.8%的SARS幸存者肺功能下降,肺纤维化程度增加。肺纤维化是病毒性肺炎患者恢复期的常见后遗症,缺乏有效临床治疗药物。
本研究收集了多种上市中成药,筛选抗成纤维细胞胶原沉积活性药物,为病毒感染肺损伤者的愈后干预提供科学依据。
1 实验部分 1.1 仪器与材料KO-250E超声波清洗器,昆山市超声仪器有限公司;IKA RV 10旋转蒸发仪,德国IKA公司;Milli-Q超纯水制备仪,Millpore公司;超声裂解仪,宁波新芝生物科技有限公司;DC300F倒置相差显微镜,德国Leica公司;多功能酶标仪,Tecan公司;倒置显微镜,日本Nikon公司;NIH-3T3小鼠胚胎成纤维细胞株及MRC5人源成纤维细胞株均来自ATCC;转化生长因子-β1(TGF-β1),R&D system公司;SB431542,美国Selleck公司;DMEM培养基、胎牛血清均购于美国Gibco公司;1%青/链霉素,美国HyClone公司;乙醇、二甲基亚砜(DMSO)等化学试剂均为分析纯,天津康科德科技有限公司。
1.2 中成药提取收集多种上市中成药,粉碎后(喷雾剂使用原料)以10倍70%乙醇溶液(W/V)超声提取30 min,4 000 g离心10 min,离心半径为150 mm,吸取上清液,40 ℃减压浓缩至干,干燥粉末以100 mg/mL浓度溶于DMSO中,备用。
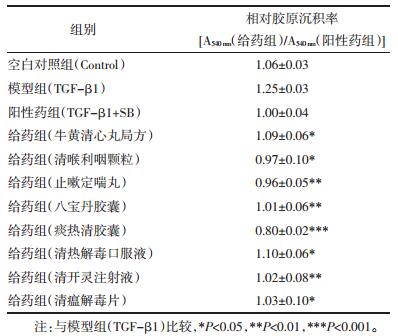
1.3 成纤维细胞胶原含量检测参考文献方法[3],收集对数生长期细胞,以1×105/mL将鼠源胚胎成纤维NIH-3T3细胞,人源肺成纤维化MRC5细胞接种到96孔板中,以含10%胎牛血清的DMEM完全培养基在37 ℃,5% CO2环境下培养,过夜后更换为无血清培养基。同步化24 h后,用TGF-β1(5 ng/mL)处理48 h为模型组,用TGF-β1+SB431542(TGF-β1抑制剂,终浓度5 μmol/L)作为阳性药组,TGF-β1+ 100 μg/mL(终浓度,DMSO浓度为0.1%)不同中成药提取物为给药组,空白对照组直接加培养基100 μL培养。48 h后弃去孔中培养基,并用200 μL PBS洗涤细胞3次,用-20 ℃冰甲醇固定过夜后,200 μL PBS洗涤3次,每孔加入100 μL天狼星红试剂,室温避光放置4 h,弃去游离的天狼星红,每孔用200 μL的0.01%乙酸洗涤3次后风干,加入200 μL 0.1 mol/L NaOH,振荡1 h后应用多功能酶标仪在540 nm处进行吸光度的测定。相对胶原沉积率= A540 nm(给药组)/A540 nm(阳性药组)。包括模型组、阳性药组、空白对照组、给药组在内的每组样品都平行进行了4次复孔实验。
1.4 统计学方法使用SPSS 20.0统计软件,实验数据用均数±标准差(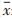
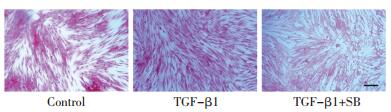
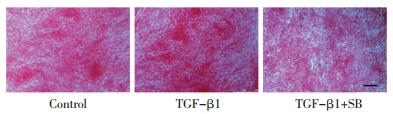
肺成纤维细胞贴壁同步化后,通过TGF-β1诱导48 h,经天狼星红染色,镜下可见明显胶原沉积。阳性对照药,TGF-β1抑制剂SB431542(SB,终浓度5 μmol/L)可有效降低胶原沉积(人源肺成纤维细胞胶原沉积模型,见图 1;鼠源胚胎纤维细胞胶原沉积模型,见图 2),说明本实验体系建立成功。各中成药提取物在本实验设计浓度下,镜下未见细胞形态及密度明显改变。
|
| 注:Control为空白对照组,TGF-β1为模型组,TGF-β1+SB为阳性药组;bar值为50 μm。 图 1 人源肺成纤维细胞胶原沉积模型构建 Fig. 1 Human-derived lung fibroblast collagen deposition model |
|
| 注:Control为空白对照组,TGF-β1为模型组,TGF-β1+SB为阳性药组;bar值为50 μm。 图 2 鼠源胚胎成纤维细胞胶原沉积模型构建 Fig. 2 Murine-derived fibroblast collagen deposition model |
与空白对照组相比,TGF-β1诱导人源肺成纤维细胞胶原沉积量上升约1.3倍,TGF-β1抑制剂SB431542(终浓度5 μmol/L)处理后能有效降低胶原沉积至正常水平。在100 μg/ mL浓度下,清喉利咽颗粒、止嗽定喘丸、清金止嗽化痰丸(天津中新药业乐仁堂制药厂,生产批号分别为0780974、15502235和0790104),六神丸(上海雷允上药业有限公司,生产批号为190601),复方一枝黄花喷雾剂(贵州百灵企业集团,生产批号为20200115),复方芩兰口服液(黑龙江珍宝岛药业股份有限公司,生产批号为B36200206001),八宝丹胶囊(厦门中药厂,生产批号为190630),痰热清胶囊(上海凯宝药业股份有限公司,生产批号为2001102),蒲地蓝消炎片、通宣理肺片、清瘟解毒片(天津中新药业隆顺榕制药厂,生产批号分别为190082、250001和220002)等11种中成药提取物能有效抑制胶原沉积(见表 1,图 3)。
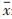


|
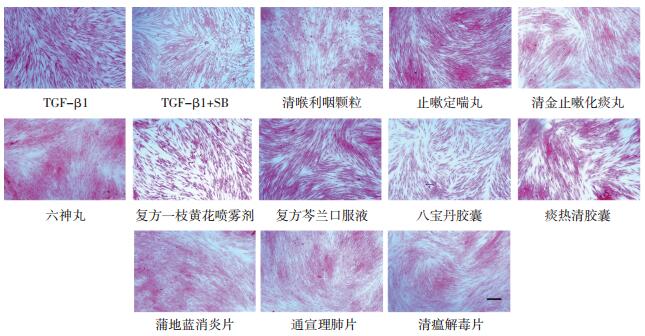
|
| 注:bar值为50 μm。 图 3 中成药提取物对人源肺成纤维细胞胶原沉积的抑制作用 Fig. 3 Inhibitory effect of Chinese patent medicine extract on collagen deposition of human-derived lung fibroblasts |
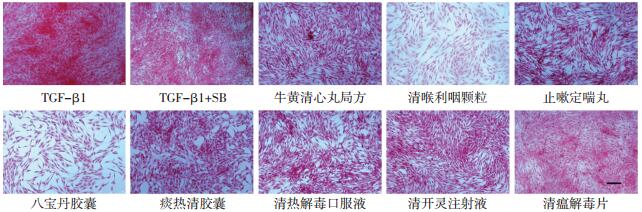
与空白对照组相比,TGF-β1诱导鼠源胚胎成纤维细胞胶原沉积量上升约1.2倍,TGF-β1抑制剂SB431542(终浓度5 μmol/L)处理后能有效降低胶原沉积至正常水平。在100 μg/mL浓度下,牛黄清心丸局方(天津中新药业达仁堂制药厂,生产批号190622),清喉利咽颗粒、止嗽定喘丸(天津中新药业乐仁堂制药厂,生产批号分别为0780974和15502235),八宝丹胶囊(厦门中药厂,生产批号为190630),痰热清胶囊(上海凯宝药业股份有限公司,生产批号为2001102),清热解毒口服液、清开灵注射液(神威药业集团,生产批号分别为1912271和20011601),清瘟解毒片(天津中新药业隆顺榕制药厂,生产批号为220002)等8种中成药提取物能有效抑制胶原沉积(表 2,图 4)。
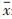
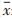
|
|
| 注:bar值为50 μm。 图 4 中成药提取物对鼠源胚胎成纤维细胞胶原沉积的抑制作用 Fig. 4 Inhibitory effect of Chinese patent medicine extract on collagen deposition of murine-derived lung fibroblasts |
在肺部炎症的损伤修复阶段,巨噬细胞调节炎症反应,并分泌转化生长因子TGF-β1和血小板衍生生长因子等,刺激成纤维细胞增殖,造成胞外基质重塑,胶原蛋白过度沉积,这个过程如果不加以药物干预,将发展为不可逆的肺纤维化,肺部会出现“毛玻璃”“蜂窝煤”状,导致呼吸困难甚至衰竭,严重影响患者生活质量。
目前,美国食品药品监督管理局(FDA)批准用于治疗肺纤维化的药物仅有吡非尼酮(细胞因子抑制剂)和尼达尼布(酪氨酸激酶抑制剂)[4],但这两种药物临床用量大,治疗成本高,且易出现耐药性,患者依从性差。目前为止,中国尚无治疗肺纤维化药物上市。中医认为,肺纤维化属于“肺痹”和“肺痿”的范畴,其病机在于气阴两虚,并兼有痰、瘀、热之邪。气滞而痰凝,脾虚而聚湿,阻于肺腔。中医治疗以益气养阴为主,活血化瘀为辅,补肺生津,标本兼治。临床证实,血府逐瘀汤、丹参饮合二陈汤、桑白皮汤[5]等具有一定临床治疗效果。
本研究从已上市中成药出发,寻找能有效抑制胶原沉积、阻碍肺纤维化发生发展的药物,以满足肺纤维化治疗的临床药物需求。在对纤维化考察的细胞水平实验中,人源肺成纤维细胞(MRC-5)和鼠源胚胎成纤维细胞(NIH-3T3)为体外实验常用的两种细胞系[6-7]。在纤维化的发展过程中,一部分纤维细胞分化为肌成纤维细胞,产生并积聚过量的胶原蛋白,胶原蛋白沉积会破坏肺部组织结构和功能,引发纤维化[8-9]。本实验所涉及的两种细胞模型,均首先通过TGF-β诱导活化后用天狼星红染色法检测细胞内胶原沉积,确定模型诱导成功,以此作为肺纤维化中胶原沉积的细胞模型。研究结果表明,清喉利咽颗粒、止嗽定喘丸、八宝丹胶囊、痰热清胶囊、清瘟解毒片5种中成药提取物,对鼠源、人源肺成纤维化细胞的胶原沉积均有抑制作用,提示这些上市中成药有应用于治疗肺纤维化的前景。
进一步对所有有效中成药组成药味进行分析,结果发现,黄芩、甘草、连翘、桔梗等饮片使用频率较高,通过文献查阅,对这4味药所含有的化学成分进行了整理,与本研究发现一致,如黄芩中的黄芩苷、黄芩素,甘草中的甘草酸[8]、甘草次酸,连翘中的连翘苷元、牛蒡子苷,桔梗根中的皂苷类成分等对纤维化有缓解作用[10-17]。
本研究正在持续进行,下一步将针对活性中成药开展体内研究,以明确其药效物质及作用机制,为临床治疗肺纤维化提供科学依据。
致谢:多家中药制药企业无私提供检测样品,在此表示衷心地感谢!由于时间仓促,本次仅报道了部分结果,后续研究将陆续报道,为疫情防控提供中医科技支撑。
| [1] |
LI G, FAN Y, LAI Y, et al. Coronavirus infections and immune responses[J]. Journal of Medical Virology, 2020, 92: 424-432. |
| [2] |
KIKKERT M. Innate immune evasion by human respiratory RNA viruses[J]. Journal of Innate Immunity, 2020, 12(1): 4-20. |
| [3] |
CHEN C, YANG S M, ZHANG M, et al. In vitro Sirius Red collagen assay measures the pattern shift from soluble to deposited collagen[J]. Advances in experimental medicine and biology, 2013, 765: 47-53. |
| [4] |
MOORTHY S, SEHGAL G. Pirfenidone and nintedanib for treatment of idiopathic pulmonary fibrosis[J]. Southern medical journal, 2017, 110(6): 393-398. |
| [5] |
宋远瑛. 血府逐瘀汤治疗老年特发性肺纤维化患者的临床疗效[J]. 实用临床医药杂志, 2016, 20(9): 155-159. SONG Y Y. Clinical efficacy of xuefu decoction in the treatment of elderly patients with idiopathic pulmonary fibrosis[J]. Journal of Clinical Medicine in Practice, 2016, 20(9): 155-159. |
| [6] |
KYUNG S Y, KIM D Y, YOON J Y, et al. Sulforaphane attenuates pulmonary fibrosis by inhibiting the epithelial-mesenchymal transition[J]. BMC Pharmacology and Toxicology, 2018, 19(1): 13. |
| [7] |
YUAN J L, LI P, PAN H H, et al. miR-542-5p Attenuates fibroblast activation by targeting integrin alpha6 in silica-Induced pulmonary fibrosis[J]. International Journal of Molecular Science, 2018, 19(12): 3717. |
| [8] |
WYNN T A. Common and unique mechanisms regulate fibrosis in various fibroproliferative diseases[J]. Journal of Clinical Investigation, 2007, 117(3): 524-529. |
| [9] |
NOBLE P W, BARKAUSKAS C E, JIANG D H. Pulmonary fibrosis:patterns and perpetrators[J]. Journal of Clinical Investigation, 2012, 122(8): 2756-62. |
| [10] |
HUANG X Y, HE Y C, CHEN Y F, et al. Baicalin attenuates bleomycin-induced pulmonary fibrosis via adenosine A2a rec eptor related TGF-β1-induced ERK1/2 si gnaling pathway[J]. BMC Pulmonary Medicine, 2016, 16(132): 1-11. |
| [11] |
王清华, 姚旭, 魏新智, 等. 黄芩苷对肺纤维化大鼠肺组织氧化应激的反应及炎症细胞的影响[J]. 中华中医药学刊, 2017, 35(6): 1382-1384. WANG Q H, YAO X, WEI X Z, et al. Impact of baicalin on oxidative stress and inflammatory cell in pulmonary fibrosis[J]. Chinese Archives of Traditional Chinese Medicine, 2017, 35(6): 1382-1384. |
| [12] |
HU Q, GAO L N, PENG B, et al. Baicalin and baicalein attenuate renal fibrosis in vitro via inhibition of the TGF-β1 signaling Pathway[J]. Experimental and Therapeutic Medicine, 2017, 14(4): 3074-3080. |
| [13] |
GAO L L, TANG H Y, HE H Y, et al. Glycyrrhizic acid alleviates bleomycin-induced pulmonary fibrosis in rats[J]. Frontiers in Pharmacology, 2015, 6: 215. |
| [14] |
金粟, 李士远, 陈芳宁, 等. 丹酚酸B、甘草次酸、白藜芦醇单用及联用对小鼠肺间质纤维化影响的实验研究[J]. 中华中医药学刊, 2016, 34(5): 1095-1098. JIN S, LI S Y, CHEN F N, et al. Single or combining use of salvianolic acid B, glycyrrhetinic acid and resveratrol on pulmonary fibrosis mice induced by bleomycin[J]. Journal of Chinese Archives of Traditional Chinese Medicine, 2016, 34(5): 1095-1098. |
| [15] |
王恩力, 姚景春, 刘铮, 等. 连翘苷元对大鼠免疫性肝纤维化的影响[J]. 药物评价研究, 2015, 38(2): 161-164. WANG E L, YAO J C, LIU Z, et al. Effect of forsythiaside on immunological hepatic fibrosis of rats[J]. Drug Evaluation Research, 2015, 38(2): 161-164. |
| [16] |
LEE S, SHIN S, KIM H, et al. Anti-inflammatory function of arctiin by Inhibiting COX-2 expression via NF-kappaB pathways[J]. Journal of Inflammation, 2011, 8(1): 16. |
| [17] |
CHOI J H, HWANG Y P, KIM H G, et al. Saponins from the roots of platycodon grandiflorum suppresses TGFβ1-induced epithelial-mesenchymal transition via repression of PI3K/Akt, ERK1/2 and Smad2/3 pathway in human lung carcinoma A549 cells[J]. Nutrition and Cancer, 2014, 66(1): 140-151. |
 2020, Vol. 37
2020, Vol. 37