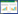文章信息
- 王亮, 李红伟
- WANG Liang, LI Hongwei
- 南葶苈子清炒前后高效液相指纹图谱研究
- Study of HPLC fingerprint of Descurainiae semen before and after stir-fry without additional ingredients
- 天津中医药, 2020, 37(6): 704-710
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(6): 704-710
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.06.24
-
文章历史
- 收稿日期: 2020-03-08
2. 河南中医药大学药学院, 郑州 450046
葶苈子始载于《神农本草经》,味辛、苦,性寒,主癥瘕积聚结气、饮食寒热、破坚逐邪、通利水道[1]。传统认为有甜、苦两种,2015版《中华人民共和国药典》规定其药用来源为十字花科植物播娘蒿Desurainia sophia(L.)Webb. ex Prantl(又称南葶苈子)和独行菜Lepidium apetalum Willd.(又称北葶苈子)的干燥成熟种子,前者称为甜葶苈,后者称为苦葶苈[2]。葶苈子的炮制方法以清炒炮制为主,最早见于张仲景《金匮要略》葶苈大枣泻肺汤中“葶苈熬令黄”[3],关于其炮制作用,清代唐宗海认为“不炒则不香,不能散,故必炒用”[4],目前临床认为“炒后药性缓和,免伤肺气”[5]。
南葶苈子中主要含有异硫氰酸及其硫苷、黄酮、脂肪油类成分,以及强心苷、三萜、甾醇、香豆素、生物碱、酚酸、挥发油、氨基酸等成分,对心血管、高血脂等疾病具有显著功效,所含的成分具有降压、抗癌、细胞毒、抗氧化等药理活性[6]。目前已有南葶苈子指纹图谱方面的研究报道[7-8],对其生品和清炒品的指标性成分检测多以槲皮素-3-O-β-D-葡萄糖-7-O-β-D-龙胆双糖苷和芥子碱硫氰酸盐含量测定为主[9-12],尚未见南葶苈子清炒品的指纹图谱研究。因南葶苈子临床传统用药以清炒品为主,因此本研究以槲皮素-3-O-β-D-葡萄糖-7-O-β-D-龙胆双糖苷和芥子碱硫氰酸盐为对照,分别建立南葶苈子生品和其清炒品的HPLC指纹图谱,通过相似度评价和对比研究,探讨南葶苈子清炒前后指纹图谱的变化,为实现南葶苈子清炒品生产过程质量控制、质量信息可追溯提供指纹图谱参考。
1 材料 1.1 仪器Agilent 1260 InfinityⅡ型高效液相色谱仪(美国安捷伦科技有限公司);KQ-500V型超声波清洗器(昆山市超声仪器有限公司);DZF-6020型真空干燥箱(嘉兴市中新医疗仪器有限公司);OSB-2100型旋转蒸发仪(上海爱朗仪器有限公司);HX-200型高速中药粉碎机(浙江省永康市溪岸五金药具厂);ME204万分之一电子天平(梅特勒·托利多仪器上海有限公司)。
1.2 试剂和药品甲醇为色谱纯(批号151282,规格4 L,纯度≥99.9%),乙腈为色谱纯(批号156275,规格4 L,纯度≥99.9%),赛默飞世尔科技(中国)有限公司;磷酸二氢钠分析纯(批号20180225,规格500 g,纯度≥99.5%),北京化工厂。南葶苈子样品采自河南郑州、安徽亳州、河北安国等地(S1~S12),计12个样本,经河南中医药大学董诚明教授鉴定为十字花科(Cruciferae)植物播娘蒿Descurainia sophia(L.)Webb ex Prantl的干燥成熟种子,见表 1。槲皮素-3-O-β-D-葡萄糖-7-O-β-D-龙胆双糖苷(批号PS14012301,规格20 mg,纯度≥98.0%),芥子碱硫氰酸盐(批号PS14031803,规格20 mg,纯度≥98.0%),成都普思生物科技股份有限公司。
|
色谱柱NUCLEODUR C18色谱柱(4.6 mm × 250 mm,5 μm),流动相为乙腈-0.01 mol/L NaH2PO4水溶液,梯度洗脱:0~6 min,1%~6% CH3CN;6~24 min,6%~15% CH3CN;24~32 min,15%~20% CH3CN;32~47 min,20%~28% CH3CN;47~52 min,28%~40% CH3CN;52~54 min,40%~40% CH3CN。流速1.0 mL/min,检测波长254 nm,柱温30 ℃,进样量5 μL,色谱分析时间54 min。
2.2 样品制备 2.2.1 南葶苈子生品制备取各批次南葶苈子药材,去除杂质,筛去灰屑,备用(S1~S12)[5]。
2.2.2 南葶苈子清炒品制备取净南葶苈子(S1~S12),置预热的锅内,用文火加热,炒至微鼓起,爆裂声减弱,并有香气逸出时,取出,放凉,备用(相对应炮制品P1~P12)[5]。
2.2.3 制备对照品溶液分别称取槲皮素-3-O-β-D-葡糖糖-7-O-β-D-龙胆双糖苷、芥子碱硫氰酸盐1.06、1.62 mg,用60%的甲醇溶解并稀释,槲皮素-3-O-β-D-葡糖糖-7-O-β-D-龙胆双糖苷浓度为21.2 μg/mL,芥子碱硫氰酸盐浓度为162.0 μg/mL,作为对照品溶液。
2.2.4 制备供试品溶液分别称取5.0 g南葶苈子生品、清炒品(折合生品质量),粉碎过60目筛,置250 mL具塞平底烧瓶中,加蒸馏水170 mL,超声波400 W,温度70 ℃提取30 min,提取液离心,取上清液,旋转蒸发仪蒸干,用甲醇溶解并转移至称量瓶中,于50 ℃下干燥呈浸膏状,真空干燥,恒质量[13]。精密称取干燥固体物50.00 mg,用60%甲醇溶解并定容至10 mL,0.45 μm微孔滤膜滤过,即为供试品溶液。
2.3 方法学考察 2.3.1 稳定性实验取南葶苈子生品或清炒品供试品溶液,分别于0、2、4、8、12、24 h进样5 μL,各主要色谱峰的相对保留时间RSD均小于2%,相对峰面积比值的RSD均小于3%,表明样品在24 h内稳定。
2.3.2 精密度实验取南葶苈子生品或清炒品溶液连续进样6次,每次5 μL,各主要色谱峰的相对保留时间均小于1%,相对峰面积比值的RSD均小于3%,表明仪器的精密度良好。符合指纹图谱的检测要求。
2.3.3 重复性实验取同批次饮片6份,分别精密称定,按“2.3.2”项下方法分别制备供试品溶液6份,分别进样检测。各主要色谱峰的相对保留时间均小于2%,相对峰面积比值的RSD均小于3%,符合指纹图谱的检测要求,表明方法的重复性良好。
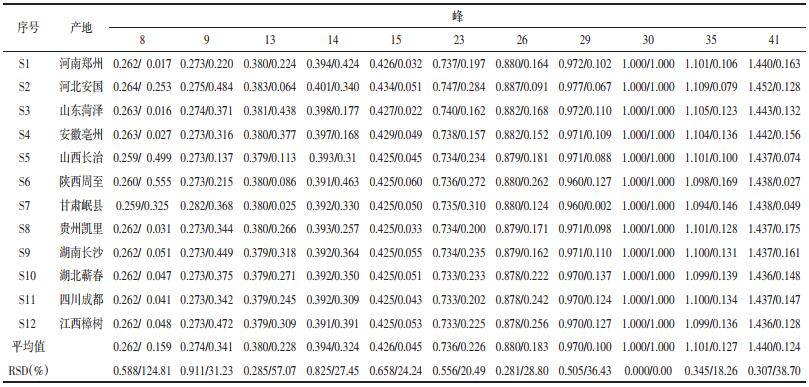
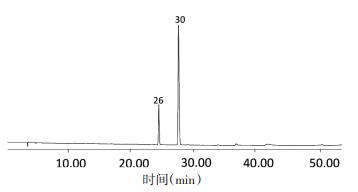
2.3.4 指纹图谱的建立 2.3.4.1 参照峰的确定按“2.1”项下的色谱条件,采集“2.3.1”项下所制备的混合对照品溶液色谱图,峰1为槲皮素-3-O-β-D-葡萄糖-7-O-β-D-龙胆双糖苷峰(峰标号26),峰2为芥子碱硫氰酸盐峰(峰标号30)。见图 1、2。
|
| 图 1 混合对照品HPLC色谱图 Fig. 1 HPLC chromatogram of mixed reference substances |
|
| 图 2 混合对照品(HB)与南葶苈子清炒品(Z1)HPLC叠加指纹图 Fig. 2 Overlaying HPLC fingerprint of mixed reference substances (HB) with processed Descurainiae semen (Z1) |
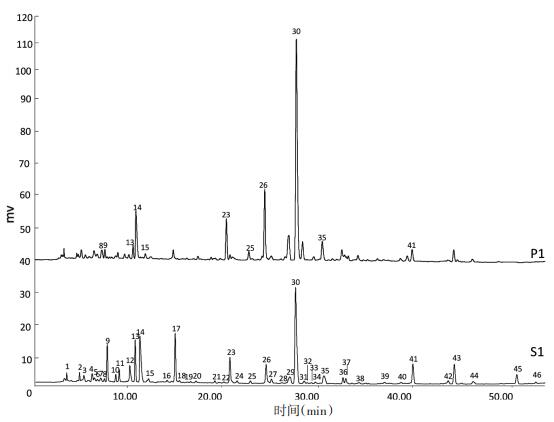
按2.1项下的色谱条件,分别采集12批南葶苈子生品、清炒品指纹图谱,标出其相同的共有峰,结果见图 3、4。因芥子碱硫氰酸盐峰相应值强,且分离度好,故以芥子碱硫氰酸盐为参照峰,计算其他共有峰的相对峰面积和保留时间,见表 1、2。
|
| 图 3 南葶苈子生品(S1)、清炒品(P1)共有峰HPLC图 Fig. 3 HPLC chromatogram of crude (S1) and processed (P1) Descurainiae Semen |
|
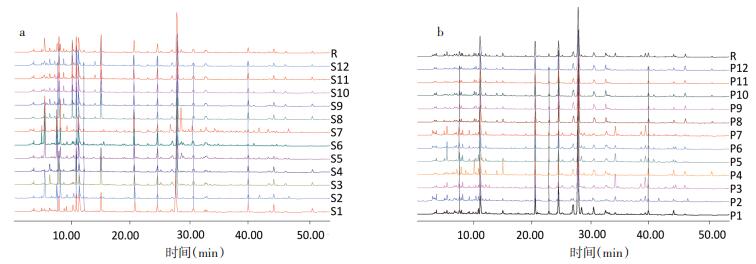
| 图 4 12批南葶苈子生品(a)、12批清炒品(b)HPLC叠加指纹图谱 Fig. 4 HPLC fingerprint of 12 batches of crude (a) and processed (b) Descurainiae semen |

|
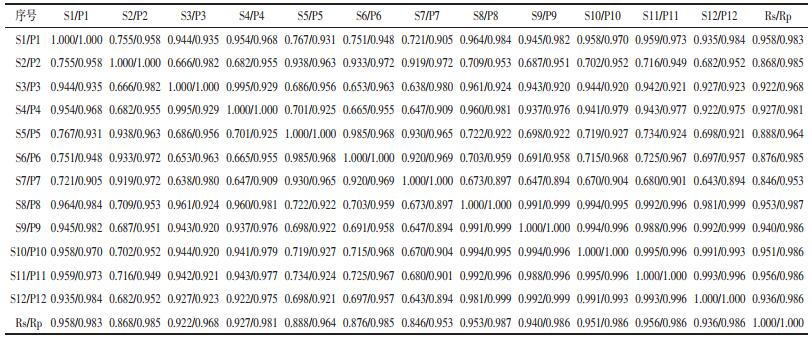
分别将12批南葶苈子生品、清炒品样品色谱指纹图谱数据,导入中药色谱指纹图谱相似度评价系统(2004A版),以S1为参照图谱,时间窗宽度为0.1,经多点校正后,中位数法生成对照图谱,生品和清炒品对照指纹图谱见图 4。采用相同方法计算生品和清炒品对照指纹图谱的相似度,见表 3。
|
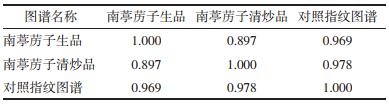
分别对南葶苈子、清炒南葶苈子HPLC指纹图谱进行相似度计算,见表 4。相似度结果表明,生品S1、S3、S4、S8、S9、S10、S11、S12样品间相似度良好,大于0.9,且与对照指纹图谱相似度均大于0.922。生品S2、S5、S6、S7样品间相似度良好,大于0.919,但与对照指纹图谱相似度小于0.9,与其他生品相似度在0.638~0.888之间,这表明这4批生品与其他生品存在一定的差异,这可能与其成长环境、干燥和贮藏条件等因素有关。清炒后,P1、P4、P8、P9、P10、P11、P12样品间相似度与对照指纹图谱相似度均大于0.92,相似度相比生品更好;P2、P5、P6、P7与对照指纹图谱相似度大于0.953,与其他样品相似度大于0.894,以上结果说明,南葶苈子生品间差异较大,大致归为两类,样品S2、S5、S6、S7为一类,其余样品为一类。清炒后,样品之间相似度得到显著改善,表明建立南葶苈子标准化生产工艺的必要性,清炒炮制能够从一定程度上缓解南葶苈子药间差异,因部分峰面积增大,造成差异减小。这对南葶苈子质量控制、药效一致性研究具有重要意义。
|
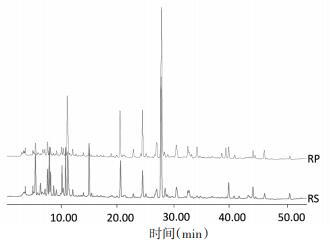
以1号样品S1和清炒后P1指纹图谱为例,对比清炒前后差异,见图 5。生品中峰面积大于0.25%的色谱峰有46个,其中色谱峰8、9、13、14、15、23、25、26、30、35、41为清炒前后共有峰。由图 3可看出,清炒后,0~20 min、42~54 min时间段内色谱峰峰面积减小,共有峰No.9、No.13、No.14、No.41峰面积降低,此段成分多为单糖、寡糖、氨基酸类成分(这些成分在254 nm无响应,同时结合紫外吸收和分子极性确定),结合清炒炮制质量标准要求颜色加深,表明此段成分发生了美拉德反应,从而使得清炒品颜色发生褐变、加深[14]。20~42 min时间段内色谱峰响应值增大,其中共有峰No.23、No.26、No.30、No.35峰面积相对生品均升高,非共有峰No.25峰面积升高,清炒工艺对南葶苈子化学成分有一定影响。
|
| 图 5 南葶苈子生品(RS)和清炒品(RP)对照指纹图谱 Fig. 5 Fingerprint common model HPLC of crude (RS) and processed(RP) Descurainiae semen |
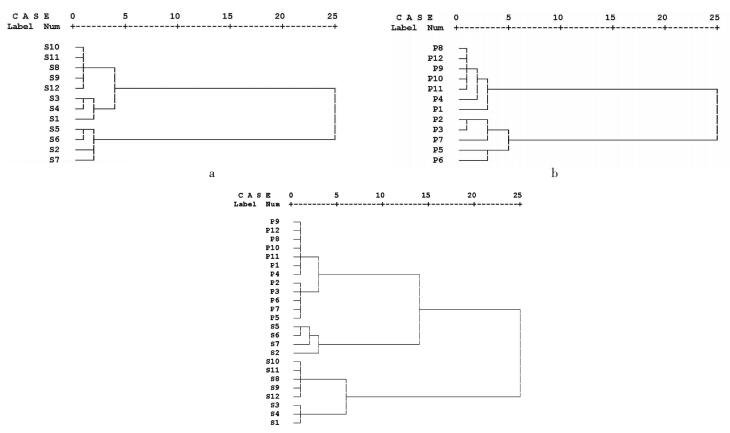
将12批南葶苈子和清炒南葶苈子作为研究对象,以芥子碱硫氰酸盐为参照峰,计算共有峰相对峰面积,以共有峰相对峰面积为变量,用SPSS 24.0统计软件,采用离差平方和法,对炮制前后指纹图谱进行聚类分析,见图 6。结果表明,从图 6(a)可看出当聚合距离为5时,生品葶苈子聚为两类,其中S1、S3、S4、S8、S9、S10、S11、S12聚为第1类,S2、S5、S6、S7聚为第2类,与相似度分析结果一致,表明建立的指纹图谱方法可靠。图 6(b)可看出清炒后南葶苈子聚为两类,除了3号样品由第1类归到第2类外,分类结果与生品一致,该结果表明,尽管炮制后12批清炒品相似度得到较大改善,但样品P2、P5、P6、P7与其他样品仍有差别,该结果为相似度评价结果互为补充。从图 6(c)12批南葶苈子生品和其清炒品的聚类分析图中可看出,当聚合距离为10时,南葶苈子12批次清炒品聚为一类,这表明清炒后的南葶苈子和生品有明显区别,清炒工艺对南葶苈子的质量控制具有显著作用;生品S2、S5、S6、S7聚为一类,其他生品聚类一类,此结果与图 6(c)结果一致,表明生品S2、S5、S6、S7与其他生品有区别。
|
| 图 6 12批南葶苈子生品(a)、清炒品(b)及二者比较(c)系统聚类分析图 Fig. 6 System clutering analysis chart of 12 batches crude(a), processed(b) and their compare(c) of Descurainiae semen |
本研究首次采用HPLC指纹图谱比较南葶苈子生品与其清炒品化学指纹图谱的差异,结合相似度评价、系统聚类分析法,不仅能对南葶苈子生品和清炒品进行快速准确鉴别,并且能够准确发现两者的区别。所采用的色谱条件重复性好,易于控制,结果直观可靠,方法简便易行,快速有效,可为南葶苈子生品和清炒品的质量评价提供依据。
选用水作为提取溶剂,符合南葶苈子临床用药的水煎煮的特点,利用超声提取,避免了南葶苈子水煎煮容易糊锅的现象,提取工艺采用了超声水提取优化工艺[13]。采用二极管阵列检测器(DAD)采集190~400 nm范围内的响应值,通过供试品溶液3D图谱发现,在254 nm条件下,色谱峰响应值较高,峰形对称,峰数较多,分离度较好,基线较为平稳,最终选择254 nm为检测波长。流动相选择,结合参考文献[13],并进一步的考察优化,选择了乙腈-0.01 mol/L NaH2PO4水溶液为洗脱流动相,优化洗脱程序,基线平稳,色谱峰分离度较好,出峰时间较为适中。故确定流动相为乙腈-0.01 mol/L NaH2PO4水溶液。
目前文献记载南葶苈子的指纹图谱,存在所得图谱共有峰数目少,重复性差等[8]。本实验优化南葶苈子的高效液相指纹图谱测定条件,建立南葶苈子清炒品的指纹图谱。比较南葶苈子生品、清炒品的指纹图谱发现,清炒后南葶苈子通过共有模式建立、相似度评价以及HPLC指纹图谱比较,表明南葶苈子清炒炮制后的HPLC指纹图谱与生品差异较大,清炒后,0~20 min时间段内色谱峰响应值减小,20~42 min时间段内色谱峰响应值增大,如色谱峰槲皮素-3-O-β-D-葡萄糖-7-O-β-D-龙胆双糖苷峰(26)、芥子碱硫氰酸盐峰(30),表明清炒炮制对南葶苈子化学成分的溶出有一定的影响。生品HPLC指纹图谱部分批次间差异较大,与其产地来源、加工、干燥、贮藏养护、包装等因素有关,建议尽快建立和完善南葶苈子产地的道地性,产地加工、干燥工艺、贮藏养护、包装工艺规范化和质量标准化。
对于南葶苈子清炒品和生品的HPLC指纹图谱研究还存在不足之处,下一步应扩大样本量,严格按照GMP要求,在控制其产地加工、干燥、贮藏养护、包装等条件下,建立其标准化HPLC指纹图谱或特征图谱,甚至不同产地的HPLC指纹图谱或特征图谱;运用高效液相-质谱联用、超高效液相-质谱联用技术,对南葶苈子清炒炮制前后化学成分进行指认,结合多级质谱裂解技术,探讨其清炒炮制对其化学成分的影响,阐明其清炒机制。
| [1] |
顾观光, 杨鹏举. 神农本草经[M]. 北京: 学苑出版社, 2007. GU G G, YANG P J. Shennong's Herbal Classic of Materia Medica[M]. Beijing: Xueyuan Press, 2007. |
| [2] |
国家药典委员会.中华人民共和国药典2015年版一部[S].北京: 中国医药科技出版社, 2015. State Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China, 2015 edition, Volume 1[S]. Beijing: China Medical Science Press, 2015. |
| [3] |
范永升. 金匮要略[M]. 北京: 中国中医药出版社, 2003: 117-118. FAN Y S. Synopsis of the Golden Chamber[M]. Beijing: China Press of Traditional Chinese Medicine, 2003: 117-118. |
| [4] |
张伯龙, 唐容川, 黄杰熙. 本草问答评注[M]. 太原: 山西科学教育出版社, 1991: 87-88. ZHANG B L, TANG R C, HUANG J X. Commentary on the question and answer of Materia Medica[M]. Taiyuan: Shanxi Science and Education Press, 1991: 87-88. |
| [5] |
龚千峰. 中药炮制学[M]. 北京: 中国中医药出版社, 2013: 197-263. GONG Q F. Traditional Chinese Medicine Processing[M]. Beijing: China Press of Traditional Chinese Medicine, 2013: 197-263. |
| [6] |
李红伟, 郑晓珂, 弓建红, 等. 独行菜和播娘蒿化学成分及药理作用研究进展[J]. 药物评价研究, 2013, 36(3): 235-240. LI H W, ZHENG X K, GONG J H, et al. Research progress in chemical constituents of Lepidium apetalum and Descurainia sophia and their pharmacological activities[J]. Drug Evaluation Research, 2013, 36(3): 235-240. |
| [7] |
周喜丹, 唐力英, 周国洪, 等. HPLC指纹图谱鉴别葶苈子与车前子[J]. 中国中药杂志, 2015, 40(2): 275-279. ZHOU X D, TANG L Y, ZHOU G H, et al. Discrimination of Descurainiae Semen and Pantagirus Semen by HPLC fingerprints[J]. China Journal of Chinese Materia Medica, 2015, 40(2): 275-279. |
| [8] |
王爱芹, 王秀坤, 李军林, 等. 南葶苈子HPLC指纹图谱的测定[J]. 中药材, 2005, 28(4): 285-287. WANG A Q, WANG X K, LI J L, et al. Determination of HPLC fingerprint of Lepidia australis[J]. Journal of Chinese Medicinal Materials, 2005, 28(4): 285-287. DOI:10.3321/j.issn:1001-4454.2005.04.011 |
| [9] |
李进冉, 黄文华, 郭宝林, 等. 南葶苈子药材含量标准的研究[J]. 药物分析杂志, 2010, 30(5): 950-953. LI J R, HUANG W H, GUO B L, et al. Research on chemical content standard of Semen Descurainiae[J]. Chinese Journal of Pharmaceutical Analysis, 2010, 30(5): 950-953. |
| [10] |
马梅芳, 吕文海. 高效液相色谱法测定南葶苈子饮片中芥子碱硫氰酸盐含量[J]. 中国药业, 2008, 17(5): 14-15. MA M F, LV W H. Determination of Sinapine Thiocyanate in processed Pieces of Semen Lepidii by HPLC[J]. China pharmaceuticals, 2008, 17(5): 14-15. DOI:10.3969/j.issn.1006-4931.2008.05.010 |
| [11] |
马梅芳, 李芳. HPLC法测定不同产地南葶苈子中芥子碱硫氰酸盐的含量[J]. 中华中医药学刊, 2010, 28(9): 1995-1997. MA M F, LI F. Determination of Sinapine Thiocyanate in Descurainia Sophia (L.) Webb ex Prantl from different regions by HPLC[J]. Chinese Archives of Traditional Chinese Medicine, 2010, 28(9): 1995-1997. |
| [12] |
王爱芹, 王秀坤, 闫兴丽, 等. HPLC测定南葶苈子中槲皮素-3-O-β-D-葡萄糖-7-O-β-D-龙胆双糖苷的含量[J]. 中国中药杂志, 2004, 29(10): 959-961. WANG A Q, WANG X K, YAN X L, et al. Determination of quercetin-3-O-β-D-glucopyranosyl-7-O-β-D-gentiobioside in Semen Descurainiae by HPLC[J]. China Journal of Chinese Materia Medica, 2004, 29(10): 959-961. DOI:10.3321/j.issn:1001-5302.2004.10.010 |
| [13] |
李红伟, 王婷婷, 孟祥乐, 等. 响应面法优化炒南葶苈子配方颗粒提取工艺[J]. 中国新药杂志, 2016, 25(24): 2831-2838. LI H W, WANG T T, MENG X L, et al. Optimized extraction process of formula granules for seeds from Desurainia sophia fried without additional ingredients by Box-Behnken response surface method[J]. Chinese Journal of New Drugs, 2016, 25(24): 2831-2838. |
| [14] |
周逸群, 贺福元, 杨岩涛, 等. 美拉德反应研究现状及对中药炮制和制剂工艺研究方法的影响[J]. 中草药, 2014, 45(1): 125-130. ZHOU Y Q, HE F Y, YANG Y T, et al. Research situation of Maillard reaction and its influence on research methods for processing and preparation process of Chinese materia medica[J]. Chinese Traditional and Herbal Drugs, 2014, 45(1): 125-130. |
2. School of Pharmacy, Henan University of Chinese Medicine, Zhengzhou 450046, China
 2020, Vol. 37
2020, Vol. 37