文章信息
- 吕彬, 谭旺晓, 刘潇, 王小莹, 高秀梅
- LYU Bin, TAN Wangxiao, LIU Xiao, WANG Xiaoying, GAO Xiumei
- 补骨脂“雷公炮制法”减毒的科学内涵
- Scientific connotation of attenuation of Psoralea corylifolia by "Leigong processing method"
- 天津中医药, 2020, 37(9): 976-983
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(9): 976-983
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.09.05
-
文章历史
- 收稿日期: 2020-05-26
2. 天津中医药大学中药学院, 天津 301617
中药补骨脂,又名破故纸、胡韭子、和兰苋,是豆科一年生直立草本补骨脂(Psoralea corylifolia L.)的干燥成熟果实[1],其性温,味辛、苦,归肾、脾经,具有温肾助阳,纳气平喘,温脾止泻的功效,主要用于治疗肾阳不足,阳痿遗精,遗尿尿频,腰膝冷痛,肾虚作喘,五更泄泻;外用治疗白癜风及斑秃[2]。现代药理学研究发现,补骨脂具有雌激素样作用[3],能够增加骨密度,多用于治疗骨质疏松[4];此外,补骨脂还有抗肿瘤、抗应激、抗血栓形成等作用[5-7],在临床上应用较为广泛。补骨脂生品性燥,易伤阴助火,具有一定的毒副作用[8-9],因此临床上多使用其炮制品。《普济本事方》《本草纲目》等医学古籍中对补骨脂应用的记载也均以其酒制品和炒制品为主,生品使用较少。补骨脂炮制方法始见于《雷公炮炙论》,曰:“凡使,性本大燥,毒,用酒浸一宿,漉出,却用东流水浸三日夜,却蒸从巳至申出,日干用。”[10]后世医家在雷公法的基础上发展出盐炙、酒浸、清炒等炮制方法[11]。其中,酒浸炒法始见于宋代《太平惠民和剂局方》;元代《瑞竹堂经验方》记载补骨脂炮制方法为“酒浸一宿,焙干”;明代至清代的炮制方法主要是用水浸泡后再蒸三时[12]。其余古籍如《太平圣惠方》《本草乘雅半偈》等也对补骨脂炮制方法有所记载。《雷公炮炙论》中提出补骨脂炮制的目的是为了解燥毒[13],后世如《太平惠民和剂局方》中记载的盐炒法、《经史证类备急本草》中提到的“入药微炒用”等,也均以减燥毒为目的[12]。《中国药典》中收载的补骨脂炮制方法为盐炙法[2],中药炮制理论提到入盐走肾,盐炙法能够增强补骨脂补肾纳气的功效[14],在临床应用中也主要以其盐制品为主[11]。有学者对补骨脂不同炮制品有效成分补骨脂素进行了含量测定,发现雷公法炮制品中补骨脂素的含量远高于盐炙品,认为盐炙法不是最佳的炮制方法[15-16]。现代对于补骨脂雷公炮制方法描述为将补骨脂浸泡于黄酒中1 d,之后滤去黄酒,以清水浸泡药材3 d,经过滤、沥干后,置于锅中隔水蒸6 h后取出,晒干。研究表明[17],经雷公法炮制后,补骨脂毒性明显降低,可能与其炮制前后化学成分的变化有关。在现代炮制的研究中,为了优化炮制工艺,通常是先选择药物中某几种主要成分作为标志性成分,再以不同方法对药物进行炮制,并根据标志性成分的含量差异对炮制工艺进行筛选,而炮制前后标志性成分的变化在炮制原理的研究中意义重大[18]。笔者从炮制前后化学成分的变化分析雷公炮制法对补骨脂的影响,以探究雷公炮制法减毒的机制。
1 补骨脂肝损伤的相关化学成分研究有关补骨脂的毒性记载始见于南北朝的《雷公炮炙论》,“性本大燥,毒”。《本草新编》中虽未言明补骨脂具有毒性,但指出补骨脂“其性过于燥”“不可轻用”。其余古籍文献中皆未见明确的补骨脂毒性记载,但对其燥性均有一定的描述,提出补骨脂性“大温而燥”,历代医家均认为“阴虚火旺者忌服”。近年来,随着对补骨脂研究的深入,且临床对于补骨脂不良反应的报道越来越多,补骨脂用药的安全性也引起了广泛的关注。娄鑫等[19]建立了一种新的有毒中药分级方法,将补骨脂归为“能导致毒性中药”;现代医药典籍如《中药大辞典》《中华本草》等对于补骨脂毒性也均有所记载。
现代药理学研究表明,补骨脂主要毒性为肝脏毒性。据报道[20],长期给予大剂量补骨脂生药,对大鼠肝脏和肾脏功能均造成一定损害。补骨脂能够造成小鼠肝细胞坏死,血清中谷氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)及炎症因子表达上升,并引起肝细胞线粒体膜电位的降低[21]。补骨脂化学成分较为复杂,自1933年分离出第1个单体成分补骨脂素起[22],至今已分离并鉴定出80余种化学成分,主要包括香豆素类、苯并呋喃苷类、黄酮类及单萜酚类化合物[23]。其中,补骨脂苷、异补骨脂苷等苷类成分主要分布于种子中,补骨脂酚和黄酮类成分存在于补骨脂果皮中,补骨脂素、异补骨脂素等脂溶性香豆素在果皮和种子中均有分布[24]。补骨脂中的主要成分(异)补骨脂素、(异)补骨脂苷均存可造成一定程度上的肝损伤,是补骨脂肝毒性的主要来源。补骨脂中主要化学成分见图 1。
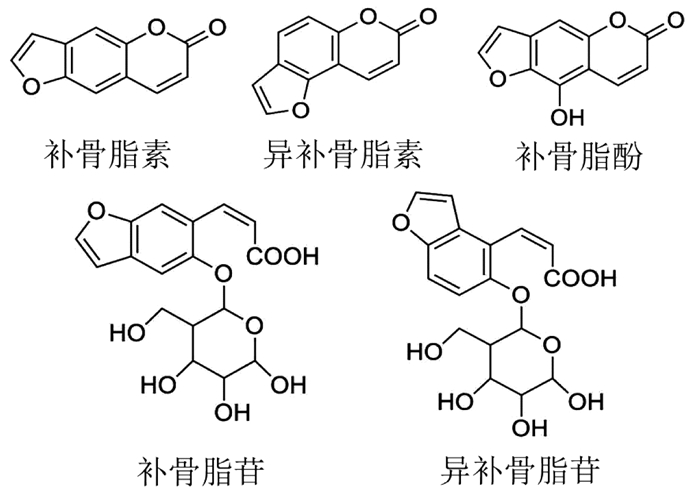
|
| 图 1 补骨脂中主要化学成分结构图 Fig. 1 Structure of main chemical components in Psoralea corylifolia |
近年来,关于补骨脂造成肝损伤的临床报道屡见不鲜。2005年,韩国1例44岁妇女以补骨脂泡茶饮用,产生急性胆汁淤积性肝损害,患者有黄疸表现,肝穿刺显示肝脏有明显坏死[25]。2001年和2008年,国家药品不良反应监测中心两次通报壮骨关节丸(含补骨脂素0.532 mg/g,异补骨脂素0.518 mg/g[26])能够造成肝损害,目前已有研究证实其造成肝损伤的成分为乳香、没药和补骨脂[27]。2006年报道1例22岁男性患者使用驱白巴布期片(维药,含补骨脂素1.15 mg/片,异补骨脂素0.91 mg/片[28])和补骨脂注射液(含补骨脂素18.66 μg/mL,异补骨脂素36.55 μg/mL[29])后,出现黄疸和肝脏生化异常,停药9周后检测肝脏生化正常,后经毒理学分析,引起肝损伤的药物成分主要为补骨脂中的成分[30]。2018年报道1例49岁男性患者使用驱白巴布期片联合补骨脂颗粒治疗白癜风,用药1个月后患者血清中ALT、AST及谷氨酰转移酶(GGT)表达明显升高,给予保肝药9周后检测肝脏生化指标恢复正常,推测补骨脂为引起该患者肝损伤的主要药物,其原因可能与两药联用导致补骨脂剂量加大有关[31]。夏叶等[32]在研究中发现,使用加味青娥方(每1 g加味青娥方中含补骨脂生药5 g)治疗的36例患者中,出现1例ALT水平升高,但情况较为轻微;付舒菲等[33]使用丹知青娥方(含补骨脂素2.1 mg/g,异补骨脂素1.8 mg/g)治疗更年期症状,出现多例心悸、胃部恶心、便秘、多眠等不良反应,16例参与者在治疗8周后表现出较高的转氨酶水平,治疗停止后肝功能检测恢复正常。加味青娥方主要组成药物为丹参、杜仲、补骨脂,丹知青娥方则在此基础上加入中药知母。其中,丹参、知母、杜仲均未见报道具有肝毒性,且多项研究证实此3味中药对肝损伤均具有保护作用[34-36],文献作者推测补骨脂为两方引起肝损伤的主要药物。
1.2 补骨脂肝损伤成分研究目前动物实验研究提示,肝损伤的程度与补骨脂给药时间、剂量呈一定的相关性[37]。张玥等[38]研究发现,小鼠连续腹腔注射80 mg/kg的补骨脂素和异补骨脂素4周后,补骨脂素组小鼠血清中碱性磷酸酶(ALP)水平明显降低,异补骨脂素则会引起小鼠血清中ALT和AST的水平上升,ALP水平下降。病理学检查显示补骨脂素组小鼠肝脏内可见散在局灶性坏死,异补骨脂素组部分小鼠肝脏有肝细胞变性,提示补骨脂素和异补骨脂素均能造成一定程度上的肝损伤;此外,100 μmol/L的异补骨脂素可以抑制多药耐药相关蛋白2(MRP2)、多药耐药相关蛋白3(MRP3)的表达,从而引起HepG2细胞内胆汁酸升高和细胞毒性[38-39]。宋蕾等[40]研究发现,采用100 mg/kg的异补骨脂素连续灌胃给药ICR小鼠9 d,雌性小鼠肝功能下降,肝脏系数及血清中ALT和AST水平显著升高,肝脏中胆汁酸盐输出泵(BSEP)、钠离子-牛磺胆酸共转运蛋白(NTCP)和有机阴离子转运多肽2(OATP2)的mRNA水平均有所降低。连续灌胃给予大鼠异补骨脂素40 mg/kg,给药28 d后,能够对大鼠肝微粒体中的细胞色素P450酶(CYP450)产生影响,造成转氨酶升高,进而引起肝脏损伤[41]。补骨脂水提物中存在大量的补骨脂苷和异补骨脂苷,连续灌胃给予小鼠80 g/kg的补骨脂水提物14 d,能够使其肝脏BSEP和NTCP表达显著降低,影响胆汁酸转运体的表达[42];连续灌胃给予大鼠2.1 g/kg的补骨脂水提物12周,能够引起大鼠肝脏出现中度弥漫性脂肪变性[43]。王昭昕等[44]采用70 %乙醇渗漉提取补骨脂中的有效成分,给予大鼠不同剂量的补骨脂提取物(生药组为3 g/kg,其余各组低剂量组为3 g/kg,高剂量组为6 g/kg),连续灌胃给药4周后发现,补骨脂生药组、补骨脂下层渗漉液高剂量组(主要含有补骨脂素、异补骨脂素和补骨脂酚)与渗漉药渣高剂量组(主要含有补骨脂苷和异补骨脂苷)能够造成明显的肝损伤,其中渗漉药渣高剂量组大鼠肝损伤最为明显,推测(异)补骨脂苷肝毒性高于其他成分。本课题组前期研究也证实[45],分别给予大鼠补骨脂水提物(主要含补骨脂苷、异补骨脂苷)及补骨脂水提后的干燥药渣(主要含补骨脂素、异补骨脂素、补骨脂酚),灌胃给药4周后水提物药渣组大鼠肝损伤程度明显低于生药组。黄酮类成分补骨脂甲素和Corylifol A能够抑制肝脏微粒体中的葡糖醛酸转移酶1A1,可能是造成胆红素水平上升的原因[46];但对其作用的评价仅局限于体外酶活性检测,对机体肝脏的影响仍有待探究。周昆等[47]发现HepG2细胞的存活率与补骨脂酚终浓度和作用时间呈负相关,但是小鼠灌胃给予50 mg/kg补骨脂酚未产生明显的肝损伤,提示补骨脂酚肝毒性较小。
上述研究表明,(异)补骨脂素、(异)补骨脂苷和补骨脂酚均能造成一定程度的肝损伤,其中补骨脂酚肝毒性最小,(异)补骨脂苷的肝毒性高于(异)补骨脂素。尽管已有多项实验证实(异)补骨脂苷的肝毒性较强,但对于补骨脂中毒性成分的研究仍有所欠缺,需进一步完善。笔者对补骨脂中主要肝毒性成分的半数致死量(LD50)、半数有效量(ED50)及毒性剂量进行检索,发现仅白茹玉等[48]报道了补骨脂素与异补骨脂素小鼠单次灌胃给药的LD50分别为638.69 mg/kg与351.72 mg/kg;其余成分的LD50及补骨脂主要成分的ED50和毒性剂量等均未见报道。对补骨脂毒性成分的深入研究,不仅能够为补骨脂临床用药提供参考,同时对补骨脂减毒的探究也具有指导意义。
补骨脂中主要的活性成分为补骨脂素和异补骨脂素。《中国药典》规定,补骨脂安全剂量为6~10 g/d,且饮片中补骨脂素和异补骨脂素总含量不得少于0.7 %。在关于(异)补骨脂素引起肝损伤的实验中,给药剂量均远大于规定用量(约为生药规定剂量的5~10倍,根据成分含量及体表面积折合计算),且多数研究给药时间较长。(异)补骨脂素口服给药的消除半衰期超过4 h,且给药后24 h仍未代谢完全[49];长时间持续给药会引起代谢不及时,大量的(异)补骨脂素在体内蓄积,从而引起肝脏损伤。此外,本课题组前期研究发现[45],(异)补骨脂苷在补骨脂中含量较高,且能够在体内代谢转化为(异)补骨脂素,使服用补骨脂后(异)补骨脂素的体内暴露量明显升高,最终过量的(异)补骨脂素导致肝损害的发生。而且,由于(异)补骨脂苷含量的不确定性,也使得(异)补骨脂素含量的控制变得毫无意义。因此,在用药剂量不超过规定剂量的条件下,通过炮制的方法降低补骨脂中毒性成分(异)补骨脂苷的含量,同时保证活性成分(异)补骨脂素含量符合其有效剂量,对保障补骨脂用药的安全性和有效性具有重要意义。
2 补骨脂“雷公炮制法”减毒机制有关补骨脂的炮制理论始见于南北朝的《雷公炮炙论》,提出补骨脂炮制的目的是解其“燥毒”。在炮制过程中,由于受到炮制条件的影响,补骨脂内在成分会发生质或量的改变,毒性成分(异)补骨脂苷转化为活性成分(异)补骨脂素,从而达到炮制减毒的目的。补骨脂素具有抗癌、调节免疫和雌激素样作用,在血浆中代谢消除缓慢[50],被认为是补骨脂中的主要活性成分,常作为指标成分用于补骨脂及其相关制品的质量控制。有关研究表明,(异)补骨脂苷与(异)补骨脂素具有一定的生物转化关系[51],可能与补骨脂中存在的β-葡萄糖苷酶有关[52]。(异)补骨脂苷和(异)补骨脂素是补骨脂水煎液入血的主要活性成分[53],(异)补骨脂苷在大鼠体内吸收较快,并在一定时间后转化为(异)补骨脂素[54]。王跃飞等[55]研究发现,(异)补骨脂苷可通过肠道微生物发生去糖基化,代谢为(异)补骨脂素。此外,(异)补骨脂苷在体外可以通过酸水解进行转化,转化条件为水解反应温度100 ℃、盐酸浓度3 mol/L、水解时间30 min[56]。在雷公法炮制过程中,通过酒浸可去除部分(异)补骨脂素及少量的(异)补骨脂苷,但其具体含量变化未见明确报道。王昭昕等[42]采用70 %乙醇渗漉提取补骨脂中的有效成分,发现提取后补骨脂中(异)补骨脂素含量下降约60 %,(异)补骨脂苷含量下降约19 %,而酒浸后补骨脂化学成分含量的变化应低于渗漉提取。随后,水浸、高温加热等条件则促进了(异)补骨脂苷的浸出和转化。宋潇等[57]研究发现,与生品组相比,补骨脂雷公炮制组中(异)补骨脂素的增加量约为(异)补骨脂苷的减少量的一半左右;而在酒浸炒法中,补骨脂素和异补骨脂素的含量增加值等同于补骨脂苷和异补骨脂苷的含量下降值,提示在雷公法炮制过程中有一部分(异)补骨脂苷在酒、水浸泡和水蒸过程中被消耗掉。此外,炮制后补骨脂中另一毒性成分补骨脂酚含量也有所降低。酒、水浸泡可以使补骨脂药材结构趋于疏松,补骨脂酚在后续炮制过程中易于逸出;水蒸可以促进补骨脂酚受热挥发[58]。李娜等[59]比较了补骨脂经不同方法炮制后补骨脂酚的含量变化,发现与生品组相比,雷公法与水蒸法炮制品补骨脂酚含量下降约12%;酒浸炒法与药典法炮制均能促进补骨脂酚含量上升;清炒法与生品组相比无明显变化,证实“水蒸”能够降低补骨脂酚的含量。杨滨等[16]的研究也证实了补骨脂经雷公法炮制后,与生品相比补骨脂酚的含量下降约为10%左右。尽管在酒浸过程中,补骨脂中的有效成分(异)补骨脂素有所消耗,但在后续工艺中,经(异)补骨脂苷转化而成的(异)补骨脂素则能够弥补这一损耗,且能保证(异)补骨脂素含量处于安全剂量范围。郭晏华等[60]对不同批次的补骨脂炮制前后(异)补骨脂素含量进行检测,发现与生品组相比,雷公法炮制组中各批次(异)补骨脂素含量均略有上升,且符合药典标准;多项研究证实经雷公法炮制后补骨脂中(异)补骨脂素含量均略高于生品组[59, 61-62]。经雷公法炮制后,(异)补骨脂苷已于炮制过程中完成转化,因此服用补骨脂雷公法炮制品后,进入体内的(异)补骨脂苷含量较少,其在体内转化而成的(异)补骨脂素也会被迅速代谢,有利于对(异)补骨脂素的含量进行控制,使得体内(异)补骨脂素的含量处于安全用药范围。宋迪等[63]基于《雷公炮炙论》,以HepaRG细胞3D培养获得的类人肝脏模型结合高内涵成像技术,证实了《雷公炮炙论》中记载的酒浸水漂法能够有效降低补骨脂的肝毒性,并设计出最优减毒工艺。通过炮制,补骨脂中燥性成分含量减少,印证了补骨脂炮制理论中炮制的目的是为了解燥毒的科学性。在补骨脂雷公法炮制过程中,先通过酒浸去除部分(异)补骨脂苷和(异)补骨脂素,再通过水浸促进部分毒性成分(异)补骨脂苷的浸出,最后通过水蒸的方法促进残留的毒性成分(异)补骨脂苷转化为活性成分(异)补骨脂素,同时促进补骨脂酚的受热挥发,使得(异)补骨脂素的含量保持在有效剂量范围内,保障了补骨脂用药的安全性及有效性,最终达到炮制减毒的目的,见图 2。
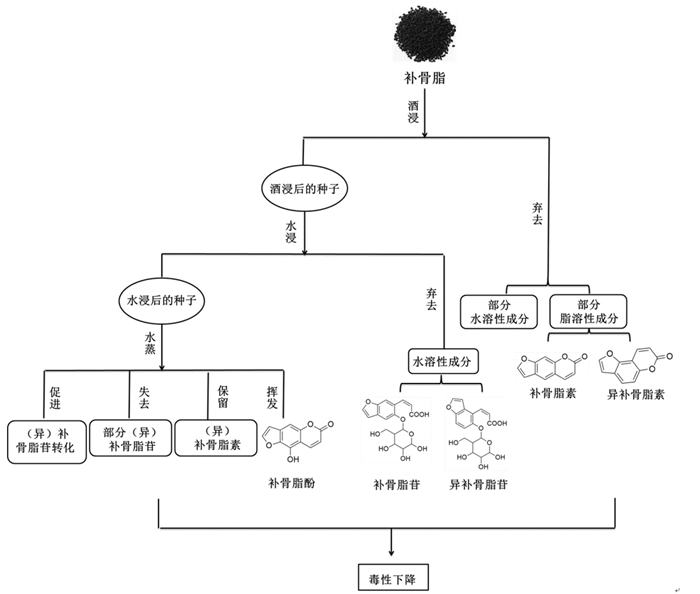
|
| 图 2 补骨脂雷公炮制法减毒机制 Fig. 2 Attenuation mechanism of Psoralea corylifolia by "Leigong processing method" |
补骨脂作为温肾助阳的传统中药,在临床上应用广泛。补骨脂生品毒性较强,主要表现为慢性肝损伤,也有研究发现其中的单萜酚类成分补骨脂酚能够造成肾脏损伤。江芳等[64]发现,补骨脂酚能促进HK-2细胞的凋亡、坏死,造成细胞膜脱落,且呈剂量和时间依赖性,判断补骨脂酚能够抑制肾脏细胞DNA的合成及有丝分裂,或直接破坏细胞膜,进而引起细胞凋亡,直接造成肾脏的损伤。补骨脂酚在补骨脂中含量较高,约占整体成分的4%[65],但其在体内溶解度较低,生物利用度较差[66]。张玉顺等[67]使用补骨脂酚(相当于生药量18.75、37.5、75 g/kg)连续灌胃昆明小鼠7、14、21和28 d后,出现不同程度肾脏病理性损害,且仅在小鼠中发现,在狗的研究中未见相同结果。此外,给予昆明小鼠连续灌胃21 d补骨脂不同炮制品水煎浸膏5 g/kg(补骨脂生药量为临床用量的25倍),发现肾小球毛细血管丛的内皮细胞及间质细胞核增大[9]。在肾毒性的实验中,补骨脂酚的使用剂量均远高于《中国药典》规定的用药剂量范围(6~10 g),在常规剂量下尚未见有肾毒性报道,推测补骨脂酚的肾毒性可能与其高给药量有关[68],临床上也未见补骨脂造成肾脏损伤的报道。
雷公法是传统的补骨脂炮制方法,炮制后补骨脂毒性明显降低,其炮制减毒的机制与主要毒性成分(异)补骨脂苷的含量下降有关。目前,对于补骨脂炮制减毒的研究仍存在许多问题。首先,对于补骨脂中毒性成分的研究仍需进一步完善;其次,在炮制过程中,不同炮制步骤如酒浸、水浸及水蒸等对补骨脂中成分的影响仍有待研究,明确各炮制步骤对补骨脂成分的影响,有利于为补骨脂炮制工艺的优化提供指导。笔者阐述了补骨脂毒性及相关成分,对雷公炮制法减毒的科学内涵进行探究,为补骨脂炮制减毒的研究提供科学依据。
| [1] |
陈莹, 吴玥, 宋金春. 补骨脂化学成分及生物活性研究进展[J]. 实用药物与临床, 2016, 19(9): 1184-1188. CHEN Y, WU Y, SONG J C. Research progress of the chemical constituents and bioactivity of Psoralea corylifolia[J]. Practical Pharmacy and Clinical Remedies, 2016, 19(9): 1184-1188. |
| [2] |
国家药典委员会.中华人民共和国药典(一部)[S].北京: 中国医药科技出版社, 2015: 187-188. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (Part 1)[S]. Beijing: China Medical Science Press, 2015: 187-188. |
| [3] |
XIN D, WANG H, YANG J, et al. Phytoestrogens from Psoralea corylifolia reveal estrogen receptor-subtype selectivity[J]. Phytomedicine, 2010, 17(2): 126-131. DOI:10.1016/j.phymed.2009.05.015 |
| [4] |
MIURA H, NISHIDA H, LINUMA M. Effect of crude fractions of psoralea corylifolia seed extract on bone calcification[J]. Planta Medica, 1996, 62(2): 150-153. |
| [5] |
钟佩茹, 高秀梅, 陈彤, 等. 补骨脂素对人脐静脉内皮细胞活力及TNF-α诱导组织因子产生的影响[J]. 辽宁中医杂志, 2012, 39(11): 2247-2249. ZHONG P R, GAO X M, CHEN T. Effects of psoralen on the activity of human umbilical vein endothelial cells and TNF-α induced tissue factor[J]. Liaoning Journal of Traditional Chinese Medicine, 2012, 39(11): 2247-2249. |
| [6] |
MIAO L, YUN X, TAO R, et al. Bakuchiol exhibits anti-metastasis activity through NF-κB cross-talk signaling with AR and ERβ in androgen-independent prostate cancer cells PC-3[J]. Journal of Pharmacological Sciences, 2018, 138(1): 1-8. |
| [7] |
MAO H, WANG H, MA S, et al. Bidirectional regulation of bakuchiol, an estrogenic-like compound, on catecholamine secretion[J]. Toxicology and Applied Pharmacology, 2014, 274(1): 180-189. DOI:10.1016/j.taap.2013.11.001 |
| [8] |
黄畋. PUVA引起中毒性肝炎[J]. 国外医学·皮肤病学分册, 1982, 8(1): 38. HUANG T. Toxipathic hepatitis caused by PUVA[J]. Inertnational Journal of dermatology And Venereology, 1982, 8(1): 38. |
| [9] |
张玉顺, 吴子伦, 回连强, 等. 补骨脂不同炮制品对小鼠肾脏毒害作用的病理学研究[J]. 中成药, 1994, 17(12): 17-18, 56. ZHANG Y S, WU Z L, HUI L Q, et al. Pathological study on toxic action to kidney of mice of different processed products of Fructus Psoraleae[J]. Chinese Traditional Patent Medicine, 1994, 17(12): 17-18, 56. |
| [10] |
雷敩. 雷公炮炙论[M]. 合肥: 安徽科学技术出版社, 1991: 69. LEI X. Leigong Pao Zhi Method[M]. Hefei: Anhui Science & Technology Publishing House, 1991: 69. |
| [11] |
杨荣平, 秦伟瀚, 林芳, 等. 补骨脂炮制工艺的超高效液相色谱指纹图谱法优化[J]. 时珍国医国药, 2012, 23(3): 699-701. YANG R P, QIN W H, LIN F, et al. Optimization of processing technology of Psoralea corylifolia by UPLC Fingerprint[J]. Lishizhen Medicine and Materia Medica Research, 2012, 23(3): 699-701. |
| [12] |
陈李东.补骨脂炮制工艺优选的研究[D].济南: 山东中医药大学, 2017. CHEN L D. Research of Psoralea corylifolia process technology optimization method[D]. Jinan: Shandong University of Traditional Chinese Medicine, 2017. |
| [13] |
郭晏华.补骨脂炮制原理研究[D].沈阳: 辽宁中医药大学, 2007. GUO Y H. Study on processing principles of Psoralea corylifolia[D]. Shenyang: Liaoning University of Traditional Chinese Medicine, 2007. |
| [14] |
张春玲, 王晓军. 食盐及盐炙法在中药炮制中的应用[J]. 甘肃中医学院学报, 2003, 20(4): 46-47. ZHANG C L, WANG X J. Application of salt and salt roasting method in traditional Chinese medicine processing[J]. Journal of Gansu University of Chinese Medicine, 2003, 20(4): 46-47. |
| [15] |
方艳夕, 谭志静, 俞浩, 等. 不同炮制方法对补骨脂中补骨脂素和异补骨脂素含量的影响[J]. 中药材, 2010, 33(7): 1062-1064. FANG Y X, TAN Z J, YU H, et al. Effects of different processing methods on the content of psoralen and isopsoralen in Psoralea corylifolia[J]. Journal of Chinese Medicinal Materials, 2010, 33(7): 1062-1064. |
| [16] |
杨滨, 姚三桃, 崔淑莲. 补骨脂古今主要炮制方法的比较[J]. 中国中药杂志, 1996, 42(9): 25-27, 63. YANG B, YAO S T, CUI S L. Comparison of ancient and modern processing methods for Fructus Psoraleae[J]. China Journal of Chinese Materia Medica, 1996, 42(9): 25-27, 63. |
| [17] |
姚祥珍, 沈鸿, 富杭育, 等. 补骨脂主要炮制品的毒性比较[J]. 中药材, 1997, 20(4): 182-184. YAO X Z, SHEN H, FU H Y, et al. Toxic studies on various processed products of Fructus Psoraleae[J]. Journal of Chinese Medicinal Materials, 1997, 20(4): 182-184. |
| [18] |
贾天柱. 中药炮制学[M]. 上海: 上海科学技术出版社, 2010: 263. JIA T Z. Preparation of traditional Chinese drugs[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2010: 263. |
| [19] |
娄鑫, 田硕, 白明, 等. 一种新的有毒中药毒性分级方法——四级毒性分类[J]. 中医学报, 2020, 35(2): 370-373. LOU X, TIAN S, BAI M, et al. A new toxicity grading method of toxic traditional Chinese medicine:Ⅳ grade toxicity classification[J]. Acta Chinese Medicine, 2020, 35(2): 370-373. |
| [20] |
杨莉, 王昭昕, 卢国彦, 等. 补骨脂水提药渣大鼠3个月长期毒性试验研究[J]. 药物评价研究, 2019, 42(6): 1128-1134. YANG L, WANG Z X, LU G Y, et al. Study of three months long-term toxicity of rats with water extracts residue of Psoralea corylifolia[J]. Drug Evaluation Research, 2019, 42(6): 1128-1134. |
| [21] |
张秀娟, 曹慧琪, 邢志华, 等. 补骨脂对小鼠肝细胞形态、肝功能及线粒体膜电位的影响[J]. 中成药, 2014, 36(1): 160-162. ZHANG X J, CAO H Q, XING Z H, et al. Effects of Psoralea corylifolia on the mouse hepatocyte morphology, liver function and mitochondrial membrane potential[J]. Chinese Traditional Patent Medicine, 2014, 36(1): 160-162. |
| [22] |
JOIS H S, MANJUNATH B L, VENKATARAO S. Chemical examination of the seeds of Psoralea corylifolia[J]. Journal of the Indian Chemical Society, 1933, 10: 41-46. |
| [23] |
颜冬梅, 高秀梅. 补骨脂化学成分研究进展[J]. 辽宁中医药大学学报, 2012, 14(9): 96-99. YAN D M, GAO X M. Research progress of chemical ingredient of Psoralea corylifolia[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2012, 14(9): 96-99. |
| [24] |
李敏, 杨君君, 杨静, 等. 补骨脂果皮和种子中化学成分的分布规律研究[J]. 天津中医药, 2018, 35(9): 706-709. LI M, YANG J J, YANG J, et al. Distribution rule of chemical component in pericarp and seed of Fructus Psoralea[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(9): 706-709. |
| [25] |
NAM S W, BAEK J T, LEE D S, et al. A case of acute cholestatic hepatitis associated with the seeds of Psoralea corylifolia (Boh-Gol-Zhee)[J]. Clinical Toxicology, 2005, 43(6): 589-591. DOI:10.1081/CLT-200068863 |
| [26] |
颜冬梅, 王跃飞, 刘亚男, 等. 紫外波长切换高效液相色谱法同时测定壮骨关节丸中7种有效成分的含量[J]. 药物分析杂志, 2010, 30(4): 637-640. YAN D M, WANG Y F, LIU Y N, et al. HPLC simultaneous determination of seven active compounds in Zhuanggu Guanjie pills with switching UV wavelength[J]. Chinese Journal of Pharmaceutical Analysis, 2010, 30(4): 637-640. |
| [27] |
周昆, 代志, 柳占彪, 等. 壮骨关节丸中肝毒性药材的筛选研究[J]. 中国药物警戒, 2009, 6(11): 641-648. ZHOU K, DAI Z, LIU Z B, et al. Experimental study of screening the hepatotoxic medicinal materials in Zhuanggu Guanjie Pill[J]. Chinese Journal of Pharmacovigilance, 2009, 6(11): 641-648. |
| [28] |
艾尼瓦尔·塔力甫, 库尔班江·肉孜. 高效液相色谱法测定维药驱白巴布期片中补骨脂素和异补骨脂素的含量[J]. 中国民族医药杂志, 2007, 53(12): 50-52. ANWAR T, KURBANJAN R. Detemination of psoralen and iso psoralen in uighur medicine Qubai Babuqi Tablet by HPLC[J]. Journal of Medicine & Pharmacy of Chinese Minorities, 2007, 53(12): 50-52. |
| [29] |
丘小惠, 袁小红, 林爱华. 补骨脂素、异补骨脂素在补骨脂注射液中的含量测定及其热稳定性考察[J]. 中国现代应用药学, 2006, 23(4): 333-335. QIU X H, YUAN X H, LIN A H. Assay of psoralen and isopsorale in Fructus Psoraleae injection and the study on the stability to heat[J]. Chinese Journal of Modern Applied Pharmacy, 2006, 23(4): 333-335. |
| [30] |
CHEUNG W I, TSE M L, NGAN T, et al. Liver injury associated with the use of Fructus Psoraleae (Bol-gol-zhee or Bu-gu-zhi) and its related proprietary medicine[J]. Clinical Toxicology, 2009, 47(7): 683-685. DOI:10.1080/15563650903059136 |
| [31] |
张利利, 黄景慧. 补骨脂颗粒与驱白巴布期片联用致药物性肝损伤1例[J]. 中国药物应用与监测, 2018, 15(4): 246-249. ZHANG L L, HUANG J H. A case of drug-induced liver injury caused by the combined medication of Buguzhi Granules and Qubai Babuqi Tablets[J]. Chinese Journal of Drug Application and Monitoring, 2018, 15(4): 246-249. |
| [32] |
XIA Y, ZHAO Y, REN M, et al. A randomized double-blind placebo-controlled trial of a Chinese herbal medicine preparation (Jiawei Qing'e Fang) for hot flashes and quality of life in perimenopausal women[J]. Menopause, 2012, 19(2): 234-244. |
| [33] |
FU S F, ZHAO Y Q, REN M, et al. A randomized, double-blind, placebo-controlled trial of Chinese herbal medicine granules for the treatment of menopausal symptoms by stages[J]. Menopause, 2016, 23(3): 311-323. DOI:10.1097/GME.0000000000000534 |
| [34] |
彭渊, 马园园, 黄恺, 等. 丹参抑制NLRP3炎症小体减轻胆汁淤积性肝损伤[J]. 上海中医药大学学报, 2019, 33(1): 66-70. PENG Y, MA Y Y, HUANG K, et al. Salvia Miltiorrhiza inhibits NLRP3 inflammasome and alleviates cholestatic liver injury[J]. Academic Journal of Shanghai University of Traditional Chinese Medicine, 2019, 33(1): 66-70. |
| [35] |
蒋真真, 袁带秀, 胡倩, 等. 杜仲总黄酮对小鼠急性肝损伤的保护作用[J]. 广州化工, 2016, 44(2): 69-70. JIANG Z Z, YUAN D X, HU Q, et al. Study on the protective effect of total flavonoids of Eucommia on acute liver injury in mice[J]. Guangzhou Chemical Industry, 2016, 44(2): 69-70. |
| [36] |
李满妹, 江涛, 黄杰昌, 等. 知母总黄酮对溴酸钾诱发小鼠肝损伤的保护作用[J]. 中草药, 2008, 39(2): 252-255. LI M M, JIANG T, HUANG J C, et al. Protective effects of total flavones from Rhizoma anemarrhenae on liver injury induced by KBrO3 in mice[J]. Chinese Traditional and Herbal Drugs, 2008, 39(2): 252-255. |
| [37] |
田文杨, 兰姗, 张力, 等. 补骨脂的安全性评价与风险控制措施探讨[J]. 中国中药杂志, 2017, 42(21): 4059-4066. TIAN W Y, LAN S, ZHANG L, et al. Safety evaluation and risk control measures of Psoralea corylifolia[J]. China Journal of Chinese Materia Medica, 2017, 42(21): 4059-4066. |
| [38] |
张玥, 毕亚男, 袁晓美, 等. 基于靶器官的补骨脂肝毒性成分探讨[J]. 时珍国医国药, 2017, 28(8): 1844-1847. ZHANG Y, BI Y N, YUAN X M, et al. Discussion on hepatotoxic components of Psoralea corylifolia based on target organs[J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(8): 1844-1847. |
| [39] |
周昆, 毕亚男, 史红. 异补骨脂素抑制MRP2、MRP3所致的HepG2细胞内胆汁酸蓄积和毒性[J]. 中国药理学通报, 2015, 31(8): 1112-1116. ZHOU K, BI Y N, SHI H. Isopsoralen induced bile acid accumulation and cytotoxicity by inhibiting MRP2 and MRP3 in HepG2 cells[J]. Chinese Pharmacological Bulletin, 2015, 31(8): 1112-1116. |
| [40] |
宋蕾, 毕亚男, 于英莉, 等. 异补骨脂素灌胃9天对雌性ICR小鼠肝毒性的初步研究[J]. 中国药理学与毒理学杂志, 2019, 33(9): 734. SONG L, BI Y N, YU Y L, et al. Preliminary study on hepatotoxicity of isopsoralen to female ICR mice by intragastric administration for 9 days[J]. Chinese Journal of Pharmacology and Toxicology, 2019, 33(9): 734. |
| [41] |
WANG X, LOU Y J, WANG M X, et al. Furocoumarins affect hepatic cytochrome P450 and renal organic ion transporters in mice[J]. Toxicology Letters, 2012, 209(1): 67-77. |
| [42] |
毕亚男, 李震, 卢国彦, 等. 补骨脂水提物对小鼠的肝毒性及胆汁酸转运的影响[J]. 药物评价研究, 2015, 38(3): 267-270. BI Y N, LI Z, LU G Y, et al. Hepatoxicity of aqueous extract from Psoralea corylifolia and its effect on bile acid transportation in mice[J]. Drug Evaluation Research, 2015, 38(3): 267-270. |
| [43] |
周昆, 代志, 柳占彪, 等. 补骨脂水提物引起的大鼠肝损害[J]. 天津中医药大学学报, 2013, 32(4): 221-224. ZHOU K, DAI Z, LIU Z B, et al. Liver damage in rats caused by water extract of psoralea corylifolia[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2013, 32(4): 221-224. |
| [44] |
王昭昕, 杨莉, 卢国彦, 等. 补骨脂的不同提取物对大鼠毒性的初步研究[J]. 实验动物科学, 2019, 36(3): 6-12. WANG Z X, YANG L, LU G Y, et al. Preliminary study on toxicity of psoralea corylifolia from different extractions in rats[J]. Laboratory Animal Science, 2019, 36(3): 6-12. |
| [45] |
高秀梅, 周昆, 王跃飞, 等.一种补骨脂药材的炮制方法、补骨脂提取物及药物组合物[P].天津: CN105232621A, 2016-01-13. GAO X M, ZHOU K, WANG Y F, et al. A processing method of psoralea corylifolia medicinal material, psoralea corylifolia extract and pharmaceutical composition[P]. Tianjin: CN105232621A, 2016-01-13. |
| [46] |
WANG X X, LV X, LI S Y, et al. Identification and characterization of naturally occurring inhibitors against UDP-glucuronosyltransferase 1A1 in Fructus Psoraleae (Bu-gu-zhi)[J]. Toxicol Appl Pharmacol, 2015, 289(1): 70-78. DOI:10.1016/j.taap.2015.09.003 |
| [47] |
周昆, 王安红, 柴丽娟, 等. 补骨脂酚对HepG2的细胞毒性及BSEP、NTCP、FXR、CYP7A1的影响[J]. 毒理学杂志, 2015, 29(3): 193-196. ZHOU K, WANG A H, CHAI L J, et al. Effect of bakuchiol on HepG2 cytotoxicity, BSEP, NTCP, FXR and CYP7A1[J]. Journal of Toxicology, 2015, 29(3): 193-196. |
| [48] |
白茹玉, 张盼阳, 毕亚男, 等. 补骨脂素和异补骨脂素的急性毒性和相互作用[J]. 药物评价研究, 2018, 41(6): 1068-1072. BAI R Y, ZHANG P Y, BI Y N, et al. Acute toxicity and drug interaction of psoralenand isopsoralen[J]. Drug Evaluation Research, 2018, 41(6): 1068-1072. |
| [49] |
王宇, 蒋嘉明, 孔思远, 等. 补骨脂ADME及其相关毒性的研究进展[J]. 世界科学技术-中医药现代化, 2017, 19(2): 276-281. WANG Y, JIANG J M, KONG S Y, et al. Research progress of Fructus Psoralea ADME and its related toxicity[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2017, 19(2): 276-281. |
| [50] |
CHANG Y X, ZHANG Q H, LI J, et al. Simultaneous determination of scopoletin, psoralen, bergapten, xanthotoxin, columbianetin acetate, imperatorin, osthole and isoimperatorin in rat plasma by LC-MS/MS for pharmacokinetic studies following oral administration of Radix Angelicae Pubescentis extract[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 77: 71-75. DOI:10.1016/j.jpba.2012.12.031 |
| [51] |
QIAO C F, HAN Q B, SONG J Z, et al. Quality assessment of fructus psoraleae[J]. Chemical and Pharmaceutical Bulletin, 2006, 54(6): 887-890. DOI:10.1248/cpb.54.887 |
| [52] |
YANG J, YANG J, DU J, et al. General survey of Fructus Psoraleae from the different origins and chemical identification of the roasted from raw Fructus Psoraleae[J]. Journal of Food and Drug Analysis, 2018, 26(2): 807-814. DOI:10.1016/j.jfda.2017.10.009 |
| [53] |
宋殿荣, 宋红运, 王跃飞, 等. 补骨脂水煎液大鼠体内血清药物成分的初步研究[J]. 中华中医药杂志, 2010, 25(11): 1863-1865. SONG D R, SONG H Y, WANG Y F, et al. Study on serum active constituents of rats intragastrically given decoction of Fructus Psoraleae[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2010, 25(11): 1863-1865. |
| [54] |
颜冬梅, 高秀梅, 康立源, 等. 补骨脂中苯并呋喃苷类成分在大鼠血浆中的移行特征[J]. 中国实验方剂学杂志, 2015, 21(11): 85-88. YAN D M, GAO X M, KANG L Y, et al. Transitional features of benzofuran glycosides part from Psoraleae Fructus in rat plasma[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2015, 21(11): 85-88. |
| [55] |
WANG Y F, LIU Y N, XIONG W, et al. A UPLC-MS/MS method for in vivo and in vitro pharmacokinetic studies of psoralenoside, isopsoralenoside, psoralen and isopsoralen from Psoralea corylifolia extract[J]. Journal of Ethnopharmacology, 2014, 151(1): 609-617. DOI:10.1016/j.jep.2013.11.013 |
| [56] |
耿莲, 彭四威, 高秀梅, 等. 一种由(异)补骨脂苷制备(异)补骨脂素的简单、高效的方法[J]. 中药材, 2015, 38(9): 1894-1896. GENG L, PENG S W, GAO X M, et al. A simple and efficient method for the preparation of (iso) psoralen from (iso) psoralenoside[J]. Journal of Chinese Medicinal Materials, 2015, 38(9): 1894-1896. |
| [57] |
宋潇, 戚爱棣, 王跃飞, 等. 不同炮制方法对补骨脂中4类化学成分的影响[J]. 中国中药杂志, 2011, 36(15): 2071-2075. SONG X, QI A D, WANG Y F, et al. Variation of 4 kinds of compounds in Psoralea corylifolia processed by different methods[J]. China Journal of Chinese Materia Medica, 2011, 36(15): 2071-2075. |
| [58] |
郭晏华, 张旭.GC/MS法分析补骨脂炮制前后补骨脂酚的含量变化[A].中华中医药学会.中药药效提高与中药饮片质量控制交流研讨会论文集[C].中华中医药学会, 2009: 95-98. GUO Y H, ZHANG X.Content change of psoralen before and after processing of Psoralea corylifolia by GC/MS[A]. China Association of Chinese Medicine. Proceedings of the Symposium on the Exchange of Traditional Chinese Medicine's Effectiveness and Quality Control[C]. China Association of Chinese Medicine, 2009: 95-98. |
| [59] |
李娜, 颜冬梅, 张金莲, 等. 炮制方法对补骨脂中抗骨质疏松效应成分含量的影响[J]. 世界科学技术-中医药现代化, 2017, 19(1): 127-132. LI N, YAN D M, ZHANG J L, et al. Effects of different processing methods on the antiosteoporotic effective compositions of Psoralea corylifolia[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2017, 19(1): 127-132. |
| [60] |
郭晏华, 罗志冬, 贾天柱. 补骨脂炮制前后补骨脂素和异补骨脂素的变化[J]. 中草药, 2006, 37(11): 1652-1654. GUO Y H, LUO Z D, JIA T Z. Changes of psoralen and isopsoralen before and after processing of Psoralea corylifolia[J]. Chinese Traditional and Herbal Drugs, 2006, 37(11): 1652-1654. |
| [61] |
励娜, 陈小川, 王爱平, 等. 补骨脂炮制研究探讨[J]. 重庆中草药研究, 2014, 57(1): 10-12. LI N, CHEN X C, WANG A P, et al. Study on Psoralea corylifolia processing[J]. Chongqing Journal of Research on Chinese Drugs and Herbs, 2014, 57(1): 10-12. |
| [62] |
杨滨, 姚三桃. 补骨脂炮制原理探讨[J]. 中国中药杂志, 1997, 43(12): 25-26, 60. YANG B, YAO S T. Exploration of processing principles for Fructus Psoralea[J]. China Journal of Chinese Materia Medica, 1997, 43(12): 25-26, 60. |
| [63] |
宋迪, 陈帅帅, 李朋彦, 等. 补骨脂潜在肝毒性的修制减毒方法研究:酒浸水漂法[J]. 药学学报, 2020, 55(2): 276-282. SONG D, CHEN S S, LI P Y, et al. Attenuating the potential hepatotoxicity of Psoraleae Fructus by pre-processing:the alcohol soaking and water rinsing method[J]. Acta Pharmaceutica Sinica, 2020, 55(2): 276-282. |
| [64] |
江芳, 周昕睿, 王旗, 等. 补骨脂酚及其与补骨脂素合用对HK-2细胞的毒性及其机制[J]. 中国药理学与毒理学杂志, 2010, 24(1): 50-58. JIANG F, ZHOU X R, WANG Q, et al. Cytotoxic effect and mechanism of bakuchiol and bakuchiol combined with psoralen on HK-2 cell[J]. Chinese Journal of Pharmacology and Toxicology, 2010, 24(1): 50-58. |
| [65] |
YAN D M, CHANG Y X, KANG L Y. Quality evaluation and regional analysis of psoraleae fructus by HPLC-DAD-MS/MS plus chemometrics[J]. Chinese Herbal Medicines, 2010, 2(3): 216-223. |
| [66] |
YAN D M, CHANG Y X, WANG Y F, et al. In vivo pharmacokinetics of bakuchiol after oral administration of bakuchiol extraction in rat plasma[J]. Journal of Ethnopharmacology, 2010, 128(3): 697-702. DOI:10.1016/j.jep.2009.12.039 |
| [67] |
张玉顺, 刘玉琦, 吴子伦, 等. 补骨脂酚对小鼠肾脏毒害作用的研究[J]. 中药通报, 1981, 27(3): 30-32. ZHANG Y S, LIU Y Q, WU Z L, et al. Study on the toxic effect of bakuchiol on kidney of mice[J]. China Journal of Chinese Materia Medica, 1981, 27(3): 30-32. |
| [68] |
于悦, 王亚静, 皮佳鑫, 等. 补骨脂酚研究进展[J]. 山东中医药大学学报, 2013, 37(2): 174-177. YU Y, WANG Y J, PI J X, et al. Research progress of bakuchiol[J]. Journal of Shandong University of Traditional Chinese Medicine, 2013, 37(2): 174-177. |
2. College of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2020, Vol. 37
2020, Vol. 37




