文章信息
- 王晓群, 李小江, 孔凡铭, 王洪武, 赵林林, 潘攀, 刘筱迪, 贾英杰
- WANG Xiaoqun, LI Xiaojiang, KONG Fanming, WANG Hongwu, ZHAO Linlin, PAN Pan, LIU Xiaodi, JIA Yingjie
- 消岩汤对Lewis肺癌小鼠的抑瘤作用及对髓源性抑制细胞的影响
- Effect of Xiaoyan Decoction on tumor inhibition and myeloid-derived suppressor cells of mice with Lewis lung cancer
- 天津中医药, 2020, 37(9): 1057-1061
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(9): 1057-1061
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.09.22
-
文章历史
- 收稿日期: 2020-08-02
2. 天津中医药大学, 天津 301617
肺癌是目前世界上发病率和病死率最高的恶性肿瘤之一。2019年美国和中国癌症中心统计数据显示肺癌发病率和病死率均占恶性肿瘤病死率的首位[1-2]。目前,西医治疗肺癌除了手术、放化疗、靶向治疗以外,免疫治疗受到越来越多的重视。肿瘤能够通过多种机制诱导免疫抑制细胞的产生,这是造成肿瘤免疫逃逸及肿瘤免疫治疗失败的主要原因。髓源性抑制细胞(MDSCs)具有强大的免疫抑制活性,能够协助肿瘤细胞进行免疫逃逸[3],是肿瘤免疫抑制微环境的主要成分之一,大量研究证实MDSCs可以促进肿瘤的进展和转移[4-5]。MDSCs是阻碍抗肿瘤免疫的重要因素之一。因此,通过阻断MDSCs来增强抗肿瘤免疫显得尤为重要。
MDSCs来源于骨髓中的骨髓祖细胞和未成熟髓细胞(IMCs)。正常情况下,是粒细胞、树突状细胞(DC)和巨噬细胞(MF)的前体,能迅速地分化为成熟的粒细胞、DC和MF,并进入相应的器官、组织,发挥正常免疫功能。病理状态下,这些髓系来源的前体细胞成熟受阻,停留在各个分化阶段,成为具有免疫抑制功能的MDSCs[6]。小鼠体内所有的MDSCs均可以表达CD11b,可根据其表达的LY6G和LY6C的差异,分为PMN-MDSC(CD11b+ LY6G + LY6C-)和M-MDSC(CD11b+LY6G-LY6C+)两种亚型。
中医药在提高患者免疫力、提高生活质量、延长生存期方面具有显著的优势,中国著名中医肿瘤学专家贾英杰教授认为肿瘤免疫抑制微环境的本质为“本元亏虚”,因此,其经验方消岩汤以黄芪和太子参为君药,前期通过研究已经证实消岩汤能够增强T细胞和自然(NK)细胞活性而提高肿瘤免疫功能[7-9]。本实验通过荷瘤动物实验,以免疫抑制细胞MDSCs为切入点,进一步研究消岩汤重塑肿瘤免疫微环境的机制,为临床研究及应用提供实验依据。
1 材料 1.1 细胞株与动物Lewis细胞由天津赛尔生物技术有限公司提供;SPF级C57BL/6小鼠30只,由中国医学科学院实验动物研究所提供(合格证号:SCXK(京)2014-0004),近交系,雌雄各半,体质量(20±2)g,饲养于天津赛尔生物公司动物房。
1.2 药物注射用环磷酰胺0.2 g,批号:H20110407,Baxter Oncology GmbH生产。消岩汤成分为生黄芪30 g,太子参15 g,郁金10 g,姜黄15 g,夏枯草10 g,生牡蛎15 g,白花蛇舌草10 g,由天津中医药大学第一附属医院中药房提供并进行质控。按传统煎法,先煎40 min,二煎30 min,两煎合兑。根据成人每日需要的生药量140 g换算为小鼠每日生药量30 g/kg体质量,旋转蒸发仪浓缩为全方28.77 g/mL。置于冰箱4 ℃备用。
1.3 主要试剂及仪器流式试剂:Anti-Mouse CD11b PE,FITC Anti-Mouse Ly-6G and LY-6C,PerCP-Cy5.5 Anti-Mouse Ly-6C,APC Anti-Mouse Ly-6G均购自美国Becton-Dicknson公司;白细胞介素(IL)-6、转化生长因子-β(TGF-β)酶联免疫吸附(ELISA)试剂盒均购自江苏酶免实业有限公司。FAC sort型流式细胞仪,Becton-Dicknson,美国;酶标仪,Rayto,RT-6100,深圳雷杜生命科学股份有限公司。
2 方法 2.1 造模Lewis细胞扩增培养,至80%密度为宜,用胰酶消化细胞成单个,计数后用磷酸缓冲盐溶液(PBS)调整浓度到1×107/mL,所用液体均预热,细胞离心2 000 r/min(离心半径10 cm),5 min,弃培养液,取80 μL无血清培养基小心混合细胞(总体积约100 μL);然后用1 mL注射器吸取细胞悬液,排空气泡,将细胞接种于小鼠右前肢腋背部皮下,每3天观察一次肿瘤的生长情况。2周后,处死小鼠,剥离生长旺盛期的瘤组织,选取1.0 mm×0.5 mm×0.3 mm左右生长良好的肿块,按肿瘤(g):生理盐水(mL)为1:3比例匀浆,调细胞数为2×106 /mL。在无菌条件下,每只小鼠右侧腋窝皮下接种0.2 mL。1周后小鼠腋下可触及明显肿块,说明荷瘤模型成功建立。
2.2 实验分组及给药30只小鼠,6只为空白组,另外造模的24只小鼠随机分为模型组、环磷酰胺(CTX)组、消岩汤组、联合组,每组6只。空白组、模型组:每日灌胃0.2 mL生理盐水;消岩汤组:每日予浓度为28.77 g/mL的中药汤剂灌胃2次,每次0.2 mL;CTX组:腹腔注射CTX 0.2 mL(给药剂量以60 mg/kg计,用生理盐水稀释,浓度为6 mg/mL);联合组:每日中药汤剂灌胃2次,每次0.2 mL+腹腔注射CTX 0.2 mL。连续给药7 d后,眼眶取血后处死小鼠,完整剥离皮下移植瘤,无菌摘取脾脏和胸腺。
2.3 检测指标及方法 2.3.1 抑瘤率、脾指数、胸腺指数处死小鼠剥离肿瘤组织,拍照并称质量,计算抑瘤率。无菌摘取脾脏和胸腺,滤纸吸去表面液体,称取质量,计算脾指数、胸腺指数。
抑瘤率(%)=(1-治疗组平均瘤质量/模型组平均瘤质量)×100%
脾/胸腺指数(mg/g)=脾/胸腺质量(mg)/体质量(g)。
2.3.2 流式细胞仪检测脾脏中MDSCs水平脾脏研磨后,制成单细胞悬液,加PBS,反复两次。加红细胞裂解液,静置5 min,配平后离心5 min,弃上清。再加入PBS重悬细胞两次,将细胞数调整至107/mL,至于碎冰上待用。每个流式加入CD11b、Gr-1(Ly-6G and LY-6C)、LY6C和LY6G各2 μL,加入制备好的脾脏单细胞悬液100 μL,震荡混勾后,冰上避光孵育30 min。加入PBS 2 mL混匀,洗1次。洗2次后,重悬于PBS 300 μL中,避光4 ℃保存。1 h内上流式细胞仪检测。
2.3.3 ELISA方法检测小鼠血清中IL-6、TGF-β水平各组小鼠给药7 d后眼眶取血,室温避光静置30~60 min,通过低温高速离心机,3 500 r/min(离心半径10 cm),离心20 min后取上清,-80 ℃低温保存。择期通过ELISA试剂盒(按照试剂盒说明操作),分别检测白细胞介素(IL)-6和转化生长因子-β(TGF-β)。
2.4 统计学分析使用SPSS 22.0统计软件数据包处理数据,计量资料分别以均数±标准差(x±s)表示。组间比较采用单因素方差分析(One-way ANOVA)组间两两比较采用SNK法。P < 0.05为差异具有统计学意义。
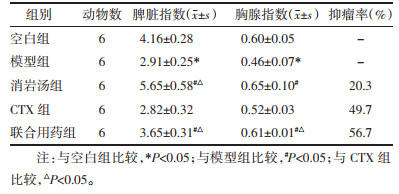
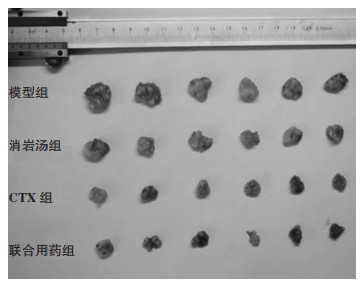
3 结果 3.1 小鼠脏器指数及抑瘤率如表 1所示,与空白组相比,模型组小鼠脾指数及胸腺指数显著降低(P < 0.05);与模型组相比,消岩汤组及联合组脾指数及胸腺指数显著升高(P < 0.05);与CTX组相比,消岩汤组及联合组脾指数显著升高(P < 0.05),联合组胸腺指数显著增高(P < 0.05);此外,收集各组小鼠肿瘤,计算抑瘤率结果表明,消岩汤、环磷酰胺及联合用药干预均可抑制肿瘤生长,抑瘤率分别为20.3%、49.7%及56.7%。见图 1。
|
|
| 图 1 各组小鼠瘤体照片 Fig. 1 Tumors images of mice in each group |
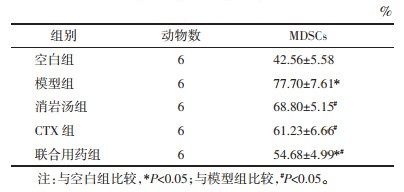
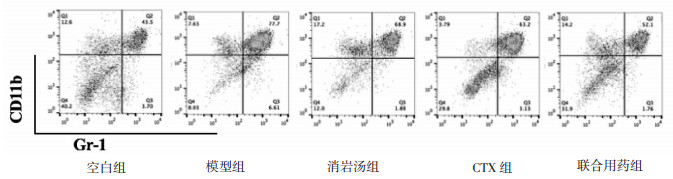
与空白组相比,模型组小鼠脾脏中MDSCs百分比显著上升(P < 0.05);与模型组相比,消岩汤组、CTX组及联合组小鼠脾脏中MDSCs百分比不同程度显著降低(P < 0.05);与CTX组相比,联合组小鼠脾脏中MDSCs百分比显著降低(P < 0.05),见表 2、图 2。
|
|
| 图 2 各组小鼠脾脏中MDSCs流式图 Fig. 2 MDSCs flow diagram in spleen of mice in each group |
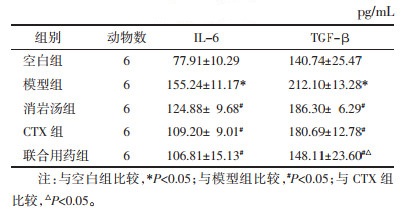
与空白组相比,模型组小鼠血清中IL-6和TGF-β水平显著升高(P < 0.05);与模型组相比,消岩汤组、CTX组及联合组小鼠血清中IL-6和TGF-β水平有不同程度降低(P < 0.05);与CTX组相比,联合组小鼠血清中TGF-β水平显著降低(P < 0.05),见表 3。
肺癌属于中医“肺积”“息贲”等范畴。贾英杰教授认为在肺癌发生、发展的过程中虚、毒、瘀、浊贯穿始末,基于此,提出黜浊培本治癌法则。临证时秉承“始终扶正培本,时时黜癌浊,以益气为第一要务”,其认为益气培本莫过于黄芪。《本草求真》指出:“黄芪为补气诸药之长,是以有耆之称。”贾英杰教授认为非重剂不足以治重病,喜用重剂黄芪以培固本元[10],黄芪也是其经验方消岩汤的核心所在。消岩汤以黄芪、太子参扶正培本共为君药,白花蛇舌草、生牡蛎、夏枯草消癌解毒共为臣药,郁金、姜黄行气活血为佐药,解毒化瘀之品共同截断癌浊生成,蜂房搜剔经络中之癌浊为使药。诸药相伍,共奏扶正、解毒、祛瘀之功效。本研究结果表明,消岩汤对肺癌有一定的抑制作用,与化疗药物联用抑瘤效果更佳。且消岩汤对小鼠脾脏和胸腺有一定的保护作用。
MDSCs是参与肿瘤免疫微环境形成的主要免疫抑制性细胞,活化和扩增后的MDSCs通过直接和间接机制抑制抗肿瘤免疫反应[11],研究证实MDSCs通过高表达Arg-1、iNOS途径抑制T淋巴细胞和NK细胞的抗肿瘤作用[12],越来越多的研究证实中医药能降低MDSCs的免疫抑制,从而达到降低肿瘤免疫逃逸的目的。国内外通过临床和动物实验已经逐步证明中医药对MDSCs有调控作用[13]。本实验结果表明荷瘤状态下MDSCs可大量扩增,消岩汤可降低小鼠脾脏中MDSCs水平,与化疗药物联用效果更显著。
肿瘤微环境下会产生大量炎性因子,这些炎性因子能使MDSCs募集、扩增和激活,启动免疫抑制。IL-6和TGF-β都在肿瘤免疫中起负向调节作用,IL-6能上调致癌转录因子STAT3[14],进而启动JAK/ STAT3信号通路,促进MDSCs扩增。TGF-β能活化JAK1-STATl通路,激活MDSCs[15]。本实验结果表明消岩汤能协助化疗药物下调IL-6、TGF-β的表达,抑制MDSCs扩增,重塑免疫微环境。
中医药治疗肿瘤的主要优势在于改善机体的内环境,尤其是重塑肿瘤相关的微环境,MDSCs是肿瘤微环境中促进肿瘤进展和转移的关键成分,如今中医药以肿瘤微环境里的MDSCs为作用靶点也为肿瘤治疗提供新思路[16-18]。目前有多种策略可以阻抑MDSCs的免疫抑制,主要包括:1)诱导髓系细胞向正性调节免疫细胞分化。2)抑制MDSCs的增殖与活化。3)增加MDSCs的消耗[19]。但是MDSCs在肿瘤免疫逃逸方面的作用机制极其复杂,在今后的研究中将更加多层次、多靶点、多通路的探讨中医药调控MDSCs的分子机制,并将研究深入到MDSCs的具体亚型。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A, et al. Cancer statistics[J]. CA:A Cancer Journal for Clinicians, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019, 41(1): 19-28. ZHENG R S, SUN K X, ZHANG S W, et al. Analysis on the prevalence of malignant tumors in China in 2015[J]. Chinese Journal of Oncology, 2019, 41(1): 19-28. |
| [3] |
TCYGANOV E, MASTIO J, CHEN E, et al. Plasticity of myeloid-derived suppressor cells in cancer[J]. Current Opinion in Immunology, 2018, 51: 76-82. DOI:10.1016/j.coi.2018.03.009 |
| [4] |
SAFARZADEH E, ORANGI M, MOHAMMADI H, et al. Myeloid-derived suppressor cells:Important contributors to tumor progression and metastasis[J]. Journal of Cellular Physiology, 2018, 233(4): 3024-3036. DOI:10.1002/jcp.26075 |
| [5] |
PASTAKI K A, ESKIAN M, KESHAVARZ F M, et al. Roles of myeloid-derived suppressor cells in cancer metastasis:immunosuppression and beyond[J]. Archivum Immunologiae et Therapiae Experimentalis, 2019, 67(2): 89-102. DOI:10.1007/s00005-018-0531-9 |
| [6] |
YOUN J I, NAGARAJ S, COLLAZO M, et al. Subsets of myeloid-derived suppressor cells in tumor bearing mice[J]. Journal of Immunology, 2008, 181(8): 5791-5802. DOI:10.4049/jimmunol.181.8.5791 |
| [7] |
张丽丽, 贺斌, 王园园, 等. 消岩汤调整黄芪剂量联合GP方案治疗非小细胞肺癌的临床观察[J]. 天津中医药, 2017, 34(9): 587-590. ZHANG L L, HE B, WANG Y Y, et al. Clinical observation of Xiaoyan decoction adjusted dose of Astragalus combined with GP regimen in the treatment of non-small cell lung cancer[J]. Tianjin Journal of Traditional Chinese Medicine, 2017, 34(9): 587-590. |
| [8] |
杨佩颖, 李小江, 孔凡铭, 等. 消岩汤对Lewis肺癌小鼠化疗后骨髓抑制的影响[J]. 中草药, 2016, 47(9): 1567-1571. YANG P Y, LI X J, KONG F M, et al. Effect of Xiaoyan Decoction on bone marrow suppression after chemotherapy in Lewis lung cancer mice[J]. Chinese Traditional and Herbal Drugs, 2016, 47(9): 1567-1571. |
| [9] |
贾英杰, 李小江, 杨佩颖, 等. 消岩汤不同时段联合化疗对Lewis肺癌小鼠免疫功能的影响[J]. 天津中医药, 2010, 27(4): 312-314. JIA Y J, LI X J, YANG P Y, et al. Effects of XiaoYanTang combined with chemotherapy on immune function of Lewis lung cancer mice at different time periods[J]. Tianjin Journal of Traditional Chinese Medicine, 2010, 27(4): 312-314. |
| [10] |
贾英杰. 论重剂黄芪在恶性肿瘤治疗中的运用[J]. 中国中医基础医学杂志, 2016, 22(4): 540-541. JIA Y J. Application of large dose astragalus in the treatment of malignant tumors[J]. Chinese Journal of Basic Medicine in Traditional Chinese Medicine, 2016, 22(4): 540-541. |
| [11] |
TIAN X, SHEN H, LI Z, et al. Tumor-derived exosomes, myeloid-derived suppressor cells, and tumor microenvironment[J]. Journal of Hematology & Oncology, 2019, 12(1): 84. |
| [12] |
SOLITO S, MARIGO I, PINTON L, et al. Myeloid-derived suppressor cell heterogeneity in human cancers[J]. Annals of the New York Academy of Sciences, 2014, 1319(1): 47-65. DOI:10.1111/nyas.12469 |
| [13] |
郝文斌, 相芬芬, 刘巧丽, 等. 髓源抑制细胞在肿瘤微环境中的研究进展[J]. 免疫学杂志, 2017, 33(8): 729-732. HAO W B, XIANG F F, LIU Q L, et al. Research advances of myeloid inhibitory cells in tumor microenvironment[J]. Immunological Journal, 2017, 33(8): 729-732. |
| [14] |
CHONOV D C, IGNATOVA M M K, ANANIEV J R, et al. IL-6 activities in the tumour microenvironment[J]. Open Access Macedonian Journal of Medical Sciences, 2019, 7(14): 2391-2398. DOI:10.3889/oamjms.2019.589 |
| [15] |
何莉莎.疏肝健脾方对瘤前抑郁型乳腺癌MDSC-NKT细胞免疫重塑调控的研究[D].北京: 中国中医科学院, 2014. HE L S. Study on regulation of immune remodeling of MDSC-NKT cells in pre-tumor depressive breast cancer with Shugan Jianpi Prescription[D]. Beijing: China Academy of Chinese Medical Science, 2014. |
| [16] |
LIN W, LU J, CHEN B, et al. Progress in research on the effects of traditional Chinese medicine on the tumor microenvironment[J]. Chinese Journal of Integrative Medicine, 2017, 15(4): 282-287. DOI:10.1016/S2095-4964(17)60345-5 |
| [17] |
PASTAKI K A, ESKIAN M, KESHAVARZ F M, et al. Roles of myeloid-derived suppressor cells in cancer metastasis:immunosuppression and beyond[J]. Archivum Immunologiae et Therapiae Experimentalis, 2019, 67(2): 89-102. DOI:10.1007/s00005-018-0531-9 |
| [18] |
胥孜杭, 张飞, 朱杨壮壮, 等. 肿瘤微环境中不同亚型的髓源抑制性细胞及中医药对其调控作用的研究进展[J]. 中国实验方剂学杂志, 2019, 25(14): 45-54. XU Z H, ZHANG F, ZHU Y Z Z, et al. Research progress on myelosuppressive cells of different subtypes in tumor microenvironment and their regulatory effects of Traditional Chinese medicine[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(14): 45-54. |
| [19] |
陈皖晴, 张博, 曹亚娟, 等. 髓源抑制细胞介导肿瘤免疫微环境重塑及靶向治疗的研究进展[J]. 上海中医药杂志, 2019, 53(11): 92-97. CHEN W Q, ZHANG B, CAO Y J, et al. Research progress on myeloid-derived suppressor cells mediating tumor immune microenvironment remodeling and targeted therapy[J]. Shanghai Journal of Traditional Chinese Medicine, 2019, 53(11): 92-97. |
2. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2020, Vol. 37
2020, Vol. 37