1. 北京中医药大学, 北京 100029;
2. 北京中医药大学东方医院, 北京 100078;
3. 河北中医学院, 石家庄 050091
收稿日期:2020-06-16
基金项目:北京中医药大学2018年度校级青年教师项目(2018-JYBZZ-JS105)
作者简介:周兰(1994-), 女, 硕士研究生, 研究方向为中西医结合治疗生殖内分泌疾病.
复发性流产(RSA)是生育障碍的常见病症之一,临床亦称习惯性流产,主要是与相同性伴侣在妊娠20周内连续有超过2次的自然流产的现象[1]。
RSA是生殖领域的一大难点,越来越受到临床重视及关注。RSA的明确病因包括父母染色体异常(如平衡易位携带者等)、母亲子宫结构异常、内分泌异常、自身免疫异常(如抗磷脂抗体综合征)等,但仍有40%的人群无法明确病因[2],并且直接影响临床治疗方法及效果。目前对于复发性流产的研究热点聚焦于免疫排斥及免疫耐受。正常妊娠是一个类似于同种异体移植的复杂生理过程。胎儿携带的父源性白细胞组织相容性抗原(HLA)不被母体免疫系统排斥的关键,在于母胎间的免疫耐受关系。母-胎免疫耐受微环境失调是复发性流产的重要影响因素[3]。既往的研究认为,Th1/Th2细胞因子的平衡是维持生理性妊娠所必需的,其中Th1细胞诱导细胞免疫反应,与组织损伤相关,可抑制胚胎着床、滋养细胞生长和胚胎的发育,不利于妊娠的维持;Th2细胞介导B淋巴细胞增殖、抗体产生和同种免疫耐受作用[4]。近年来,辅助性T细胞家族的新成员Th17细胞,与介导免疫耐受的调节性T细胞,两者平衡的相关研究备受关注。Th17细胞可引起母胎界面剧烈的局部炎症,导致母体容受性降低,继而发生流产[5]。而介导免疫耐受的Treg细胞由于其存在免疫无能及免疫抑制的作用特点,可抑制母体对胎儿的免疫反应,进而维持妊娠[6]。有越来越多的证据表明,Treg和Th17细胞分别作为调节性和效应性细胞,参与了妊娠的建立与维持[7-10]。
目前临床对于复发性流产的常规西医治疗是补充孕激素。中医方面,复发性流产的病机主要责之脾肾两虚,气血不足。临床诸家报道多以健脾益肾、益气养血安胎为基本治疗大法[11-12]。基于此,本研究采用自然流产模型小鼠,观察中药自拟固胎煎对流产小鼠模型胚胎丢失率及Th17/Treg细胞的影响,探讨健脾益肾、益气养血安胎中药固胎煎对复发性流产的治疗机制及作用机制。
1 实验动物与试剂
1.1 动物
SPF级CBA/J雌鼠48只,BALB/C雄鼠4只,DBA/2雄鼠20只,周龄8~10周,体质量(20±2)g。CBA/J雌鼠购于北京华阜康生物科技有限公司[许可证号:SCXK(京)2014-0004];BALB/C雄鼠、DBA/2雄鼠购于北京维通利华生物科技有限公司[许可证号:SCXK(京)2016-0006]。
1.2 药物
自拟固胎煎组成:桑寄生10 g,菟丝子15 g,覆盆子10 g,苎麻根9 g,白术10 g,茯苓10 g,女贞子15 g,墨旱莲10 g,莲须6 g,中药饮片购于北京中医药大学东方医院。制备:用8倍水浸泡,过夜,先煮沸30 min,倒出药液,再加入8倍水,煮沸20 min,最后再加5倍水,煮沸20 min,合并药液并减压浓缩,最后配制成自拟固胎煎煎剂(含生药1.425 g/mL),置-20 ℃冰箱备用。地屈孕酮溶液:由地屈孕酮片[Abbott Biologicals B.V.(荷兰);批号:H20130110;规格:10 mg/片] 3片溶于200 mL蒸馏水制成,稀释至1.5×10-4 mg/mL,置-20 ℃冰箱备用。
1.3 试剂及仪器
小鼠淋巴细胞分离液(产品编号为:DKW33-R100),购自达科为生物工程有限公司;Fox P3-APC(17-5773-82)和Foxp3 Staining Buffer Set(00-5523-00),购自eBioscience公司;CD3e -PerCP-Cy5.5(561163),CD4-FITC(553047),CD25-PE(553866),Fox P3-APC(17-5773-82),RORγt-BV421(562894),FcR阻断剂(CD16/32)(553142),含1%FBS的磷酸缓冲盐溶液(PBS)和溶血素(349202),购自BD PMG公司;流式细胞仪(FacsCalibur,美国BD公司)。
2 方法
2.1 造模、分组及给药
将CBA/J雌鼠与BALB/c雄鼠2:1合笼,建立正常妊娠模型(CBA/J×BALB/c组),CBA/J雌鼠与DBA/2雄鼠2:1合笼,建立自然流产模型(CBA/J×DBA/2组)。每天20:00开始合笼,早上8:00检查阴栓,肉眼观察阴道口有无乳白色、固态胶状物,发现明显阴栓者为阳性。检出阴栓的小鼠计为妊娠第0天。正常妊娠组予0.9%生理盐水灌胃;自然流产模型组孕鼠随机分为自然流产组、地屈孕酮组、中药低剂量组(低剂量组)、中药中剂量组(中剂量组)、中药高剂量组(高剂量组),每组8只。自然流产组予0.9%生理盐水灌胃,地屈孕酮组予地屈孕酮溶液灌胃,中药低、中、高剂量组分别给予7.125、14.25、28.5 g/kg自拟固胎煎汤剂灌胃,每组灌胃量均稀释至0.4 mL,连续灌胃2周,每日1次。
2.2 胚胎吸收率的计算
孕14 d断颈处理小鼠,迅速解剖,用镊子撕开子宫,记录被吸收的胚胎数和存活胚胎数。胚胎丢失的判断标准:丢失之胚胎体积明显缩小,胎儿胎盘单位有明显出血或坏死。胚胎丢失率(ELR)的计算方法按下列公式进行:ELR=丢失胚胎数/(丢失胚胎数+存活胚胎数)×100%。
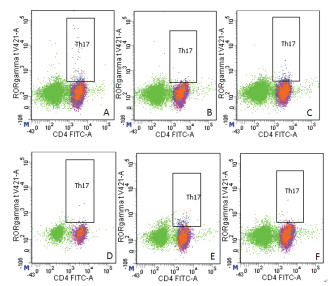
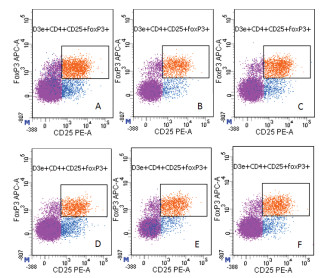
2.3 流式细胞检测脾脏Th17、Treg细胞含量
流式细胞仪检测孕鼠脾脏Th17/CD4+、Treg/CD4+细胞。研磨脾脏,并用淋巴分离液分离脾脏细胞,在试管中加入106个脾细胞,加入FcR阻断剂1 μg,混匀,室温孵育15 min;加入CD3e、CD4、CD25各1 μg,混匀,室温避光孵育30 min;加2 mL预冷的含1%FBS的PBS,500×g,5 min;弃上清,混匀;加入1 mL新鲜制备的eBioscience Fixation/Permeabilization应用液(1×);混匀,室温避光孵育60 min;加入2 mL Permeabilization Buffer(1×),500×g,5 min;弃上清,混匀,再重复此步骤1次;加入100 μL Permeabilization Buffer(1×)、1 μg Foxp3-APC和1 μg RORγt-BV421混匀,4 ℃避光30 min;加入2 mL Permeabilization Buffer(1×)500×g,5 min;弃上清液,混匀;加2 mL含1%FBS的PBS,500×g,5 min;弃上清液,混匀;加入0.2 mL PBS(1%FBS),1 h内上机获取分析。
2.4 统计学分析
所有数据使用SPSS 20.0软件包进行数据分析处理,实验数据以均数±标准差(x±s)表示。实验数据符合正态性及方差齐性组间比较采用单因素方差分析,组间两两比较采用LSD法。P < 0.05为差异有统计学意义。
3 结果
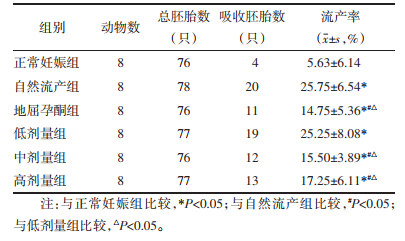
3.1 自拟固胎煎对自然流产模型孕鼠胚胎丢失率的影响
与正常妊娠组相比,自然流产组、地屈孕酮组、中药高、中、低剂量组流产率均明显升高,差异具有统计学意义(P < 0.05);与自然流产组相比,中剂量组、高剂量组和地屈孕酮组流产率均明显降低,差异有统计学意义(P < 0.05),低剂量组流产率差异无统计学意义(P>0.05);与低剂量组相比,中剂量组、高剂量组和地屈孕酮组流产率均明显降低,差异有统计学意义(P < 0.05),且组间差异无统计学意义(P>0.05)。见表 1。
表 1 各组孕鼠胚胎丢失率比较
Tab. 1
Comparison of the embryo loss rate of pregnant mice in each group
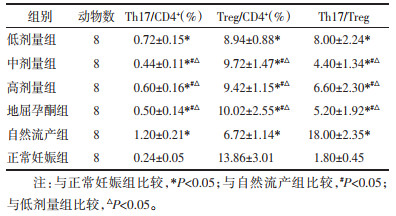
3.2 自拟固胎煎对自然流产模型孕鼠Th17/CD4+、Treg/CD4+细胞的影响
与正常妊娠组相比,自然流产组、地屈孕酮组、高剂量组、中剂量组和低剂量组Th17/CD4+细胞数及Th17/Treg细胞百分率比值均明显升高,差异具有统计学意义(P < 0.05);与自然流产组相比,中剂量组、高剂量组和地屈孕酮组Th17/CD4+细胞数及Th17/Treg细胞百分率比值均明显降低,差异有统计学意义(P < 0.05),低剂量组Th17/CD4+细胞数及Th17/Treg细胞百分率比值差异无统计学意义(P>0.05);与低剂量组相比,中剂量组、高剂量组和地屈孕酮组Th17/CD4+细胞数及Th17/Treg细胞百分率比值均明显降低,差异有统计学意义(P < 0.05),且中药中剂量组、高剂量组、地屈孕酮组3组间差异无统计学意义(P>0.05)。
与正常妊娠组相比,自然流产组、地屈孕酮组、高剂量组、中剂量组和低剂量组Treg/CD4+细胞数均明显降低,差异具有统计学意义(P < 0.05);与自然流产组相比,中剂量组、高剂量组和地屈孕酮组Treg/CD4+细胞数均明显升高,差异有统计学意义(P < 0.05),低剂量组Treg/CD4+细胞数差异无统计学意义(P>0.05);与低剂量组相比,中剂量组、高剂量组和地屈孕酮组Treg/CD4+细胞数均明显升高,差异有统计学意义(P < 0.05),且中药中剂量组、高剂量组、地屈孕酮组3组间差异无统计学意义(P>0.05)。见表 2、图 1和图 2。
表 2 各组孕鼠脾脏中Th17/CD4+、Treg/CD4+相对表达水平(x±s)
Tab. 2
Relative expression levels of Th17/CD4+, Treg/CD4+ in spleen of pregnant mice in each group(x±s)
4 讨论
Th17细胞是一种新型CD4+效应性T细胞亚群,近年来已成为不明原因复发性流产RSA机制研究的一大热点。研究发现,在妊娠期,母胎界面同种异体的胚胎抗原刺激产生的炎性介质,系统性炎症以及增加的炎性细胞因子均可能诱发Th17细胞的分化。蜕膜中的NK细胞能够通过IFN-y通路抑制Th17调节的局部炎性反应。RSA的女性患者中,NK细胞介导的调节功能丧失,Th17细胞比例明显增加,导致Th17细胞引起的局部炎症显著加剧,并最终导致母体容受性的丧失[4]。
Treg主要分为胸腺发育的天然调节T细胞(nTreg)和来源于外周的诱导性调节T细胞(iTreg)。在妊娠小鼠和人类,当母体免疫细胞第1次接触与侵入滋养层有关的胎儿抗原时,Treg的扩增发挥了关键的保护作用。Treg细胞可抑制母体对同种异体移植物胎儿的免疫反应,并在此过程中发挥重要作用,利用细胞的调节免疫,加速耐受的形成和维持妊娠[5, 13]。
Th17和Treg细胞在母-胎免疫耐受方面具有关键性的调节作用,Th17细胞分泌促炎因子,促进炎症反应;Treg细胞分泌抗炎因子,抑制免疫反应,两者虽然在功能上有拮抗作用,但在起源上具有同源性[14],它们在不同的细胞因子作用下由CD4+T细胞分化而来,在一定条件下Th17细胞和Treg细胞可相互转化[15-16]。一旦Th17/Treg平衡被打破,无论是Th17细胞增多还是Treg细胞减少,都有可能导致胚胎排斥的发生[17]。
孕激素补充是目前临床治疗RSA的常规治疗手段。研究认为,在一定孕激素水平下,孕激素受体阳性的淋巴细胞和蜕膜CD56+细胞可分泌孕激素诱导封闭因子(PIBF),诱导Th1/Th2平衡向Th2型转化,从而使Th17/Treg下调,增强母体免疫耐受,从而有利于妊娠[18-19]。本研究使用地屈孕酮作为阳性对照药,结果发现地屈孕酮组孕鼠的胚胎丢失率显著低于自然流产组,且Th17细胞、Treg细胞及其比例与自然流产组相比差异均有统计学意义,结果与文献相符。
复发性流产属于中医“滑胎”的范畴,临床公认的病机为脾肾两虚,气血不足,自拟固胎煎以补肾健脾,益气养血安胎为法,是在经方寿胎丸基础上化裁而来,方中菟丝子滋补肝肾、固精安胎为君药,桑寄生、覆盆子补肝肾,固精益血,白术、茯苓健脾益气,且茯苓能宁心安神,以上诸药合用共为臣药,亦补先天生化之本以补肾安胎,又健后天气血化生之源以安胎,女贞子、墨旱莲补肾滋阴,清热凉血,苎麻根清热安胎,以防补益药物的温补滋腻,莲须固肾涩精,四者合为佐药。诸药合用,共奏补肾健脾,清热安胎之效。纵观全方配伍精当,既补先天后天的脾肾以滋两脏之精气,又益气补血以载胎养胎,使养胎有源,固胎有力,配以清热凉血药物,合增安胎之功。本研究发现,自拟固胎煎中剂量组、高剂量组均可下调脾脏中Th17细胞的比例,上调Treg细胞比例,促使Th17/Treg平衡向Treg方向移动,降低自然流产小鼠的胚胎丢失率,效果与地屈孕酮相当,可于临床推广。
Effect of self-made Gutei Decoction on the balance of Th17/Treg cells in spleen of mice with recurrent abortion
1. Beijing University of Chinese Medicine, Beijing 100029, China;
2. Dongfang Hospital of Beijing University of Chinese Medicine, Beijing 100078, China;
3. Hebei University of Chinese Medicine, Shijiazhuang 050091, China
 2020, Vol. 37
2020, Vol. 37