文章信息
- 郭小雷
- GUO Xiaolei
- 基于JAK2-STAT3途径探讨黄连素对高糖诱导足细胞损伤的修复机制
- Study on the repairment mechanism of berberine on podocyte injury induced by high glucose based on JAK2-STAT3 pathway
- 天津中医药, 2020, 37(9): 1071-1075
- Tianjin Journal of Traditional Chinese Medicine, 2020, 37(9): 1071-1075
- http://dx.doi.org/10.11656/j.issn.1672-1519.2020.09.25
-
文章历史
- 收稿日期: 2020-06-16
糖尿病肾病(DKD)是终末期肾病最常见的病因,临床主要表现为尿蛋白渐进性增多及肾功能的逐步减退[1]。足细胞是肾小球脏层上皮细胞,对维持肾小球的结构、形态、滤过屏障的正常功能有重要作用。足细胞损伤会影响肾小球滤过功能,导致蛋白尿出现[2]。近年研究发现,酪氨酸蛋白激酶/信号转导与转录激活子(JAK-STAT)途径与DKD进行性发展密切相关。在早期和进展性DKD的肾脏多种细胞中(包括肾小球足细胞)均发现JAK-STAT基因表达增加[3]。在糖尿病小鼠的足细胞中选择性过表达JAK2 mRNA,最终导致小鼠肾功能恶化,尿蛋白增多;而给予特异性JAK1/2抑制剂后,小鼠尿蛋白排泄改善,且与DKD进展有关的多种下游基因如STAT3等正常表达[4]。
目前,特异性JAK1/2抑制剂还仍处实验阶段,现有西医治疗DKD的方法近20年未有明显变化[5]。中医药是中国传统瑰宝,黄连是清热药,在治疗消渴的方剂中多有使用,魏晋时的《名医别录》就有“黄连止消渴”的记载[6]。黄连素是由中药黄连等中提取出的生物碱,循证医学证据表明,黄连素通过降低血糖、胆固醇、C-反应蛋白的作用,不但降低血液黏稠度,从血流动力学方面改善肾小球的滤过能力,还可以减少对血管包括微血管的损害,治疗DKD,降低尿蛋白[7]。黄连素也能改善足细胞的结构和功能、抑制足细胞凋亡,其机制目前集中于抑制TLR4/NF-κB[8]、PI3K-Akt[9]通路活性,增强腺苷酸激活蛋白激酶(AMPK)活性[10]等方面。但黄连素改善足细胞功能的作用是否与JAK-STAT途径相关尚不清晰,因此本研究拟进行探讨,为临床重用黄连治疗DKD提供更多实验依据。
1 材料与方法 1.1 材料黄连素、二甲基亚砜(DMSO)、干扰素-γ(IFN-γ)、转化生长因子-β1(TGF-β1)购自Sigma公司,青链霉素双抗混合液、0.25%胰蛋白酶购自Solarbio公司,RPMI 1640购自Hyclon公司,胎牛血清购自Gibco公司,总RNA提取试剂盒、逆转录试剂盒、定量聚合酶链反应(qPCR)试剂盒购自北京康为世纪有限公司。小鼠来源JAK2(AHO1352)和STAT3(MA1-13042)单抗购自Thermo Fisher Scientific公司,兔来源磷酸化JAK2(phospho Tyr1007,GTX32203)和磷酸化STAT3(phospho Tyr705,GTX24740)多抗购自GeneTex公司。
所用仪器为Nikon光学显微镜、Bio-Tek酶标仪、Bio-rad凝胶图像分析系统、ABI 7500型荧光定量PCR仪等。
1.2 方法 1.2.1 足细胞培养和分组将冻存的MPC-5条件永生化小鼠足细胞复苏,在含有10 U/mL IFN-γ、10%胎牛血清、1%青链霉素双抗的RPMI 1640培养液中,33 ℃、5%CO2培养箱传代。传代后在37 ℃、5%CO2培养箱内用无IFN-γ的培养基培养10~14 d使细胞分化。
将细胞分为正常糖浓度组(5 mmol/L葡萄糖)、高糖浓度组(30 mmol/L葡萄糖)、高糖+10 μmol/L黄连素组、高糖+25 μmol/L黄连素组和高糖+50 μmol/L黄连素组。正常糖浓度组常规培养;其余各组使用相应培养基培养48 h。
1.2.2 噻唑蓝(MTT)法检测足细胞存活率取对数生长期的细胞,调整密度为1×105/mL,接种于96孔板,每孔100 μL,于37 ℃、5% CO2培养箱中培养,待细胞融合后,更换无血清培养基继续培养8 h使细胞同步。按上述实验分组,加入相应培养基继续培养48 h后,每孔加入5 g/L的MTT溶液10 μL,培养4 h,弃上清,每孔加入150 μL DMSO,混匀10 min,采用酶标仪于490 nm测定各孔的吸光度,计算细胞存活率。每组设5个复孔。
1.2.3 Transwell实验检测足细胞迁移能力取对数生长期的细胞,调整密度为1×105/mL,采用24孔transwell小室,上室加入200 μL细胞悬液,下室中加入600 μL完全培养基,于37 ℃、5% CO2培养箱中培养,待细胞融合后,更换无血清培养基继续培养8 h使细胞同步。按上述实验分组,加入相应培养基继续培养48 h后,取出小室,用磷酸盐缓冲溶液(PBS)漂洗,结晶紫染色,将上室中的细胞用棉签擦去,倒置显微镜下观察,每个样本随机选取10个视野,计算每个视野的细胞数。
1.2.4 白蛋白流量率检测法测定足细胞屏障功能取对数生长期的细胞,调整密度为1×103/mL,采用24孔transwell小室,上室加入200 μL细胞悬液,下室中加入600 μL完全培养基,于37 ℃、5% CO2培养箱中培养,待细胞融合后,更换无血清培养基继续培养8 h使细胞同步。按上述实验分组,加入相应培养基继续培养48 h后,1×PBS洗涤2次,然后给上室更换完全培养基,下室更换含有40 mg/mL小牛血清白蛋白的完全培养基,于37 ℃培养1 h后,取上层培养液,BCA法测定上层培养基中的白蛋白浓度。
1.2.5 实时定量聚合酶链反应(RT-qPCR)检测基因表达收集各组细胞,提取总RNA后测定纯度和浓度,将总RNA逆转录为cDNA。将cDNA、上下游引物、荧光染料等加入反应体系中,RT-qPCR法检测。PCR反应条件为件:95 ℃预变性10 min;变性95 ℃ 5 s;退火、延伸60 ℃ 34 s;重复40个循环,70~95 ℃绘制融解曲线。反应体系为25 μL。引物由苏州金维智公司合成。引物序列:JAK2为5’-CGTCTC- GGAGGAGCGGAT-3’和5’-CTGGGGAGGGAAAA- CAGTTCA-3’;STAT3为5’-CGGATCGCTGAGGT- ACAACC-3’和5’-TCAGGGGTCTCGACTGT-3’。GAPDH为5’-CTGCTCCTCCCTGTTCCA-3’和5’-TGGCAACAATCTCCACTTTGC-3’。所有样品重复检测3次,2-ΔΔCt法计算mRNA相对表达量。
1.2.6 蛋白免疫印迹(Western Blot)法检测蛋白表达收集各组细胞,RIPA提取液提取总蛋白,BCA法定量后,蛋白样品进行10%SDS聚丙烯酰胺凝胶电泳、转膜、封闭后,分别与JAK2(1:1 000)、p-JAK2(1:1 000)、STAT3(1:1 000)、p-STAT3(1:1 000)的Ⅰ抗杂交,再经与HRP标记的Ⅱ抗杂交、化学发光显色等步骤,Bio-rad凝胶图像分析系统测定光密度值。每个样品重复测量3次,取均值分析。实验以β-actin作为内参照物。
2 统计分析使用SPSS 20.0软件进行数据分析。计量资料以均数±标准差(x±s)表示;多组间比较采用单因素方差分析;组间多重比较采用LSD法(方差齐)/Dunnett’s T3法(方差不齐)。P < 0.05为差异有统计学意义。
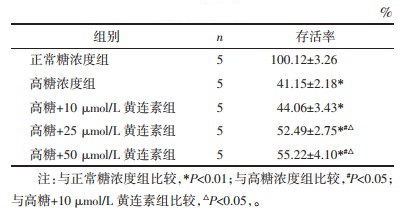
3 结果 3.1 对足细胞存活率的影响与正常糖浓度组相比,高糖刺激后足细胞存活率明显降低(P < 0.01),而黄连素各组能不同程度促进足细胞存活,且呈浓度依懒性(P < 0.05,P < 0.01)。但黄连素25 μmol/L组与50 μmol/L组差异无统计学意义,见表 1。
与正常糖浓度组相比,高糖刺激能明显增加足细胞的迁移能力(P < 0.01),黄连素各组能明显减少足细胞迁移,且呈浓度依懒性(P < 0.05,P < 0.01)。但黄连素25 μmol/L组与50 μmol/L组差异无统计学意义,见表 2。
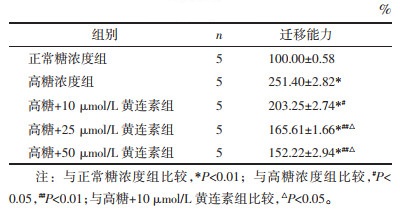
白蛋白流量率体现了足细胞的屏障功能。与正常糖浓度组相比,高糖刺激增加了白蛋白的渗漏,提示糖浓度提高削弱了足细胞单层屏障功能(P < 0.01);而黄连素各组能不同程度降低白蛋白渗漏,说明黄连素能增强足细胞的屏障功能,且呈浓度依懒性(P < 0.05或P < 0.01)。但黄连素25 μmol/L组与50 μmol/L组差异无统计学意义,见表 3。
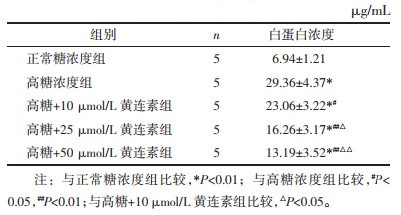
与正常糖浓度组相比,高糖刺激能增加JAK2和STAT3 mRNA表达量(P < 0.01);而黄连素各组能不同程度降低其表达,且呈浓度依赖性(P < 0.05或P < 0.01)。但黄连素25 μmol/L组与50 μmol/L组差异无统计学意义,见表 4。
|
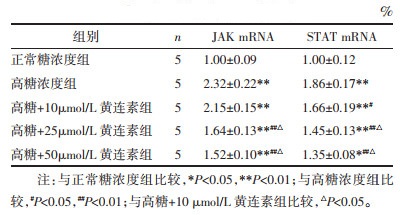
与正常糖浓度组相比,高糖刺激增加JAK2和STAT3总蛋白及磷酸化蛋白的表达量(P < 0.05);而黄连素各组能不同程度降低其总蛋白及磷酸化蛋白的表达量,且在一定程度上呈浓度依懒性(P < 0.05),见图 1。
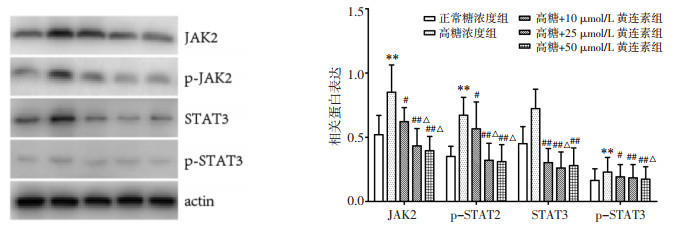
|
| 注:与正常糖浓度组比较,*P<0.05,**P<0.01;与高糖浓度组比较,#P<0.05,##P<0.01;与高糖+10 μmol/L黄连素组比较,△P<0.05。 图 1 各组足细胞JAK和STAT蛋白表达比较(x±s) Fig. 1 Comparison of JAK and STAT protein expression in podocytes of each group(x±s) |
足细胞是维持肾小球滤过屏障结构和功能完整的重要细胞。足细胞是肾小球脏层上皮细胞,高糖、糖基化终末产物、转化生长因子-β(TGF-β)等都可损伤足细胞,导致其向间充质细胞转分化并获得分泌功能,分泌细胞外基质增多,最终导致肾小球硬化[11]。足细胞结构和功能的异常导致肾小管萎缩和功能损伤,是导致蛋白尿并促使DKD发生发展的关键因素,因此减轻足细胞损伤是治疗DKD的关键。
JAK-STAT信号通路的激活与DKD的发病密切相关。高糖、糖基化终末产物、血管紧张素Ⅱ、过氧化应激、血管内皮生长因子等多种能促进DKD发展发展的病理因素,均能激活JAK2/STAT3通路[12]。在早期或进展性DKD患者中,肾小球和肾小管间质中JAK和STAT基因各亚型的表达均大幅增加[3]。而baricitinib(JAK1和JAK2选择性抑制剂)可减少DKD患者的蛋白尿,甚至在停药4周后,中高剂量组减少蛋白尿的作用仍能维持[5]。使小鼠足细胞过表达JAK2,发现对无糖尿病小鼠没有任何影响;但却导致糖尿病小鼠尿白蛋白明显增加、系膜扩张、足细胞密度减少、肾小球硬化和肾小球基底膜增厚。口服JAK1/JAK2抑制剂两周后,上述病理变化显著改善[4]。给予STAT3活性降低的转基因小鼠以链脲佐菌素,使其发生糖尿病,该小鼠在蛋白尿、系膜扩张、细胞增殖、巨噬细胞浸润、炎症和异常基质合成等方面均降低[13];口服JAK1/JAK2抑制剂可使STAT3等许多与DKD进展有关的下游基因的表达恢复正常。上述研究结果提示,足细胞内JAK2及STAT3的活化及表达增加对DKD发生发展非常关键。本研究结果显示,高糖诱导使足细胞存活率降低、迁移能力提高;并使JAK2和STAT3 mRNA和蛋白表达量提高。提示高糖刺激损伤了足细胞的屏障功能,而这一作用与JAK2/STAT3通路活性升高相关。
黄连素是从黄连、黄柏等中药中提取出的一种生物碱,对与DKD密切相关的病理机制,如糖脂代谢、胰岛素抵抗[14]、炎症[8]、氧化损伤[15]等均有改善;因而具有良好的肾保护作用。黄连素能有效缓解早期DKD患者的临床症状,降低其空腹血糖、糖化血红蛋白及尿微量白蛋白排泄率[16]。黄连素能降低链脲佐菌素诱导的DKD大鼠的空腹血糖、肾质量体质量比、24 h尿蛋白、血肌酐和血尿氮水平;还可减轻DKD大鼠全身及肾脏的炎症反应[8]。黄连素可抑制由高糖所导致的肾小球系膜细胞的增殖与肥大、改善肾小球纤维化,其机制涉及调节细胞周期蛋白表达,使细胞周期停滞于G1期[17];抑制鞘氨醇激酶-1-磷酸鞘氨醇(SphK/S1P)通路活性[18];抑制激活蛋白1(AP-1)活化[19];抑制核因子κB(NF-κB)的核移位和转录活性,进而抑制其下游靶基因转录[20]等多种信号通路。黄连素对足细胞也有保护作用,其改善足细胞的结构和功能、抑制足细胞凋亡的机制与抑制TLR4/NF-κB[8]、PI3K-Akt[9]通路,增强AMPK活性[10]等有关。最新研究表明,黄连素可以通过降低动力相关蛋白1(Drp1)激活来保护足细胞线粒体的结构与功能,从而使足细胞免于凋亡[21]。但目前尚未见黄连素调节JAK-STAT通路进而保护足细胞的相关报道。本研究结果表明,黄连素对高糖引起的足细胞功能损伤具有明显的保护作用,黄连素各浓度均能提高足细胞的存活率,减少其迁移能力,改善其屏障功能;且均能降低JAK2和STAT3 mRNA及蛋白的表达。本研究结果与前人研究结果一致,均发现过表达JAK2导致足细胞密度减少;且也证实黄连素对足细胞屏障功能的改善作用,与调节JAK-STAT通路活性相关。
综上所述,黄连素能保护高糖诱导的足细胞损伤,提高足细胞在高糖环境下的存活率、降低其迁移率,维持其屏障功能,其机制可能与调控JAK2和STAT3基因与蛋白表达有关。
| [1] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J]. 中华糖尿病杂志, 2018, 10(1): 4-67. The Diabetes Branch of Chinese Medical Association. Guidelines for the prevention and treatment of type 2 diabetes in China (2017)[J]. Chinese Journal of Diabetes Mellitus, 2018, 10(1): 4-67. |
| [2] |
BROSIUS F C, TUTTLE K R, KRETZLER M. JAK inhibition in the treatment of diabetic kidney disease[J]. Diabetologia, 2016, 59(8): 1624-1627. DOI:10.1007/s00125-016-4021-5 |
| [3] |
BERTHIER C C, ZHANG H, SCHIN M L, et al. Enhanced expression of Janus kinase-signal transducer and activator of transcription pathway members in human diabetic nephropathy[J]. Diabetes, 2009, 58(2): 469-477. DOI:10.2337/db08-1328 |
| [4] |
ZHANG H, SAHA J, ATKINS K B, et al. Podocyte JAK2 augments glomerular injury induced by diabetes and angiotensin Ⅱ[J]. Journal ofAmerican Society of Nephrology, 2012, 23: 478A. |
| [5] |
TUTTLE K R, BROSIUS F C, ADLER S G, et al. JAK1/JAK2 inhibition by berberine in diabetic kidney disease:results from a Phase 2 randomized controlled clinical trial[J]. Nephrology Dialysis Transplantation, 2018, 33(11): 1950-1959. DOI:10.1093/ndt/gfx377 |
| [6] |
张青, 李琰, 陈磊. 黄连素对2型糖尿病及其并发症的治疗作用及相关机制研究进展[J]. 中国中药杂志, 2015, 40(9): 1660-1665. ZHANG Q, LI Y, CHEN L. Effect of berberine in treating type 2 diabetes mellitus and complications and its relevant mechanisms[J]. China Journal of Chinese Materia Medica, 2015, 40(9): 1660-1665. |
| [7] |
姚金铭, 宋秀玲, 王焕君, 等. 黄连素(小檗碱)治疗糖尿病肾病疗效和安全性的系统评价[J]. 中华临床医师杂志(电子版), 2015, 9(23): 110-114. YAO J M, SONG X L, WANG H J, et al. Efficacy and safety of berberine in treatment of diabetic nephropathy:a meta analysis[J]. Chinese Journal of Clinicians (Electronic Edition), 2015, 9(23): 110-114. |
| [8] |
ZHU L, HAN J, YUAN R, et al. Berberine ameliorates diabetic nephropathy by inhibiting TLR4/NF-κB pathway[J]. Biological Research, 2018, 51(1): 9. |
| [9] |
NI W J, ZHOU H, DING H H, et al. Berberine ameliorates renal impairment and inhibits podocyte dysfunction by targeting the phosphatidylinositol 3-kinase-protein kinase B pathway in diabetic rats[J]. Journal of Diabetes Investigation, 2019, 11(2): 297-306. |
| [10] |
JIN Y, LIU S, MA Q, et al. Berberine enhances the AMPK activation and autophagy and mitigates high glucose-induced apoptosis of mouse podocytes[J]. European Journal of Pharmacology, 2017(794): 106-114. |
| [11] |
MAEZAWA Y, TAKEMOTO M, YOKOTE K. Cell biology of diabetic nephropathy:roles of endothelial cells, tubulointerstitial cells and podocytes[J]. Journal of Diabetes Investigation, 2015, 6(1): 3-15. |
| [12] |
ZHANG H, NAIR V, SAHA J, et al. Podocyte-specific JAK2 overexpression worsens diabetic kidney disease in mice[J]. Kidney International, 2017, 92(4): 909-921. DOI:10.1016/j.kint.2017.03.027 |
| [13] |
LU T C, WANG Z H, FENG X, et al. Knockdown of Stat3 activity in vivo prevents diabetic glomerulopathy[J]. Kidney International, 2009, 76(1): 63-71. DOI:10.1038/ki.2009.98 |
| [14] |
王媛. 黄连素对2型糖尿病患者血脂及胰岛素抵抗的影响及机制研究[J]. 糖尿病新世界, 2016, 9(19): 27-28. WANG Y. Berberine blood lipids in patients with type 2 diabetes mellitus and the effect of insulin resistance and mechanism research[J]. Diabetes New World, 2016, 9(19): 27-28. |
| [15] |
WANG B, XU X, HE X, et al. Berberine improved Aldo-induced podocyte injury via inhibiting oxidative stress and endoplasmic reticulum stress pathways both in vivo and in vitro[J]. Cellular Physiology and Biochemistry, 2016, 39(1): 217-228. DOI:10.1159/000445618 |
| [16] |
王媛. 黄连素治疗早期糖尿病肾病的疗效观察[J]. 中国现代药物应用, 2016, 10(21): 86-87. WANG Y. Observation on the efficacy of berberine in the treatment of early diabetic nephropathy[J]. Chinese Modern Drug Application, 2016, 10(21): 86-87. |
| [17] |
LAN T, WU T, CHEN C, et al. Berberine attenuates high glucose-induced proliferation and extracellular matrix accumulation in mesangial cells:involvement of suppression of cell cycle progression and NF-κB/AP-1 pathways[J]. Molecular and Cellular Endocrinology, 2014, 384(1-2): 109-116. DOI:10.1016/j.mce.2014.01.022 |
| [18] |
HUANG K, LIU W, LAN T, et al. Berberine reduces fibronectin expression by suppressing the S1P-S1P2 receptor pathway in experimental diabetic nephropathy models[J]. PLOS One, 2012, 7(8): e43874. DOI:10.1371/journal.pone.0043874 |
| [19] |
LAN T, LIU W, XIE X, et al. Berberine suppresses high glucose-induced TGF-β1 and fibronectin synthesis in mesangial cells through inhibition of sphingosine kinase 1/AP-1 pathway[J]. European Journal of Pharmacology, 2012, 697(1-3): 165-172. DOI:10.1016/j.ejphar.2012.10.003 |
| [20] |
LIU W, ZHANG X, LIU P, et al. Effects of berberine on matrix accumulation and NF-kappa B signal pathway in alloxan-induced diabetic mice with renal injury[J]. European Journal of Pharmacology, 2010, 638(1-3): 150-155. DOI:10.1016/j.ejphar.2010.04.033 |
| [21] |
QIN X, ZHAO Y, GONG J, et al. Berberine protects glomerular podocytes via inhibiting Drp1-mdiated mitochondrial fission and dysfunction[J]. Theranostics, 2019, 9(6): 1698. DOI:10.7150/thno.30640 |
 2020, Vol. 37
2020, Vol. 37