文章信息
- 陈丽, 王霄霜, 周忠志, 赵思如, 胡晋婷, 谭滢, 高兰天, 王婷婷
- CHEN Li, WANG Xiaoshuang, ZHOU Zhongzhi, ZHAO Siru, HU Jinting, TAN Ying, GAO Lantian, WANG Tingting
- 仙藕乳蒲方对糖尿病大鼠皮肤溃疡创面愈合及线粒体的影响
- Effect of Xian'ou Rupu Recipe on skin ulcer wound healing and mitochondria in diabetic rats
- 天津中医药, 2021, 38(1): 93-97
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(1): 93-97
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.01.21
-
文章历史
- 收稿日期: 2020-09-20
2. 汕头大学医学院第一附属医院, 汕头 515041;
3. 湖南中医药大学第一附属医院, 长沙 410007
糖尿病溃疡(DU)发病率高,具有难愈、易感染等特点,其难愈主要与线粒体功能缺陷有关[1-2]。研究表明,高糖环境下线粒体结构破坏致产生的三磷酸腺苷(ATP)不能满足机体能量需求、产生过多的活性氧分子(ROS)可能为糖尿病并发症发生的共同机制[3-4]。因此,关注糖尿病溃疡中线粒体结构和功能障碍,为改善溃疡愈合中能量代谢缺陷、降低氧化应激状态从而促进愈合有重大意义。前期研究表明[5],仙藕乳蒲方可加快小鼠创面愈合,蛋白质组学分析表明其作用的关键蛋白定位在线粒体中。因此,本课题组通过制作糖尿病大鼠溃疡模型,电镜下观察两组溃疡组织中线粒体结构,检测创面组织ATP、ROS含量,探究仙藕乳蒲方对糖尿病溃疡中线粒体功能的具体影响,为临床糖尿病溃疡治疗提供新方法。
1 材料与方法 1.1 实验动物从湖南斯莱克景达实验动物有限公司购买雄性SD大鼠48只(SPF级,体质量180~220 g,许可证号:SYXK湘2016-0002)。实验期间动物饲养于湖南中医药大学第一附属医院实验室(许可证号:SYXK湘2015-0003),温度维持在20~22 ℃。实验操作遵循实验室动物伦理准则和使用指南。
1.2 实验药品与试剂仙藕乳蒲方即仙鹤草、藕节、乳香、蒲黄粉制剂,由湖南中医药大学第一附属医院制剂室参考课题组已发表论文制备[6]。0.1 mol/L柠檬酸钠缓冲液(北京索莱宝科技有限公司,批号Cat#C1013,100 mL)。链脲佐菌素(STZ,上海翊圣生物科技有限公司,批号:60256ES60,100 mg),6-正丙基-2-硫代尿嘧啶(上海源叶生物科技有限公司,批号:530643,25 g),猪胆酸钠(上海源叶生物科技有限公司,批号:S30219,100 g),食用猪油(GB/T8937,生产许可QS430102030013),吐温-80(天津市科密欧化学试剂有限公司,批号:20130128,500 mL),1、2-丙二醇(湖南省天虹试剂有限公司,批号:20160412,500 mL),Rat ROS酶联免疫吸附测定(ELISA)Kit(武汉贝茵莱生物科技有限公司,批号:RA20694),Rat ATP ELISA Kit(武汉贝茵莱生物科技有限公司,批号:RA20768),酶标仪(Labsystems Multiskan MS,型号:352型),洗板机(Thermo Labsystems,型号:AC-8),离心机(国产微量高速离心机,型号:TG16W,培养箱(国产隔水式恒温培养箱,型号GNP-9080),HT7700透射电子显微镜(日本日立公司,批号2114-05)。
1.3 高脂乳剂的配制取50 g胆固醇分次加入研钵中,研磨至无亮光后将其加入已融化的100 g猪油。加入同时注意搅拌,待充分混匀后依次加入1 g丙硫氧嘧啶、10 g胆酸钠、100 mL已预热的吐温-80和100 mL已预热的丙二醇,最后缓慢加入蒸馏水定容至500 mL。
1.4 STZ溶液的配制在避光条件下取出冷冻保存的STZ粉末100 mg和冷藏保存的柠檬酸钠缓冲液,配制浓度为20 mg/mL的STZ溶液,时间控制在半小时内。
1.5 分组及糖尿病大鼠溃疡模型制备所有大鼠使用高脂乳剂每日2 mL/只连续灌胃14 d后,按照40 mg/kg的剂量腹腔注射STZ溶液建立大鼠糖尿病模型。3 d后,尾静脉采血,测定任意血糖水平,连续3 d血糖≥16.7 mmol/L则为糖尿病模型造模成功。将糖尿病大鼠随机分为模型对照组、仙藕乳蒲方组,按照10%水合氯醛3.5 mL/kg剂量对两组糖尿病大鼠腹腔注射进行麻醉,在背部剃毛形成1个4 cm×4 cm正方形裸皮区域,用络合碘与乙醇消毒处理后在大鼠背部用打孔器创设1个直径为1 cm的圆形全层皮肤缺损区域,即成功建立糖尿病大鼠背部溃疡模型。仙藕乳蒲方组大鼠创面敷以仙藕乳蒲方粉末,模型对照组创面不予处理。
1.6 标本采集大鼠于伤后第3天、第7天、第14天处死,冰上取材,从背部切取一个以创面为中心的2 cm×2 cm的深至腹膜的正方形组织块。将取下的组织块放入磷酸盐缓冲溶液(PBS)中清洗3次,分为3份,电镜样本放入2.5 %的戊二醛溶液固定,并于4 ℃保存,送电镜室检测。ATP及ROS检测样本置于2 mL冻存管中,-80 ℃冰箱冻存,行ELISA检测。
1.7 指标检测 1.7.1 创面愈合率于造模对应时间点用标尺标记溃疡创面并用相机拍下,再通过图像分析软件Image pro plus 6.0计算创面面积,创面愈合率A(%)=(原始创面面积-观察时间点创面面积)/原始创面面积×100%。
1.7.2 电镜观察创面溃疡组织形态将标本送中南大学湘雅医院电镜室,经脱水、浸透、包埋、聚合、切片等步骤制作好切片后,利用透射电镜观察大鼠糖尿病溃疡创面细胞超微结构改变且拍照。
1.7.3 ELISA检测ATP含量按照ELISA试剂盒的实验步骤进行操作,实验的大致步骤如下:
1)将皮肤组织样本消化为组织液。
2)标准品的稀释:准备6支做好标记的小试管,向所有试管中加入标准品稀释液100 μL,然后取原浓度标准品100 μL加入第1支试管中,轻轻混匀,再依次从上1支试管中取100 μL液体加入下1支试管并混匀,到第5支试管时,取100 μL液体丢弃,第6支试管作为标准0,则最终各管标准品的浓度为3 200、1 600、800、400、200、0 nmol/L。在酶标包被板上设标准品孔,依次加入上述浓度的标准品50 μL。
3)添加样品:分别设空白对照孔及待测样品孔,先加40 μL样品至待测样品孔,然后再加10 μL生物素化的抗ATP抗体。
4)加酶:向所有待测孔加入酶标试剂50 μL。
5)温育:用封板膜封板后于37 ℃下温育30 min。
6)配液:用蒸馏水30倍稀释浓缩洗涤液后备用。
7)洗涤:小心揭掉封板膜,丢弃液体,甩干,每孔加满洗涤液,静置30 s后弃去,如此重复5次,拍干。
8)显色:每孔先后加入显色剂A与B各50 μL,轻轻振荡混匀,37 ℃避光显色10 min。
9)终止:每孔加终止液50 μL,终止反应,此时见蓝色转黄色。
10)测定:在加终止液后15 min以内,以空白孔调零,于450 nm波长处依序测量各孔的吸光度(OD值)。
1.7.4 ELISA检测ROS含量按照ELISA试剂盒的实验步骤进行操作,标准品稀释后各管浓度分别是:12、6.0、3.0、1.5、0.75、0 U/mL,加样时加生物素化的抗ROS抗体10 μL,其余同上。
1.8 统计学方法采用SPSS 22.0统计软件进行数据处理,实验数据以均数±标准差(x±s)表示,计量资料两个样本间的比较采用独立样本t检验,P < 0.05为差异具有统计学意义。
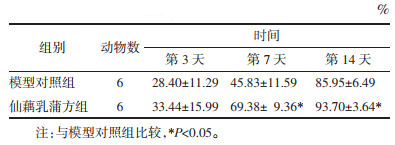
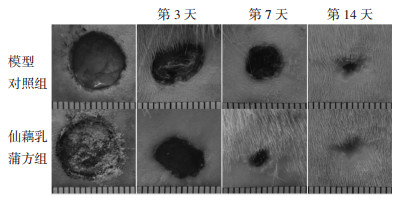
2 结果 2.1 两组溃疡创面愈合率与模型对照组相比,创面愈合第7、14天,仙藕乳蒲方组创面愈合加速,且创面愈合率差异具有统计学意义(P < 0.05)。见图 1、表 1。
|
| 图 1 两组溃疡创面不同时间点肉眼观察 Fig. 1 Visual observation of ulcer wounds in two groups at different time points |
创面愈合第3天,模型对照组胶原纤维较少;肿胀线粒体多、部分嵴消失(见图 2A);内质网少且伴部分扩张、脱颗粒;仙藕乳蒲方组胶原纤维丰富,排列紧密;线粒体轻度肿胀,少数嵴消失(见图 2B);粗面内质网数量多,颗粒附着明显。第7天,模型对照组胶原纤维减前稀疏,排列散乱;细胞核内容物松散染色浅;线粒体结构破坏严重,肿胀较前加重,伴聚集、挤压、融合等改变(见图 2C);未见明显内质网;仙藕乳蒲方组胶原纤维丰富,排列紧密有序;细胞核内容物致密染色深;线粒体肿胀较前减轻,较多可见清楚嵴结构的线粒体(见图 2D)。第14天,模型对照组胶原纤维较前丰富,肿胀线粒体数量减少,部分可见清楚嵴结构(见图 2E);仙藕乳蒲方组胶原纤维丰富,线粒体未见明显肿胀,形态正常、嵴结构清楚的线粒体聚集(见图 2F)。
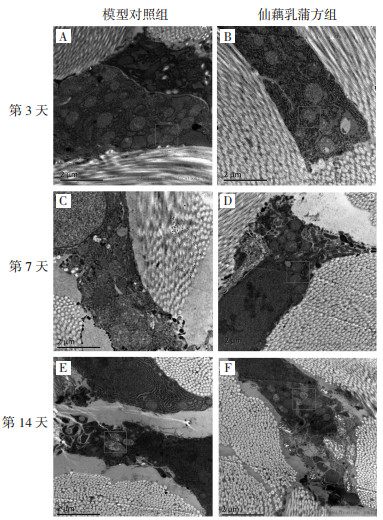
|
| 图 2 两组创面皮肤组织超微结构(×10 000) Fig. 2 Ultrastructure of the wound skin tissue of rats between two groups(×10 000) |
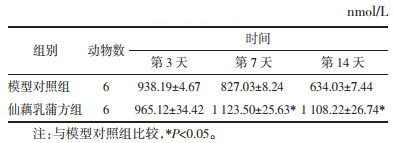
与模型对照组相比,创面愈合第7、14天时仙藕乳蒲方组ATP含量均高于模型对照组,且差异具有统计学意义(P < 0.05)。见表 2。
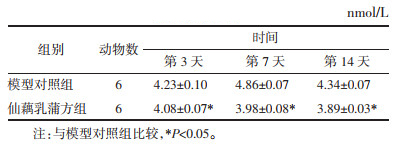
与模型对照组相比,创面愈合第7、14天时仙藕乳蒲方组ROS含量均低于模型对照组,且差异具有统计学意义(P < 0.05)。见表 3。
近年来,糖尿病溃疡发病率增高,且因其长期不愈、反复感染、病理机制复杂等临床特点,目前仍是临床治疗的重点难点[7]。线粒体是有氧代谢的枢纽,通过呼吸链递氢递电子参与生物氧化。胡永胜等[8]研究发现,糖尿病大鼠创面存在线粒体功能障碍、能量代谢失衡及三大营养物质合成与分解水平下降的特点,导致了创面的修复障碍。且有研究表明,在糖尿病进程中,持续高糖环境作用下可导致细胞线粒体结构损伤,进而使氧化呼吸链无法发挥正常功能,这一方面使得ROS产生增加,造成高水平氧化应激状态,而后者已被证实[9]是导致糖尿病溃疡难愈的重要机制;另一方面线粒体作为人体能量生成的主要场所,被破坏后无法维持细胞能量代谢,ATP产生减少,使得机体包括创面修复在内的各种生命活动受阻。有实验证实[10],红外光可通过刺激光感受器细胞色素C氧化酶,使大鼠糖尿病创面能量产生增加、物质代谢加快,进而促进细胞和组织修复。由此可见,线粒体正常结构的维持和功能的发挥可被看作糖尿病溃疡治疗过程中的关键环节。
目前,随着对各种疾病发病机制及治疗的深入研究,线粒体已经成为许多诸如肝病、心脏病、阿尔茨海默病等疾病治疗的靶点,且线粒体在糖尿病溃疡治疗方面的作用逐渐引起重视,但其作为糖尿病溃疡的治疗靶点的相关研究却相对较少,尤其在中医药方面。仙藕乳蒲方由仙鹤草、藕节、乳香和蒲黄四味中药制成,在急慢性创面愈合中均起到一定疗效。前期研究[5]发现,仙藕乳蒲方可加快小鼠创面愈合,且蛋白质组学分析表明差异表达蛋白主要定位在线粒体中,但仙藕乳蒲方对糖尿病溃疡皮肤组织中线粒体的影响尚不清楚。
本研究通过构建糖尿病大鼠溃疡模型发现,使用仙藕乳蒲方干预后,在愈合中晚期大鼠溃疡愈合加速,且在透射电镜下观察到此时溃疡皮肤组织成纤维细胞中线粒体破坏程度更轻,结构完整的线粒体丰富。与此同时,ELISA结果显示出在愈合中晚期,仙藕乳蒲方组创面组织中ATP含量更高,而ROS含量则更低。这表明在糖尿病溃疡愈合的第7、14天,仙藕乳蒲方可通过减轻高糖环境下线粒体结构损伤和功能障碍,改善细胞能量代谢,降低氧化应激水平,从而改善组织愈合环境,加快糖尿病溃疡愈合进程。另外,笔者的研究中发现在溃疡愈合第3天,仙藕乳蒲方组的ROS水平较模型对照组低,且差异具有统计学意义,这可能与线粒体并不是ROS的唯一来源有关,也证实了在糖尿病高糖环境下线粒体是氧化应激损伤的主要靶位,即持续的氧化应激与线粒体损伤之间互为因果、恶性循环[11-12],仙藕乳蒲方可能还作用于其他分子通路而降低糖尿病溃疡创面的氧化应激水平,有待深入探讨研究。
综上,笔者证实仙藕乳蒲方具有通过防护线粒体损伤,促进糖尿病溃疡愈合的疗效,为其临床应用提供理论依据,此外,这也为研发以线粒体为靶点治疗糖尿病溃疡愈合药物提供了新的思路。
| [1] |
侯清涛, 李芸, 李舍予, 等. 全球糖尿病疾病负担现状[J]. 中国糖尿病杂志, 2016, 24(1): 92-96. HOU Q T, LI Y, LI S Y, et al. Current situation of global diabetes burden[J]. Chinese Journal of Diabetes, 2016, 24(1): 92-96. |
| [2] |
范润萍, 徐笑红. 线粒体与2型糖尿病的相关性研究进展[J]. 中华全科医学, 2017, 15(4): 672-676. FAN R P, XU X H. Research progress on the correlation between mitochondria and type 2 diabetes[J]. Chinese Journal of General Practice, 2017, 15(4): 672-676. |
| [3] |
赵天雪, 王琛. 线粒体自噬与糖尿病发病及其并发症发生的研究进展[J]. 上海医学, 2018, 41(2): 125-128. ZHAO T X, WANG C. Research progress on mitochondrial autophagy and the incidence and complications of diabetes[J]. Shanghai Medical Journal, 2018, 41(2): 125-128. |
| [4] |
郭晓玲, 康丽霞, 任美芳, 等. 黄芪多糖对糖尿病肾病肾小管上皮细胞凋亡、转分化及ROS含量的影响研究[J]. 中国免疫学杂志, 2018, 34(3): 388-392. GUO X L, KANG L X, REN M F, et al. Effects of astragalus polysaccharides on apoptosis, transdifferentiation and ROS content of renal tubular epithelial cells in diabetic nephropathy[J]. Chinese Journal of Immunology, 2018, 34(3): 388-392. DOI:10.3969/j.issn.1000-484X.2018.03.014 |
| [5] |
CHEN L, HOU Q, ZHOU Z Z, et al. Comparative proteomic analysis of the effectof the four-herb chinese medicine ANBP on promoting mouse skin wound healing[J]. The International Journal of Lower Extremity Wounds, 2017, 16(3): 154-162. DOI:10.1177/1534734617720623 |
| [6] |
HOU Q, HE W J, HAO H J, et al. The four-herb chinese medicine ANBP enhances wound healing and inhibits scar formation via bidirectional regulation of transformation growth factor pathway[J]. PLoS One, 2014, 9(12): e112274. DOI:10.1371/journal.pone.0112274 |
| [7] |
刘鹏, 朱子昭, 常柏, 等. 生肌象皮膏对糖尿病溃疡大鼠Ang/Tie-2通路的影响[J]. 天津中医药, 2018, 35(2): 127-130. LIU P, ZHU Z Z, CHANG B, et al. Effect of Shengji Xiangpi mastic on diabetic ulcer rats Ang/Tie-2 pathway[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(2): 127-130. |
| [8] |
胡永胜, 徐鹏涛, 叶胜捷, 等. 核磁共振代谢组学方法研究雷公藤红素对大鼠糖尿病溃疡促愈合作用机制[J]. 分析化学, 2018, 46(2): 170-177. HU Y S, XU P T, YE S J, et al. Study on the mechanism of Tripterine in promoting healing of diabetic ulcer in rats by nuclear magnetic resonance metabolomics[J]. Chinese Journal of Analytical Chemistry, 2018, 46(2): 170-177. |
| [9] |
朱万博. 糖尿病患者创面难愈机制及治疗研究进展[J]. 中国糖尿病杂志, 2016, 24(12): 1135-1139. ZHU W B. Research progress of wound healing mechanism and treatment of diabetic patients[J]. Chinese Journal of Diabetes, 2016, 24(12): 1135-1139. DOI:10.3969/j.issn.1006-6187.2016.12.018 |
| [10] |
CHEN B, KAO H K, DONG Z, et al. Complementary effects of negative-pressure wound therapy and pulsed radiofrequency energy on cutaneous wound healing in diabetic mice[J]. Plastic and Reconstructive Surgery, 2017, 39(1): 105-117. |
| [11] |
YUE S, HU Y D, WANG X H, et al. Relationship between mitochondrial dysfunction, oxidative stress and diabetic retinopathy[J]. International Journal of Ophthalmology, 2014, 14(12): 2176-2178. |
| [12] |
李泽君, 呼丹, 熊克朝, 等. 活性氧与线粒体损伤研究概述[J]. 中南药学, 2014, 12(10): 989-993. LI Z J, HU D, XIONG K C, et al. Research overview of reactive oxygen species and mitochondrial injury[J]. Central South Pharmacy, 2014, 12(10): 989-993. |
2. The First Affiliated Hospital of Shantou University Medical College, Shantou 515041, China;
3. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha 410007, China
 2021, Vol. 38
2021, Vol. 38