文章信息
- 江茜, 王宏, 王蕾, 康利, 李燕林
- JIANG Qian, WANG Hong, WANG Lei, KANG Li, LI Yanlin
- 尿毒康通过抑制p38/ERK MAPK通路改善UUO大鼠肾小管细胞上皮-间质转化
- Niaodukang improves epithelial-mesenchymal transition of renal tubular epithelial cells in UUO rats by inhibiting p38/ERK MAPK pathway
- 天津中医药, 2021, 38(1): 103-108
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(1): 103-108
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.01.23
-
文章历史
- 收稿日期: 2020-08-24
2. 中山市中医院, 中山 528400
近年来,慢性肾脏病(CKD)的发病率呈上升趋势,CKD常合并贫血、骨代谢异常、心血管并发症等多种并发症,严重影响患者的生理状态和生活质量,并增加患者的死亡风险[1-2]。肾纤维化是CKD的主要病理改变,是由肾小球硬化和肾小管间质纤维化之间的不平衡,细胞外基质(ECM)合成过多引起[3],包括肾小球硬化(GS)、肾间质纤维化(TIF)和血管硬化。其典型病理表现为肾小球内固有细胞数量减少、细胞外基质过度沉积、肾间质成纤维细胞增生及间质毛细血管丧失[4]。丝裂原活化蛋白激酶(MAPKs)是一种胞浆内广泛分布的丝氨酸/苏氨酸蛋白激酶,在真核细胞中,由4条平行的信号转导通路组成,即细胞外信号调节蛋白激酶1/2(ERK1/2)通路、c-Jun氨基末端激酶(JNK)和应激活化蛋白激酶(SAPK)通路、p38丝裂原活化蛋白激酶(p38 MAPK)通路和细胞外信号调节蛋白激酶5(ERK5)/大丝裂原活化蛋白激酶1(BMK1)通路[5]。最新的研究发现,ANGPTL2通过MEK/ERK/Nrf-1途径调节自噬并影响糖尿病性肾病肾纤维化的进展[6]。Roscovitine通过重组人转化生长因子-β(TGF-β1)/p38MAPK途径减轻糖尿病小鼠的肾间质纤维化[7]。
中医中药在预防和治疗CKD中发挥日益重要的作用[8]。百日草(RDP)通过经典和非经典的转化生长因子TGF-β信号转导途径改善了单侧输尿管结扎法(UUO)诱导的肾纤维化[9]。清肾补阳方通过抑制上皮间质转化(EMT)和Wnt/β-Catenin途径减轻5/6肾切除大鼠的肾纤维化[10]。芪丹地黄汤通过抑制核转录因子-κB(NF-κB)途径减轻糖尿病肾纤维化[11]。肾康注射液可减轻阻塞性肾病中的肾小管间质纤维化[12]。当归芍药散通过调节缺氧和自噬减轻肾脏纤维化[13]。黄葵胶囊通过抑制NOD样受体热蛋白结构域3(NLRP3)炎性小体和激活Toll样受体4(TLR4)/NF-κB信号传导,减轻糖尿病肾病的肾小管EMT,抑制肾纤维化[14]。尿毒康是中山市中医院自主研发的中药制剂,从1992年开始即以汤剂在临床中使用。该药由大黄、丹参、黄芪、红花、地榆等药物组成,黄芪益气健脾为方中主药,配伍红花、丹参活血化瘀,大黄泻浊逐瘀以通肾络,地榆凉血解毒,诸药相合,扶正祛邪,攻补相宜。尿毒康针对慢性肾功能衰竭湿浊内留,气虚血瘀的本虚标实之病机,具有祛湿浊,通肾络,益气健脾的功效。动物实验发现尿毒康合剂能够降低慢性肾功能衰竭大鼠的血清肌酐(SCr)和尿素氮含量,调节脂质代谢,改善肾功能[15]。临床试验发现,尿毒康能降低患者SCr水平,改善肾功能,延缓终末期肾病发展[16-19]。尿毒康能增强机体的排毒能力,减轻肾损伤改善肾功能衰竭[18, 20]。然而,尿毒康改善肾纤维化的具体机制至今没有研究。因此,文章通过单侧输尿管结扎法,构建大鼠肾纤维化模型,考察尿毒康改善肾纤维化的机制。
1 实验方法 1.1 UUO复制肾间质纤维化模型大鼠体质量(208.60±6.05)g,45 mg/kg戊巴比妥钠腹腔注射麻醉,右侧卧位固定于手术台上,剪毛后用碘酊-75%乙醇消毒手术区,行左侧腹切口,逐层切开皮肤、肌肉及腹壁各层,暴露并分离左侧输尿管,手术线结扎两道,然后在两道结扎点间剪断输尿管,逐层缝合。假手术组仅切开腹腔,游离左侧输尿管,但不结扎和剪断。
1.2 分组及给药将UUO大鼠按体质量随机分为假手术组、模型组、阳性药对照组(氯沙坦钾片,30 mg/kg,10 mL/kg,相当于临床给药剂量的6倍)、尿毒康20 mL/kg组、10 mL/kg组和5 mL/kg组(分别相当于临床给药剂量的12倍、6倍和3倍)。手术第2天开始给药。假手术组和模型组灌胃给予等体积纯净水,每日1次,连续21 d。各实验组大鼠10只。实验过程中模型组死亡大鼠2只,尿毒康高剂量死亡大鼠3只,低剂量死亡大鼠1只。假手术组、阳性药对照组、尿毒康中剂量组未见死亡大鼠。
1.3 尿液和血清生化检测末次给药后,收集大鼠24 h尿液,测定24 h尿蛋白。45 mg/kg戊巴比妥钠腹腔注射麻醉大鼠,腹主动脉取血,分离血清,检测SCr水平。
1.4 组织病理学观察取结扎侧肾脏(左侧),纵向剖开,10%中性甲醛固定,制成石蜡切片。苏木精-伊红(HE)染色观察大鼠肾组织的病理改变。Masson染色观察纤维化程度。Masson染色后,显微镜下观察,随机选取10个视野,按病变面积占该视野的百分比评分,无计0分、小于25%计1分、25%~50%计2分、大于50%计3分。
1.5 实时定量聚合酶链反应(qRT-PCR)检测TGF-β和α-平滑肌肌动蛋白(α-SMA)mRNA表达取肾脏组织剪碎后加入1 mL Trizon后反复吹打,使样本充分裂解。加入200 μL氯仿,剧烈振荡15 s,室温放置2 min。4 ℃ 12 000 r/min离心15 min,离心半径8 cm,取上层水相层。加入等体积的异丙醇,颠倒混匀,室温放置10 min。4 ℃ 12 000 r/min离心10 min,弃上清。加入1 mL 75%乙醇洗涤沉淀。4 ℃ 12 000 r/min离心5 min,离心半径8 cm,弃上清,挥干。加入30 μL无RNase的水溶解。根据HiFiScript g DNA Removal cDNA Synthesis Kit(康为世纪,Cat:CW2582M)说明书配制反应体系,42 ℃ 15 min,85℃ 5 min逆转录为cDNA。根据UltraSYBR Mixture(Low ROX)(康为世纪,Cat:CW2601M)进行实时定量反应:预变性95 ℃ 5 min,(变性95 ℃ 15 s,退火60 ℃ 1 min,延伸72 ℃ 30 s)45 cycles,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。2-ΔΔCt计算mRNA的相对变化。
取肾脏组织,磷酸盐缓冲液(PBS)洗净,加入蛋白裂解液,充分裂解后,4 ℃ 12 000 r/min离心15 min,离心半径8 cm,取上清液,蛋白定量,变性后进行SDS-PAGE电泳。电泳结束后,甲醇活化PVDF膜,按滤纸、凝胶、PVDF膜、滤纸的顺序组装;组装完成后按PVDF膜在正极,凝胶在负极,置于转膜槽中,200 mA恒流转2 h。5%脱脂奶粉室温闭1 h。一抗p38(CST,1:1 000),ERK(CST,1:1 000),β-actin(CST,1:1 000),4 ℃孵育过夜。1×TBST洗3次,每次5 min;二抗(HRP标记的羊抗兔IgG抗体,1:3 000),室温2 h,洗膜,ECL成像系统发光显影,采用Image J软件分析条带灰度值。
1.7 统计学方法应用SPSS 22.0软件进行统计学分析,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD法,以P < 0.05为差异有统计学意义。
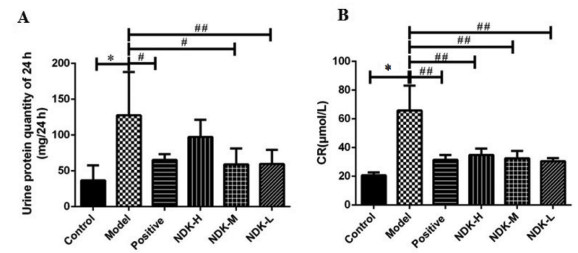
2 结果 2.1 尿毒康能改善UUO大鼠的肾功能对各组大鼠24 h尿蛋白含量进行检测,发现与假手术组相比,UUO模型大鼠24 h尿蛋白明显升高(P < 0.01),见图 1A;与模型组相比,阳性药对照组和尿毒康组较UUO模型大鼠24 h尿蛋白定量水平(P < 0.05或P < 0.01)明显降低,其中尿毒康10 mL/kg组下降明显。随后,检测了大鼠SCr的变化,发现模型组SCr水平明显升高(P < 0.01),见图 1B;与模型组相比,阳性对照组和尿毒康组SCr水平明显降低(P < 0.01)。说明尿毒康能够改善UUO大鼠的肾功能。见图 1。
|
| 注:A.大鼠24 h尿蛋白定量,B.大鼠SCr水平;Control:假手术组,Model:UUO模型组,Positive:阳性药对照组,NDK-H:尿毒康20 mL/kg组,NDK-M:尿毒康10 mL/kg组,NDK-L:尿毒康5 mL/kg组;与Control比较,*P < 0.01;与Model比较,#P < 0.05,##P < 0.01。 图 1 尿毒康对UUO大鼠肾功能的影响 Fig. 1 Effect of Niaodukang on renal function of UUO rats |
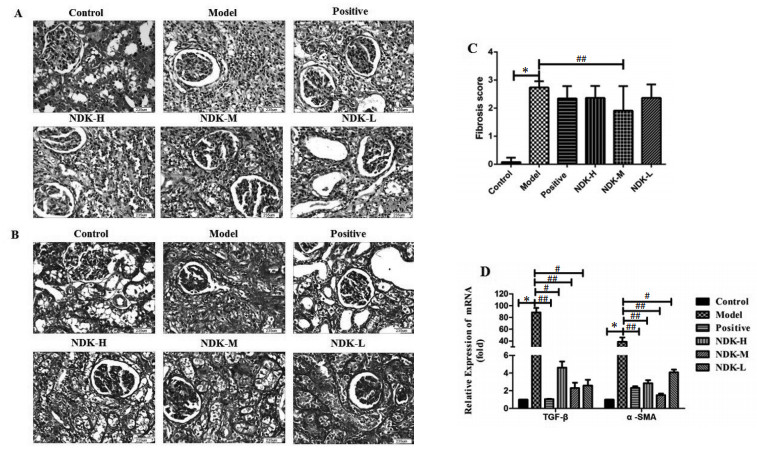
大体观察发现:假手术组肾脏大小正常,表面光滑,切面见肾实质厚度正常,皮髓质分界清晰,未见肾盂、肾盏扩张;模型组肾脏体积增大,成囊状,肾切面可见实质菲薄,皮、髓质分界不清,肾盂和肾盏高度扩张、变形。尿毒康各剂量组和阳性药对照组肾脏体积增大较模型组小,肾盂和肾盏高度扩张、变形程度轻。肾组织HE染色发现:假手术组肾小球体积未见缩小或肥大,数目未见减少,肾小管上皮细胞未见变性、坏死或脱落,管腔中未见管型及结石,肾间质未见炎细胞浸润及纤维组织增生;模型组肾小管广泛萎缩及代偿扩张,部分区域可见肾实质细胞明显减少,多数肾小囊增宽,并出现部分肾小球的崩解,大多数肾小管萎缩,上皮细胞变性坏死,局部管腔扩张明显,髓质区失去放线结构,伴有大量炎细胞浸润。尿毒康各剂量组和阳性药对照组病理表现较模型组肾小球形态、肾小管形态、肾间质、炎细胞浸润方面有所改善。其中尿毒康10 mL/kg组在间质纤维化程度方面改善相对明显。见图 2A。
|
| 注:A.肾脏组织HE染色(×200);B.肾脏组织Masson染色(×200);C.肾纤维化评分;D. qRT-PCR检测纤维化关键因子TGF-β和α-SMA mRNA的变动;Control:假手术组,Model:UUO模型组,Positive:阳性药对照组,NDK-H:尿毒康20 mL/kg组,NDK-M:尿毒康10 mL/kg组,NDK-L:尿毒康5 mL/kg组;与Control比较,*P < 0.01;与Model比较,#P < 0.05,##P < 0.01。 图 2 尿毒康对UUO大鼠肾脏纤维化的影响 Fig. 2 Effect of Niaodukang on renal fibrosis significantly of UUO rats |
Masson染色发现:模型组肾间质增宽、间质成纤维细胞大量增生,胶原纤维形成。半定量分析显示模型组肾间质纤维化程度明显高于假手术组(P < 0.01);尿毒康10 mL/kg组能够明显减轻UUO大鼠肾间质纤维化程度(P < 0.01)。见图 2B和2C。
随后,qRT-PCR检测了纤维化关键因子TGF-β和α-SMA的mRNA的表达,发现UUO模型大鼠TGF-β,α-SMA mRNA表达增加,而尿毒康组较UUO模型组TGF-β,α-SMA mRNA表达表达下降。以上结果表明尿毒康能够明显改善肾纤维化,且尿毒康10 mL/kg作用最明显。见图 2D。
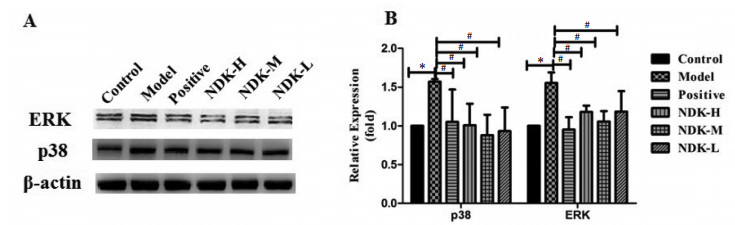
2.3 尿毒康抑制p38/ERK MAPK通路改善肾纤维化为了进一步研究尿毒康改善肾纤维化的机制,检查了MAPK通路关键蛋白p38,ERK的表达,发现UUO模型大鼠p38,ERK的表达增加,而尿毒康组较模型组p38,ERK表达下降。说明尿毒康改善肾纤维化可能与抑制了p38/ERK MAPK通路有关。见图 3。
|
| 注:A. Western Blot检测MAPK通路蛋白p38,ERK的表达;B. p38、ERK蛋白表达灰度值分析;Control:假手术组,Model:UUO模型组,Positive:阳性药对照组,NDK-H:尿毒康20 mL/kg组,NDK-M:尿毒康10 mL/kg组,NDK-L:尿毒康5 mL/kg组;与Control比较,*P < 0.05;与Model比较,#P < 0.05。 图 3 尿毒康对MAPK通路的影响 Fig. 3 Effect of Niaodukang on MAPK pathway |
中医学中没有肾纤维化的病名,但从肾纤维化形成的病理基础来看,其与血瘀证密切相关,具体为脏腑功能虚损,脾肾虚为主,兼有浊毒内阻,病情逐步发展而加重,最后导致正气虚衰,浊邪阻滞。研究发现,清肾补阳方[10]、芪丹地黄汤[11]、当归芍药散[13]等在防治肾纤维化方面具有显著的效果,显示了中医药在治疗肾纤维化应用中的良好前景。尿毒康由大黄、何首乌、女贞子、黄芩等药组成,具有益气温阳,健脾益肾,活血泻浊的功能,切中慢性肾功能衰竭脾肾气(阳)虚为本,湿浊瘀血为标的病机。大黄具有泻湿浊、逐瘀血、荡涤胃肠、清热解毒之功效,此外,大黄还具有抗菌,抗凝,降血黏,改善氨基酸、脂质代谢,抑制肾小球系膜细胞等作用,故大黄长期以来用于慢性肾功能衰竭的治疗。丹参中的成分Magnesium Lithospermate B能提高肾组织活性氧清除酶活性,抑制过氧化脂质丙二醛(MDA)的产生,从而改善肾小球滤过、肾小管重吸收功能。丹酚酸A通过抑制NF-κB和p38 MAPK信号通路来减轻5/6肾切除大鼠的肾脏损伤和炎症[21]。丹参和红花协同活瘀血、通肾络,增加尿量,加速毒素从尿中排泄。黄芪具有健脾益气,扩张血管,改善肾血流,促进蛋白质合成的作用。诸药合用,具有化瘀解毒、利湿泻浊、健脾益气功效。本实验首先通过单侧输尿管结扎,成功复制了大鼠肾纤维化模型,通过灌胃给与不同浓度的尿毒康,证实了临床等效剂量的尿毒康能够明显改善UUO大鼠的肾小管细胞上皮-间质转化。在进一步的机制探讨中发现,尿毒康能够降低TGF-β的表达,TGF-β为肾纤维化进展的重要因子。已有研究发现TGF-β上调ERK途径,导致肾小管细胞胶原沉积和肾纤维化[22]。于是通过Western Blot检测了p38与ERK的表达,发现模型组p38与ERK表达增加,尿毒康组p38与ERK表达下降。p38与ERK是MAPK通路的关键蛋白,p38 MAPK通路为控制炎性反应最主要的MAPK家族成员之一,可被TGF-β激活,参与应激条件下的细胞凋亡、免疫调节、细胞转分化及炎性反应过程。本实验发现给予尿毒康后,p38与ERK表达降低,MAPK通路抑制,因此,尿毒康能够通过抑制p38/ERK MAPK通路改善肾小管细胞上皮-间质转化的肾纤维化。但是尿毒康能否改善其他脏器的纤维化,扩大尿毒康的临床应用仍需进一步的研究。
| [1] |
MALEKMAKAN L, KHAJEHDEHI P, PAKFETRAT M, et al. Prevalence of chronic kidney disease and its related risk factors in elderly of southern Iran:A population-based study[J]. Isrn Nephrology, 2015, 2013(2): 427230-427230. |
| [2] |
ROCCO M V, CHAPMAN A, CHERTOW G M, et al. Chronic kidney disease classification in systolic blood pressure intervention trial:comparison using modification of diet in renal disease and CKD-epidemiology collaboration definitions[J]. American Journal of Nephrology, 2016, 44(2): 130-140. DOI:10.1159/000448722 |
| [3] |
NOGUEIRA A, PIRES M J, OLIVEIRA P A. Pathophysiological mechanisms of renal fibrosis:a review of animal models and therapeutic strategies[J]. In Vivo, 2017, 31(1): 1-22. DOI:10.21873/invivo.11019 |
| [4] |
黎凤仪. 肾纤维化的中西医治疗进展[J]. 山西中医, 2013, 29(5): 55-58. LI F Y. Progress in treatment of renal fibrosis with traditional Chinese medicine and Western medicine[J]. Shanxi Journal of Traditional Chinese Medicine, 2013, 29(5): 55-58. DOI:10.3969/j.issn.1000-7156.2013.05.033 |
| [5] |
刘婷婷, 张淑萍, 覃筱燕, 等. MAPK信号转导通路与神经损伤研究进展[J]. 中国公共卫生, 2016, 32(2): 248-254. LIU T T, ZHANG S P, QIN X Y. Progress in studies on MAPK signal transduction pathway and nerve injury[J]. Chinese Journal of Public Health, 2016, 32(2): 248-254. |
| [6] |
HUANG H, NI H, MA K, et al. ANGPTL2 regulates autophagy through the MEK/ERK/Nrf-1 pathway and affects the progression of renal fibrosis in diabetic nephropathy[J]. American Journal of Translational Research, 2019, 11(9): 5472-5486. |
| [7] |
WANG S, ZHOU Y, ZHANG Y, et al. Roscovitine attenuates renal interstitial fibrosis in diabetic mice through the TGF-β1/p38 MAPK pathway[J]. Biomedicine & Pharmacotherapy, 2019, 115: 108895. |
| [8] |
戚莉, 王晓柠, 刘平, 等. 中药口服治疗肾纤维化随机对照试验的系统评价[J]. 中国中西医结合肾病杂志, 2014, 15(12): 1059-1065. QI L, WANG X N, LIU P, et al. Systematic review of randomized controlled trials of traditional Chinese medicine for oral treatment of renal fibrosis[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2014, 15(12): 1059-1065. |
| [9] |
GU L, WANG Y, YANG G, et al. Ribes Diacanthum Pall (RDP) ameliorates UUO-induced renal fibrosis via both canonical and non-canonical TGF-β signaling pathways in mice[J]. Journal of Ethno-pharmacology, 2019, 231: 302-310. DOI:10.1016/j.jep.2018.10.023 |
| [10] |
ZHANG X, FANG J, CHEN Z, et al. Qingshen Buyang Formula attenuates renal fibrosis in 5/6 nephrectomized rats via inhibiting EMT and Wnt/β-Catenin pathway[J]. Evidence-based Complementary and Alternative Medicine, 2019, 2019: 5370847. |
| [11] |
MA F, LI L, WANG Q, et al. Qi-dan-di-huang decoction alleviates diabetic nephropathy by inhibiting the NF-kappaB pathway[J]. Frontiers in Bioscience-Landmark, 2019, 24: 1477-1486. DOI:10.2741/4792 |
| [12] |
LIU Y, SHI G, YEE H, et al. Shenkang injection, a modern preparation of Chinese patent medicine, diminishes tubulointerstitial fibrosis in obstructive nephropathy via targeting pericyte-myofibroblast transition[J]. American Journal of Translational Research, 2019, 11(4): 1980-1996. |
| [13] |
ZHANG M Y, CHEN H H, TIAN J, et al. Danggui Shaoyao San ameliorates renal fibrosis via regulation of hypoxia and autophagy[J]. Evidence-based Complementary and Alternative Medicine, 2019, 2019: 2985270. |
| [14] |
HAN W, MA Q, LIU Y, et al. Huangkui capsule alleviates renal tubular epithelial-mesenchymal transition in diabetic nephropathy via inhibiting NLRP3 inflammasome activation and TLR4/NF-κB signaling[J]. Phytomedicine, 2019, 57: 203-214. DOI:10.1016/j.phymed.2018.12.021 |
| [15] |
罗清, 顾向明, 苏小茹, 等. 尿毒康合剂改善慢性肾功能衰竭大鼠的实验研究[J]. 中华中医药学刊, 2007, 26(7): 1421-1423. LUO Q, GU X M, SU X R, et al. Experimental study on the effect of Niaodukang mixture on rats with chronic renal failure[J]. Chinese Archives of Traditional Chinese Medicine, 2007, 26(7): 1421-1423. |
| [16] |
李燕林, 杨楠, 林凯旋, 等. 中药"慢肾康"对血液透析患者残余肾功能的保护作用观察[J]. 中国中西医结合急救杂志, 1999, 6(12): 564-565. LI Y L, YANG N, LIN K X, et al. Observation on protective actions of traditional Chinese medicine Manshenkang on residual renal functions in patients on hemodialysis[J]. Chinese Journal of Integrated Traditional and Western Medicine in Intensive and Critical Care, 1999, 6(12): 564-565. DOI:10.3321/j.issn:1008-9691.1999.12.014 |
| [17] |
李燕林, 何训昌, 缪灿铭. 慢肾康延缓慢性肾衰竭的远期疗效临床研究[J]. 中国中西医结合肾病杂志, 2002, 3(3): 163. LI Y L, HE X C, MIAO C M. Clinical study of long-term efficacy of Manshenkang on slow renal failure[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2002, 3(3): 163. DOI:10.3969/j.issn.1009-587X.2002.03.016 |
| [18] |
李燕林, 安海文, 凌小浩, 等. 中药尿毒康口服液对急性肾小管坏死肾组织自由基影响的实验研究[J]. 中国中医急症, 2008, 17(9): 1265-1267. LI Y L, AN H W, LING X H, et al. Experimental study on the effect of Chinese medicine Niaodukang Oral Liquid on free radicals in acute renal tubular necrosis[J]. Journal of Emergency in Traditional Chinese Medicine, 2008, 17(9): 1265-1267. DOI:10.3969/j.issn.1004-745X.2008.09.047 |
| [19] |
李燕林, 安海文, 凌小浩, 等. 中药尿毒康对急性肾小管坏死初发期保护作用的研究[J]. 中国中西医结合急救杂志, 2008, 15(4): 216-218. LI Y L, AN H W, LING X H, et al. Study on the protective effect of traditional Chinese medicine Niaodukang on the acute stage of acute tubular necrosis[J]. Chinese Journal of Integrated Traditional and Western Medicine in Intensive and Critical Care, 2008, 15(4): 216-218. DOI:10.3321/j.issn:1008-9691.2008.04.007 |
| [20] |
李李, 李燕林. 尿毒康合剂保留灌肠治疗慢性肾衰竭临床研究[J]. 时珍国医国药, 2017, 28(6): 1375-1377. LI L, LI Y L. Clinical study on the treatment of chronic renal failure with Niaodukang retention enema[J]. Lishizhen Medicine and Materia Medica Research, 2017, 28(6): 1375-1377. |
| [21] |
ZHANG H F, WANG Y L, GAO C, et al. Salvianolic acid A attenuates kidney injury and inflammation by inhibiting NF-κB and p38 MAPK signaling pathways in 5/6 nephrectomized rats[J]. Acta Pharmacologica Sinica, 2018, 39(12): 1855-1864. DOI:10.1038/s41401-018-0026-6 |
| [22] |
XIAO H B, LIU R H, LING G H, et al. HSP47 regulates ECM accumulation in renal proximal tubular cells induced by TGF-β1 through ERK1/2 and JNK MAPK pathways[J]. American Journal of Physiology-Renal Physiology, 2012, 303(5): F757-765. DOI:10.1152/ajprenal.00470.2011 |
2. Zhongshan Hospital of Traditional Chinese Medicine, Zhongshan 528400, China
 2021, Vol. 38
2021, Vol. 38