文章信息
- 郭小雷
- GUO Xiaolei
- 黄连素调节miR-29b抑制高糖诱导的MPC-5足细胞上皮-间质转化研究
- Study on the berberine regulates miR-29b to inhibit epithelial-mesenchymal transition of MPC-5 podocytes induced by high glucose
- 天津中医药, 2021, 38(1): 113-118
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(1): 113-118
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.01.25
-
文章历史
- 收稿日期: 2020-08-15
糖尿病肾病(DKD)是由糖尿病引起的最严重的并发症,也是终末期肾病最常见的病因,其中足细胞病变是DKD的主要病理表现之一。足细胞是肾小球脏层上皮细胞,对维持肾小球的结构、形态、滤过屏障的正常功能具有重要作用[1]。病理情况下足细胞损伤后出现上皮向间充质细胞转分化(EMT),获得分泌功能,促使细胞外基质分泌增多,最终引起肾小球硬化及纤维化[2]。而减轻足细胞损伤能可延缓DKD进展[3]。
miRNAs是一类长度约18~22 bp的非编码小分子RNA,在糖尿病及DKD的发生发展过程中起着重要的调控作用。其中miR-29b与肾纤维化相关,其在盐敏感小鼠、单侧输尿管梗阻小鼠及链脲佐菌素诱导的糖尿病大鼠的肾脏中均表达下降[4]。降低的miR-29b无法抑制胶原基质的形成,导致肾纤维化的发生发展。
糖尿病肾病在中医属于“消渴病肾病”范畴。黄连是传统的清热类中药,在治疗消渴的方剂中多有使用,魏晋时的《名医别录》就有“黄连止消渴”的记载[5]。黄连素是由中药黄连等中提取出的生物碱,循证医学证据表明,黄连素通过降低血糖、胆固醇、C-反应蛋白的作用,不但降低血液黏稠度,从血流动力学方面改善肾小球的滤过能力,还可以减少对血管包括微血管的损害,治疗糖尿病肾病,降低尿蛋白[6]。前期临床实践发现,重用黄连的方剂对DKD有较好疗效。但黄连素对足细胞的保护作用,特别是保护足细胞免于EMT转化的机制研究较少,且这种保护作用是否由miR-29b介导也不清楚。因此,本研究拟将肾小球足细胞损伤与miR-29b相联系,探讨黄连素对足细胞损伤的作用,为临床采用黄连素治疗DKD提供实验依据。
1 材料与方法 1.1 材料黄连素、二亚基化砜(DMSO)、干扰素-γ(IFN-γ)、重组人转化生长因子-β1(TGF-β1)购自Sigma公司,青链霉素双抗混合液、0.25%胰蛋白酶购自Solarbio公司,RPMI 1640购自Hyclon公司,胎牛血清、Opti-MEM Reduced Serum Medium购自Gibco公司:Trizol、miScript Reverse Transcriptase Kit、miScript SYBR Green PCR Kit、Lipofectane 2000购自Qiagen公司。限制性内切酶、双萤光素酶报告基因试剂盒(Renilla-Firefly Luciferase Dual Assay Kit)购自美国Promega公司;RIPA裂解液、电泳缓冲液、转膜缓冲液等购自博士德公司;PVDF膜购自Millipore公司;α-平滑肌肌动蛋白(α-SMA,MA5-11547)和肌间线蛋白(desmin,MA5-16357)单抗、podocin(PA5-37284)多抗购自Thermo Fisher Scientific公司。ELISA试剂盒购购自德国IBL公司。
所用仪器为Nikon光学显微镜、Bio-Tek 800酶标仪、Bio-rad凝胶图像分析系统、ABI 7500型荧光定量PCR仪等。
1.2 方法 1.2.1 足细胞培养和分组将冻存的MPC-5条件永生化小鼠足细胞复苏,在含有10 U/mL IFN-γ、10%胎牛血清、1%青链霉素双抗的RPMI 1640培养液中,33 ℃、5%CO2培养箱传代。传代后在37 ℃、5%CO2培养箱内用无IFN-γ的培养基培养10~14 d使细胞分化。
1.2.2 黄连素对MPC-5细胞转分化的影响取对数生长期的细胞,调整密度为1×105个细胞/mL,接种于96孔板,每孔100 μL,于37 ℃、5% CO2培养箱中培养,待细胞融合后,更换无血清培养基继续培养8 h使细胞同步。将细胞分为正常组(Control,5 mmol/L葡萄糖)、高糖组(HG,30 mmol/L葡萄糖)和高糖+50 μmol/L黄连素组(HG+Ber)。正常组常规培养;其余各组使用相应培养基培养48 h。酶联免疫吸附(ELISA)法测定培养液上清液中的TGF-β1;收集细胞,实时定量聚合酶链反应(RT-qPCR)法测定miR-29b表达;Western blot法检测EMT相关蛋白α-SMA、desmin、podocin的表达。
RT-qPCR法:收集各组细胞,提取总RNA后测定纯度和浓度,将5 μg总RNA逆转录为cDNA。将cDNA、引物、荧光染料等加入反应体系中,依试剂盒说明书进行RT-qPCR检测。PCR反应条件:95℃ 10 min,95℃ 15 s,60 ℃ 1 min,共40个循环。反应体系为20 μL。引物由上海生工合成。引物序列:mmu-miR-29b逆转录引物采用茎环结构,为5'-CTCAA-CTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAAC-ACTGA-3',RT-qPCR引物为5'-ACACTCCAGCTG-GGTAGCACCATTTGAAA-3'和5'-TGGTGTCGTGGAGTCG-3',内参U6 snRNA引物为5'-CTCGCTT-CGGCAGCACA-3'和5'-AACGCTTCACGAATTTG-CGT-3'。所有样品重复检测3次,2-ΔΔCt法计算miR-29b的相对表达量。
Western blot法检测蛋白表达:收集各组细胞,RIPA提取液提取总蛋白,BCA法定量后,蛋白样品进行10% SDS聚丙烯酰胺凝胶电泳、转膜、封闭后,分别与α-SMA(1:1 000)、desmin(1:1 000)、podocin(1:1 000)的一抗杂交,再经与HRP标记的二抗杂交、化学发光显色等步骤,Bio-rad凝胶图像分析系统测定光密度值。每个样品重复测量3次,取均值分析,实验以GAPDH作为内参照物。
1.2.3 miR-29b过表达对转分化的影响取对数生长期的细胞,调整密度为1×105个细胞/mL,接种于12孔板。将细胞分为正常组(Control,5 mmol/L葡萄糖)、高糖组(HG,30 mmol/L葡萄糖)、高糖+miR-29b mimic NC组(HG+mimic NC)和高糖+miR-29b mimic组(HG+mimic)。于37 ℃、5% CO2培养箱中培养至60%~70%融合后,更换无双抗培养基培养过夜。更换Opti-MEM培养基,在Lipofectamine 2000的介导下转染miR-29b mimic NC或mimic,培养6 h。更换各组相应培养基继续培养至48 h。取培养液上清液,ELISA法测定其中的TGF-β1;收集细胞,Western blot法检测EMT相关蛋白α-SMA、desmin、podocin的表达。
1.2.4 双荧光素酶报告基因实验检测miR-29b与TGF-β1是否直接结合将TGF-β1基因3’-UTR克隆至pGL3质粒,构建pGL3-TGF-β1野生型载体和突变型载体。取对数生长期的细胞,调整密度为1×105个细胞/mL,接种于12孔板,于37 ℃、5% CO2培养箱中培养至60%~70%融合后,更换无双抗培养基培养过夜。更换Opti-MEM培养基,在Lipofectamine 2000的介导下共转染pGL3-TGF-β1野生或突变型载体及miR-29b mimic,5% CO2培养箱中37 ℃培养24 h。依双荧光素酶检测试剂盒说明书处理细胞,多功能酶标仪测定荧光强度。
1.2.5 下调miR-29b表达对黄连素抑制转分化的影响取对数生长期的细胞,调整密度为1×105个细胞/mL,接种于12孔板。将细胞分为正常组(Control,5 mmol/L葡萄糖)、高糖组(HG,30 mmol/L葡萄糖)、高糖+50 μmol/L黄连素组(HG+Ber)、高糖+50 μmol/L黄连素+miR-29b inhibitor NC组(HG+Ber+inhibitor NC)和高糖+50 μmol/L黄连素+miR-29b inhibitor(HG+Ber+inhibitor)组。于37 ℃、5% CO2培养箱中培养至60%~70%融合后,更换无双抗培养基培养过夜。更换Opti-MEM培养基,在Lipofectamine 2000的介导下转染miR-29b inhibitor NC或inhibitor,培养6 h。更换各组相应培养基继续培养至48 h。取培养液上清液,ELISA法测定其中的TGF-β1;收集细胞,Western blot法检测EMT相关蛋白α-SMA、desmin、podocin的表达。
2 统计分析使用SPSS 24.0软件进行数据分析。计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间多重比较方差齐时采用LSD法,方差不齐时采用Dunnett’s T3法,P < 0.05为差异有统计学意义。
3 结果 3.1 黄连素对MPC-5细胞转分化的影响高糖培养48 h后,高糖组miR-29b表达较正常组显著降低;而高糖+黄连素组的miR-29b表达较高糖组明显增加(P < 0.01)。高糖组培养液上清液中TGF-β1浓度较正常组上升,而高糖+黄连素组培养液上清液中TGF-β1浓度较高糖组明显下降(P < 0.01)。进一步分析显示,高糖组EMT相关蛋白α-SMA、desmin表达较正常组上升,podocin表达较正常组下降,而高糖+黄连素组α-SMA、desmin表达较高糖组下降,podocin表达较高糖组上升(均P < 0.01)。见图 1。
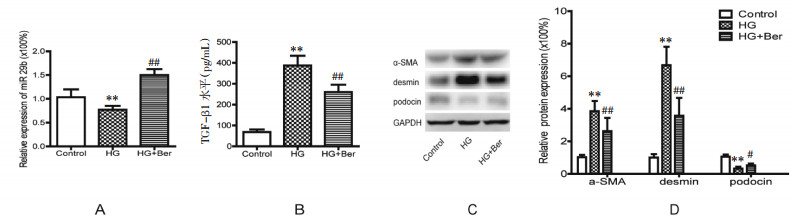
|
| 注:与正常组比较,**P < 0.01;与高糖组比较,#P < 0.05,##P < 0.01。 图 1 黄连素对MPC-5细胞转分化的影响 Fig. 1 Effect of berberine on the transdifferentiation of MPC-5 cells |
与正常组相比,高糖组、高糖+miR-29b mimic NC组培养液上清液中TGF-β1浓度上升,而高糖+miR-29b mimic组的TGF-β1浓度较高糖组、高糖+miR-29b mimic NC组明显下降(P < 0.01)。与正常组相比,高糖组、高糖+miR-29b mimic NC组中α-SMA、desmin表达上升,podocin表达下降(P < 0.01)。与高糖组和高糖+miR-29b mimic NC组相比,高糖+miR-29b mimic组α-SMA、desmin表达下降,podocin表达上升(P < 0.01)。见图 2。
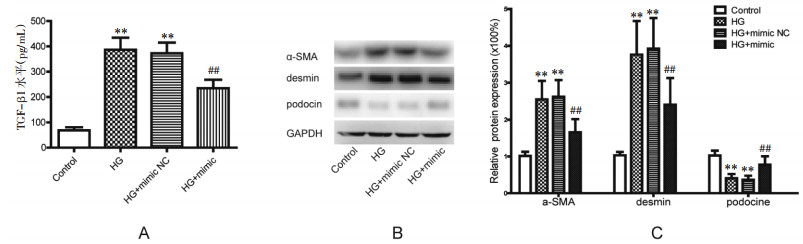
|
| 注:与正常组比较,**P < 0.01;与高糖组比较,##P < 0.01。 图 2 miR-29b过表达对转分化的影响 Fig. 2 Effect of over expression of miR-29b on transdifferentiation |
双荧光素酶报告基因实验结果表明,转染pGL3-TGF-β1野生型质粒时,荧光强度被明显抑制,而转染pGL3-TGF-β1突变质粒时,荧光强度与正常水平接近,提示miR-29b可直接作用于TGF-β1并抑制其表达。
3.4 下调miR-29b表达对黄连素抑制转分化的影响为了探索miR-29b与黄连素在抗EMT作用之间的联系,向MPC-5足细胞内转染miR-29b的inhibitor,并加入黄连素培养。
结果发现,与正常组相比,高糖组培养液上清液中TGF-β1浓度上升;与高糖组相比,高糖+黄连素组培养液上清液中TGF-β1浓度明显下降;与高糖+黄连素组相比,高糖+黄连素+miR-29b inhibitor组培养液上清液中TGF-β1浓度明显上升(P < 0.01)。
进一步分析显示,高糖组EMT相关蛋白α-SMA、desmin表达较正常组上升,podocin表达较正常组下降;而高糖+黄连素组α-SMA、desmin表达较高糖组下降,podocin表达较高糖组上升(P < 0.01)。与高糖+黄连素组相比,高糖+黄连素+miR-29b inhibitor组α-SMA、desmin表达上升,podocin表达下降(P < 0.01)。见图 3。
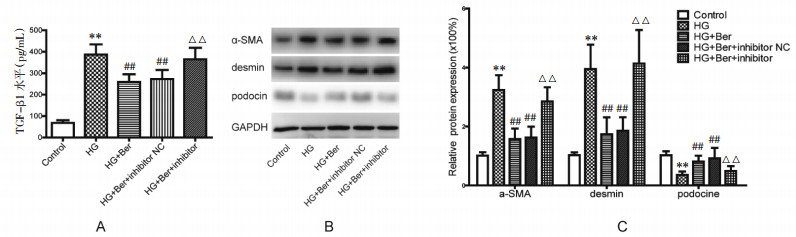
|
| 注:与正常组比较,**P < 0.01;与高糖组比较,##P < 0.01。与高糖+黄连素组比较,△△P<0.01。 图 3 下调miR-29b表达对黄连素抑制转分化的影响 Fig. 3 Effect of down regulation of miR-29b expression on inhibition of transdifferentiation by berberine |
足细胞是构成肾小球滤过屏障的主要细胞之一,其覆盖于肾小球基底膜表面,相邻足细胞的足突相互交联形成网状结构,可阻止大分子蛋白滤过。在糖尿病的病理条件下,足细胞的结构和功能遭到破坏,出现数量减少、足突融合、分泌功能改变等异常,进而导致细胞外基质沉积、肾小球基底膜增厚,最终导致蛋白尿和肾小球硬化[1]。
研究显示,足细胞损伤是肾脏疾病发生、发展至肾功能衰竭的主要原因。甚至在DKD早期,就已经发现足细胞出现损伤。足细胞发生EMT是导致足细胞结构与功能紊乱及肾小球滤过屏障损害的重要原因。podocin是特异表达于足细胞上的一种跨膜蛋白,与其他蛋白组成蛋白复合体固定于细胞骨架上,对维持足细胞结构完整性及肾小球滤过功能具有重要作用,还具有离子通道和信号转导的功能[7]。desmin是细胞骨架中间丝蛋白,正常情况下足细胞仅少量表达desmin;但足细胞损伤时其细胞骨架发生重排,导致大量表达desmin。因此,desmin是足细胞损伤的标志蛋白[8]。α-SMA是间质细胞标志蛋白,正常情况下足细胞不表达α-SMA,但发生EMT时则大量表达α-SMA。α-SMA表达量的高低与肾间质纤维化程度及肾病的进展呈正相关[9]。
miR-29b在肾纤维化的发病机制中可能发挥了重要的调节作用。2型糖尿病患者血浆中miR29b表达减少[10]。miR-29b的水平与IgA肾病的蛋白尿和肾功能相关[11]。高糖处理人上皮细胞系后,miR-29b表达减少,而胶原蛋白Ⅳ表达增加[12]。对盐诱导的高血压大鼠和Dahl盐敏感大鼠的研究表明,miR-29b能调节肾脏细胞外基质形成相关基因(如胶原基因,基质金属蛋白酶2和整合素β1)的表达,增高miR-29b能使肾髓质免于纤维化[13]。链脲佐菌素诱导的糖尿病大鼠肾脏中miR-29b表达显著降低[14]。
TGF-β1是促进肾纤维化发生发展的重要细胞因子[15],既可以促进系膜细胞增殖和细胞外基质沉积,又能通过降低基质金属蛋白酶的活性来抑制细胞外基质降解。研究显示,miR-29b能负调控TGF-β1及其下游信号通路的活性,从而起到抑制细胞外基质形成的作用。高糖条件下,TGF-β1能降低miR-29b在肾小管上皮细胞和足细胞中的表达,并增加胶原蛋白Ⅰ、Ⅲ和Ⅳ的表达[16]。用TGF-β1处理的近端肾小管上皮细胞、系膜细胞和足细胞中,miR-29b水平降低,而细胞外基质蛋白合成增加。用miR-29启动子抑制剂处理的肾细胞系,纤维化标志物表达增加[16]。本研究结果显示,高糖处理使足细胞表达miR-29b减少,同时培养液上清液中TGF-β1浓度上升;转染miR-29b mimic后,培养液上清液中TGF-β1浓度下降。双荧光素酶报告基因实验进一步证实miR-29b可与TGF-β1启动子结合,从而抑制TGF-β1的表达。高糖处理还使足细胞表达EMT相关蛋白α-SMA、desmin表达上升,podocin表达下降;转染miR-29b mimic后,可见α-SMA、desmin表达下降,podocin表达上升。提示过表达miR-29b可以减少TGF-β1水平,并降低足细胞EMT程度。
黄连素是一种生物碱,多种中药如黄连、黄柏中均含有黄连素。以往研究证实,黄连素对糖脂代谢紊乱、胰岛素抵抗、过氧化损伤、炎症等诸多能引起DKD的病理机制,均有调节作用[17-18],因此对DKD有较好疗效。黄连素能降低DKD患者空腹血糖、糖化血红蛋白及尿微量白蛋白排泄率[19]。黄连素能明显降低2型糖尿病大鼠的血糖、血肌酐和24 h尿蛋白量[20]。黄连素能抑制高糖诱导的肾小球系膜细胞增殖与肥大、改善肾小球纤维化,其起效机制与调节细胞周期蛋白表达、阻滞细胞周期进程[21],抑制鞘氨醇激酶-1-磷酸鞘氨醇(SphK/S1P)通路活性[22],抑制激活蛋白1(AP-1)活化[23],抑制核转录因子-κB(NF-κB)及其下游靶基因转录[24]等相关。本研究结果显示,黄连素可减轻高糖处理对足细胞的不良影响,使miR-29b表达升高,TGF-β1水平降低,EMT相关蛋白α-SMA、desmin表达下降,podocin表达上升。转染miR-29b inhibitor后,黄连素抑制足细胞EMT的作用减弱,表现为TGF-β1浓度上升;α-SMA、desmin表达上升,podocin表达下降。提示黄连素抑制足细胞EMT的作用需经miR-29b介导。
综上所述,黄连素可以通过调节miR-29b水平,进而降低高糖诱导的足细胞表达TGF-β1、降低足细胞发生上皮-间质转化的程度,从而在改善DKD症状方面发挥作用。
| [1] |
陈朝红, 刘志红. 足细胞研究进展[J]. 肾脏病与透析肾移植杂志, 2018, 27(4): 348-352. CHEN Z H, LIU Z H. New insights into podocyte biology and injury[J]. Chinese Journal of Nephrology, Dialysis & Transplantation, 2018, 27(4): 348-352. DOI:10.3969/j.issn.1006-298X.2018.04.012 |
| [2] |
LIU Y. New insights into epithelial-mesenchymal transition in kidney fibrosis[J]. Journal of the American Society of Nephrology, 2010, 21(2): 212-222. DOI:10.1681/ASN.2008121226 |
| [3] |
ZHANG Z, SUN L, WANG Y, et al. Renoprotective role of the vitamin D receptor in diabetic nephropathy[J]. Kidney International, 2008, 73(2): 163-171. DOI:10.1038/sj.ki.5002572 |
| [4] |
MENG X M, TANG P M K, LI J, et al. TGF-β/Smad signaling in renal fibrosis[J]. Frontiers in Physiology, 2015(6): 82. |
| [5] |
张青, 李琰, 陈磊. 黄连素对2型糖尿病及其并发症的治疗作用及相关机制研究进展[J]. 中国中药杂志, 2015, 40(9): 1660-1665. ZHANG Q, LI Y, CHEN L. Effect of berberine in treating type 2 diabetes mellitus and complications and its relevant mechanisms[J]. China Journal of Chinese Materia Medica, 2015, 40(9): 1660-1665. |
| [6] |
姚金铭, 宋秀玲, 王焕君, 等. 黄连素(小檗碱)治疗糖尿病肾病疗效和安全性的系统评价[J]. 中华临床医师杂志(电子版), 2015, 9(23): 110-114. YAO J M, SONG X L, WANG H J, et al. Efficacy and safety of berberine in treatment of diabetic nephropathy:a Meta analysis[J]. Chinese Journal of Clinicians (Electronic Edition), 2015, 9(23): 110-114. DOI:10.3877/cma.j.issn.1674-0785.2015.23.028 |
| [7] |
QI X M, WANG J, XU X X, et al. FK506 reduces albuminuria through improving podocyte nephrin and podocin expression in diabetic rats[J]. Inflammation Research, 2016, 65(2): 103-114. DOI:10.1007/s00011-015-0893-y |
| [8] |
GARSEN M, ROPS A L, DIJKMAN H, et al. Cathepsin L is crucial for the development of early experimental diabetic nephropathy[J]. Kidney International, 2016, 90(5): 1012-1022. DOI:10.1016/j.kint.2016.06.035 |
| [9] |
WANG Y, LIN C, REN Q, et al. Astragaloside effect on TGF-β1, SMAD2/3, and α-SMA expression in the kidney tissues of diabetic KKAy mice[J]. International Journal of Clinical and Experimental Pathology, 2015, 8(6): 6828-6834. |
| [10] |
ZAMPETAKI A, KIECHL S, DROZDOV I, et al. Plasma microRNA profiling reveals loss of endothelial miR-126 and other microRNAs in type 2 diabetes[J]. Circulation Research, 2010, 107(6): 810-817. DOI:10.1161/CIRCRESAHA.110.226357 |
| [11] |
GLOWACKI F, SAVARY G, GNEMMI V, et al. Increased circulating miR-21 levels are associated with kidney fibrosis[J]. PloS One, 2013, 8(2): e58014. DOI:10.1371/journal.pone.0058014 |
| [12] |
DU B, MA L M, HUANG M B, et al. High glucose down-regulates miR-29a to increase collagen IV production in HK-2 cells[J]. FEBS Letters, 2010, 584(4): 811-816. DOI:10.1016/j.febslet.2009.12.053 |
| [13] |
LIU Y, TAYLOR N E, LU L, et al. Renal medullary microRNAs in Dahl salt-sensitive rats:miR-29b regulates several collagens and related genes[J]. Hypertension, 2010, 55(4): 974-982. DOI:10.1161/HYPERTENSIONAHA.109.144428 |
| [14] |
SILVA V A O, POLESSKAYA A, SOUSA T A, et al. Expression and cellular localization of microRNA-29b and RAX, an activator of the RNA-dependent protein kinase (PKR), in the retina of streptozotocin-induced diabetic rats[J]. Molecular Vision, 2011, 17: 2228-2240. |
| [15] |
孟晓明, 蓝辉耀. 转化生长因子-β与肾脏纤维化的研究进展[J]. 生理学报, 2018, 70(6): 612-622. MENG X M, LAN H Y. Transforming growth factor-β and renal fibrosis[J]. Acta Physiologica Sinica, 2018, 70(6): 612-622. |
| [16] |
WANG B, KOMERS R, CAREW R, et al. Suppression of microRNA-29 expression by TGF-β1 promotes collagen expression and renal fibrosis[J]. Journal of the American Society of Nephrology, 2012, 23(2): 252-265. DOI:10.1681/ASN.2011010055 |
| [17] |
茹爱忠, 范强, 杨丽霞. 基于中国知网数据库分析黄连素治疗糖尿病的研究现状[J]. 卫生职业教育, 2017, 35(9): 133-135. RU A Z, FAN Q, YANG L X. Analysis of current research situation of berberine in the treatment of diabetes based on CNKI database[J]. Health Vocational Education, 2017, 35(9): 133-135. |
| [18] |
陈小青, 王丽萍. 黄连素在代谢综合征及相关疾病中的研究进展[J]. 中国中西医结合肾病杂志, 2015, 16(1): 88-91. CHEN X Q, WANG L P. Research progress of berberine in metabolic syndrome and related diseases[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2015, 16(1): 88-91. |
| [19] |
王媛. 黄连素治疗早期糖尿病肾病的疗效观察[J]. 中国现代药物应用, 2016, 10(21): 86-87. WANG Y. Observation on the efficacy of berberine in the treatment of early diabetic nephropathy[J]. Chinese Journal of Modern Drug Application, 2016, 10(21): 86-87. |
| [20] |
吴伟, 朱章志, 江丹, 等. 小檗碱保护糖尿病大鼠肾脏的系统评价[J]. 中华中医药杂志, 2013, 28(5): 1622-1626. WU W, ZHU Z Z, JIANG D, et al. Systematic evaluation of berberine in protecting kidney of diabetic rats[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2013, 28(5): 1622-1626. |
| [21] |
LAN T, WU T, CHEN C, et al. Berberine attenuates high glucose-induced proliferation and extracellular matrix accumulation in mesangial cells:involvement of suppression of cell cycle progression and NF-κB/AP-1 pathways[J]. Molecular and Cellular Endocrinology, 2014, 384(1-2): 109-116. |
| [22] |
HUANG K, LIU W, LAN T, et al. Berberine reduces fibronectin expression by suppressing the S1P-S1P2 receptor pathway in experimental diabetic nephropathy models[J]. PLoS One, 2012, 7(8): e43874. |
| [23] |
LAN T, LIU W, XIE X, et al. Berberine suppresses high glucose-induced TGF-β1 and fibronectin synthesis in mesangial cells through inhibition of sphingosine kinase 1/AP-1 pathway[J]. European Journal of Pharmacology, 2012, 697(1-3): 165-172. |
| [24] |
LIU W, ZHANG X, LIU P, et al. Effects of berberine on matrix accumulation and NF-kappa B signal pathway in alloxan-induced diabetic mice with renal injury[J]. European Journal of Pharmacology, 2010, 638(1-3): 150-155. |
 2021, Vol. 38
2021, Vol. 38


