文章信息
- 赵明智, 李雪
- ZHAO Mingzhi, LI Xue
- 大蒜素逆转人乳腺癌MCF-7细胞顺铂耐药性的研究
- Study of Allicin reverses Cisplatin resistance in human breast cancer MCF-7 cells
- 天津中医药, 2021, 38(1): 119-123
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(1): 119-123
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.01.26
-
文章历史
- 收稿日期: 2020-08-19
乳腺癌发病率居女性恶性肿瘤之首,全球每年新诊断患者约150万例、年死亡病例超过50万,并且以约年度2%的速度增长[1],严重威胁着女性的生命健康。手术切除是临床治疗乳腺癌的首选方案,而手术前后给予化疗、内分泌治疗可明显延缓疾病进展、延长患者生存期[2]。顺铂是乳腺癌化疗一线用药,但肿瘤细胞获得性耐药的产生所致药物敏感性降低是导致治疗失败甚至死亡的重要原因[3]。因此,研发高效、低毒的化疗耐药逆转剂对乳腺癌治疗具有重要意义。
大蒜素(Allicin)是由葱科葱属植物大蒜的鳞茎中提取的一种有机硫化合物,化学名为二烯丙基三硫化物,具有广泛的抗肿瘤活性,对胃癌[4]、小细胞肺癌[5]、舌鳞状细胞癌[6]等均具有一定的抑制作用,并且大蒜素能够逆转人子宫内膜癌Ishikawa细胞[7]、人舌鳞状细胞癌Tca8113细胞[8]顺铂耐药性。本实验将以人乳腺癌耐顺铂MCF-7/DDP细胞为受试细胞,研究大蒜素对人乳腺癌MCF-7细胞顺铂耐药性的影响并探索其调控机制。
1 材料与方法 1.1 细胞人乳腺癌耐顺铂细胞系MCF-7/DDP购自中国科学院上海细胞库。
1.2 药物与试剂大蒜素注射液购自上海禾风制药有限公司(规格:5 mL:60 mg,批号:4E38006);顺铂注射液购自江苏豪森药业集团有限公司(规格:6 mL:30 mg,批号:20190125);DMEM培养基(高糖)、胎牛血清购自杭州四季青生物工程材料有限公司(批号:190509、190611);胰蛋白酶购自美国Sigma公司(批号:190106);噻唑蓝(MTT)购自美国AMRESCO公司(批号:1324B37);Annexin V-FITC试剂盒购自江苏凯基生物技术股份有限公司(批号:20190417);碘化丙啶(PI)购自Sigma-Aldrich公司(批号:P4170);兔抗人B细胞淋巴瘤/白血病-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、细胞周期素D1(Cyclin D1)、周期蛋白依赖激酶2、4、6(CDK2、CDK4、CDK6)抗体购自上海碧云天生物技术有限公司(批号:201905014、201903008、201904025、201904001、201903012、201904011);ECL超敏化学发光液购自美国Thermo Fisher Scientific公司(批号:34580)。
1.3 主要仪器DL-CJ-1N型超净工作台(北京东联哈尔仪器制造有限公司);BD FACSCalibur型流式细胞仪(美国BD公司);TC20型细胞计数器、GelDoc EZ型凝胶成像系统(美国BIO-RAD公司);Spectramax M2型酶标仪(美国Medtronic公司);BB5060U型CO2细胞培养箱(德国Hereaus公司);TD5.5型离心机(上海卢湘仪离心机仪器有限公司);Tetra Systerm型垂直电泳槽、Power Pac Basic转膜槽(美国Bio-Bad公司);WD-9413B型凝胶成像系统(北京六一公司);CKX41型倒置光学显微镜(日本Olympus公司)。
1.4 细胞培养人乳腺癌耐顺铂MCF-7/DDP细胞用DMEM高糖培养基(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)进行培养,细胞培养箱设置条件:5%二氧化碳、恒温37 ℃、饱和湿度,每2天换液1次,观察并记录细胞生长状态。
1.5 MTT法测定细胞增殖抑制率取对数生长期MCF-7/DDP细胞经0.25%胰酶消化后计数、制备浓度1×105个/mL单细胞悬液,每孔50 μL接种于96孔板,设空白对照组(DMSO)、大蒜素组(20 μg/mL)[9]、顺铂组(6 μg/mL)[10]、联合组(大蒜素20 μg/mL+顺铂6 μg/mL),每组10个复孔。给药干预并继续培养48 h后,每孔加入10 μL浓度为5 μg/mL MTT溶液,继续培养4 h后弃培养液、每孔加入150 μL二甲基亚砜(DMSO)终止反应,通过酶标仪测定490 nm处吸光度值(OD490nm),细胞增殖抑制率(%)=(空白对照组OD490nm值-实验组OD490nm值)/空白对照组OD490 nm值×100%
1.6 Annexin V-FITC染色流式细胞术检测细胞凋亡取“1.5”制备的MCF-7/DDP细胞悬液,每孔1 mL接种于6孔板,设空白对照组(DMSO)、大蒜素组(20 μg/mL)、顺铂组(6 μg/mL)、联合组(大蒜素20 μg/mL+顺铂6 μg/mL),每组10个复孔。给药干预并继续培养48 h后,经0.25%胰酶消化后计数、取1×106个细胞并加入500 μL浓度为1%的FITC染液混匀后制备单细胞悬液,恒定4℃继续避光孵育10 min后通过流式细胞仪检测细胞凋亡并计算凋亡率,每组均重复3次取平均值。
1.7 PI染色流式细胞术分析细胞周期分布取“1.5”制备的MCF-7/DDP细胞悬液,每孔1 mL接种于6孔板,设空白对照组(DMSO)、大蒜素组(20 μg/mL)、顺铂组(6 μg/mL)、联合组(大蒜素20 μg/mL+顺铂6 μg/mL),每组10个复孔。给药干预并继续培养48 h后,经0.25%胰酶消化后离心(1 500 r/min,离心半径10 cm,5 min)取沉淀细胞,磷酸盐缓冲溶液(PBS)洗涤后加入5 mL浓度75%的乙醇,-20 ℃固定1 h,离心取细胞、PBS洗涤后加入5 μL水解酶Rnase,37 ℃放置1 h,加入PI染液行避光孵育0.5 h,然后采用流式细胞术检测分析细胞周期分布。
1.8 Western blot法检测Bax、Bcl-2、Cyclin D1、CDK2、CDK4、CDK6蛋白表达取对数生长期MCF-7/DDP细胞经0.25%胰酶消化,离心(1 500 r/min,离心半径10 cm,5 min)弃上清取沉淀细胞,低温4 ℃超声破碎处理后离心(12 000 r/min,离心半径8 cm,10 min)取上清液,BCA法定量蛋白浓度、沸水浴变性后取30 μg总蛋白,依次行SDS-PAGE凝胶电泳、转PVDF膜、5%脱脂牛奶封闭1 h,滴加一抗4 ℃孵育12 h,滴加二抗37 ℃孵育1 h,用PBS溶液充分洗涤后滴加ECL显色,运用凝胶成像系统获得条带;以β-actin为内参,以条带灰度值半定量Bax、Bcl-2、Cyclin D1、CDK2、CDK4、CDK6蛋白表达。
1.9 统计学方法采用SPSS 24.0软件进行统计分析,计量结果以均数±标准差(x±s)方式表示,多组间比较采用单因素方差分析、两两比较采用LSD-t检验,率的比较采用卡方检验,取检测限α=0.05,P < 0.05为差异有统计学意义。
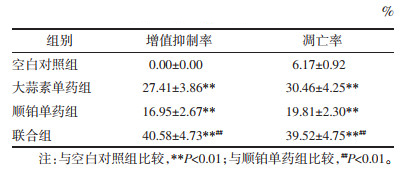
2 结果 2.1 各组人乳腺癌耐顺铂MCF-7/DDP细胞增殖抑制率与空白对照组比较,大蒜素单药组、顺铂单药组、联合组MCF-7/DDP细胞增殖抑制率均显著升高(P < 0.01);与顺铂单药组比较,联合组MCF-7/DDP细胞增殖抑制率显著升高(P < 0.01)。见表 1。
|
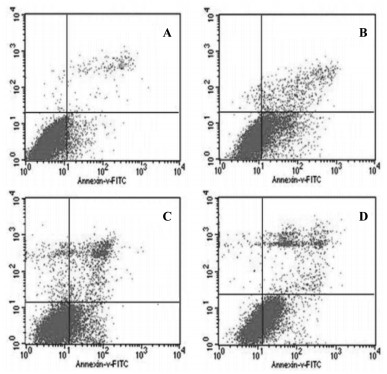
如图 1所示,空白对照组MCF-7/DDP细胞仅可见少量凋亡细胞,大蒜素单药组、顺铂单药组、联合组MCF-7/DDP细胞凋亡数量明显增多,联合组凋亡细胞数量明显多于顺铂组。与空白对照组比较,大蒜素单药组、顺铂单药组、联合组MCF-7/DDP细胞凋亡率显著升高(P < 0.01);与顺铂单药组比较,联合组MCF-7/DDP细胞凋亡率显著升高(P < 0.01)。见表 1。
|
| 注:A.空白对照组;B.大蒜素单药组;C.顺铂单药组;D.联合组。 图 1 各组人乳腺癌耐顺铂MCF-7/DDP细胞凋亡状况 Fig. 1 Apoptosis of human breast cancer cisplatin-resistant MCF-7/DDP cells in each group |
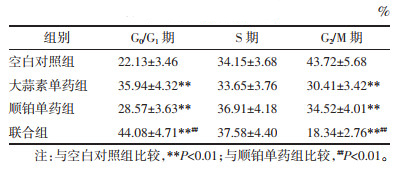
与空白对照组比较,大蒜素单药组、顺铂单药组、联合组MCF-7/DDP细胞处于G0/G1期比例显著升高而G2/M期比例显著降低(P < 0.01);与顺铂单药组比较,联合组MCF-7/DDP细胞处于G0/G1期比例显著升高而G2/M期比例显著降低(P < 0.01)。见表 2。
|
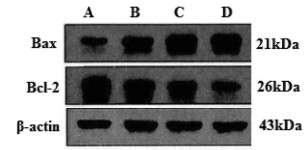
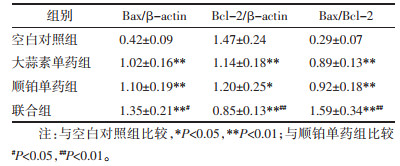
与空白对照组比较,大蒜素单药组、顺铂单药组、联合组MCF-7/DDP细胞Bax蛋白表达量显著升高而Bcl-2表达量显著降低、Bax/Bcl-2比值显著升高(P < 0.05或P < 0.01);较顺铂单药组,联合组MCF-7/DDP细胞Bax表达量显著升高而Bcl-2表达量显著降低、Bax/Bcl-2比值显著升高(P < 0.05或P < 0.01)。见图 2和表 3。
|
| 注:A.空白对照组;B.大蒜素单药组;C.顺铂单药组;D.联合组。 图 2 各组人乳腺癌耐顺铂MCF-7/DDP细胞Bax、Bcl-2蛋白表达 Fig. 2 Expression of Bax, Bcl-2 proteins of human breast cancer cisplatin-resistant MCF-7/DDP cells in each group |
|
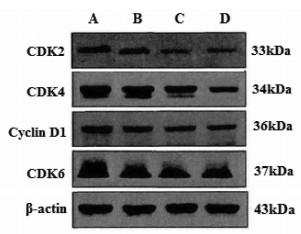
较空白对照组,大蒜素单药组、顺铂单药组、联合组MCF-7/DDP细胞Cyclin D1、CDK2、CDK4、CDK6蛋白表达量显著降低(P < 0.05或P < 0.01);较顺铂单药组,联合组MCF-7/DDP细胞Cyclin D1、CDK2、CDK4、CDK6蛋白表达量显著降低(P < 0.05或P < 0.01)。见图 3和表 4。
|
| 注:A.空白对照组;B.大蒜素单药组;C.顺铂单药组;D.联合组。 图 3 各组人乳腺癌耐顺铂MCF-7/DDP细胞Cyclin D1、CDK2、CDK4、CDK6蛋白表达 Fig. 3 Expression of Cyclin D1, CDK2, CDK4, CDK6 proteins of human breast cancer cisplatin-resistant MCF-7/ DDP cells in each group |

|
大蒜素是一种天然存在的二烯丙基三硫化物,既往研究发现大蒜素能够通过促进细胞凋亡而逆转人子宫内膜癌Ishikawa细胞顺铂耐药性[7]、能够通过阻滞细胞周期进程而逆转人舌鳞状细胞癌Tca8113细胞顺铂耐药性[8]。本研究也发现大蒜素具有逆转人乳腺癌MCF-7细胞顺铂耐药性的作用。
顺铂抗肿瘤主要是通过抑制细胞增殖和诱导细胞凋亡两种途径[11]。Shapiro[12]研究发现Cyclin D1-CDK4/CDK6复合体过表达将诱导细胞异常增殖而病变形成肿瘤,多个瘤种中均可见该复合物活性异常。本研究发现,与顺铂单药组比较,大蒜素+顺铂联合治疗能够显著降低人乳腺癌耐顺铂MCF-7/DDP细胞Cyclin D1、CDK2、CDK4、CDK6蛋白表达量;与空白对照组比较,大蒜素单药组MCF-7/DDP细胞Cyclin D1、CDK2、CDK4、CDK6蛋白表达量显著降低,这可能是大蒜素抑制MCF-7/DDP细胞增殖及逆转MCF-7细胞顺铂耐药的重要分子机制。
Zhang等[13]研究发现细胞凋亡对肿瘤细胞化疗敏感性非常重要,Bax、Bcl-2在线粒体凋亡通路调控过程中起着关键作用,Bax能够激活促凋亡Caspase-3蛋白、促进线粒体释放细胞色素C(Cyt-C)等而导致细胞凋亡,Bcl-2则能够抑制Caspase-3活化、保护线粒体膜而抑制Cyt-C释放等而抑制细胞凋亡[14]。此外,体内Bax以同源二聚体Bax-Bax形式或异源二聚体Bax-Bcl-2形式存在,Bax-Bax表现为促凋亡作用,但Bax-Bax的稳定性低于Bax-Bcl-2,所以Bax/Bcl-2表达比值反映两者对细胞凋亡的调控作用更加准确[15]。本研究发现,与顺铂单药组比较,大蒜素+顺铂联合治疗能够显著提高人乳腺癌耐顺铂MCF-7/DDP细胞Bax表达量并降低Bcl-2表达量,提高Bax/Bcl-2值;与空白对照组比较,大蒜素单药干预能够显著提高Bax表达量并降低Bcl-2表达量,提高Bax/Bcl-2值,这可能是大蒜素促进MCF-7/DDP细胞凋亡及逆转MCF-7细胞顺铂耐药的重要分子机制。
综上所述,大蒜素具有逆转人乳腺癌MCF-7细胞顺铂耐药性的药理学作用,可能与调节细胞凋亡、周期相关蛋白表达进而促进MCF-7/DDP细胞凋亡、阻滞其细胞周期进程有关。
| [1] |
SRREB J, GLANOWSKA I, STREB A, et al. The relationship between breast cancer treatment, tumor type and vitaminDlevel in pre- and postmenopausal women[J]. Neuroendocrinology Letters, 2017, 38(6): 437-440. |
| [2] |
SATO F, TOI M. Molecular targeted therapy and genomic evolution of breast cancer[J]. Nihon Rinsho, 2015, 73(8): 1364-1372. |
| [3] |
谢贤鑫, 王聪, 李伟杰, 等. 齐墩果酸衍生物SZCO14同时诱导乳腺癌细胞的凋亡和自噬[J]. 中医药学报, 2019, 47(4): 17-23. XIE X X, WANG C, LI W J, et al. Dual induction ofapoptosis and autophagy in breast cancer cells by SZC014 of Oleanolic Acid Derivative[J]. Acta Chinese Medicine and Pharmacology, 2019, 47(4): 17-23. |
| [4] |
孙丽, 孙三元, 卓士超, 等. 大蒜素对裸鼠胃癌移植瘤生长和端粒酶活性抑制作用的研究[J]. 中华临床医师杂志(电子版), 2011, 5(12): 3445-3448. SUN L, SUN S Y, ZHUO S C, et al. Research on the inhibitory influence of allicin on tumor growth and telomerase activity of the transplanted gastric carcinoma in nude mouse[J]. Chinese Journal of Clinicians(Electronic Edition), 2011, 5(12): 3445-3448. DOI:10.3877/cma.j.issn.1674-0785.2011.12.012 |
| [5] |
于亦鸣, 钟斌诚, 何茜, 等. 大蒜素对小细胞肺癌A549细胞增殖、迁移能力及凋亡的影响[J]. 临床和实验医学杂志, 2017, 16(18): 1776-1779. YU Y M, ZHONG B C, HE Q, et al. Effects of allicin on proliferation, migration and apoptosis of lung cancer A549 cells[J]. Journal of Clinical and Experimental Medicine, 2017, 16(18): 1776-1779. DOI:10.3969/j.issn.1671-4695.2017.18.003 |
| [6] |
郭燕军. 大蒜素对人舌鳞状细胞癌Tca8113细胞生长的影响[J]. 西部中医药, 2019, 32(2): 25-28. GUO Y J. Influence of Allimin on Tca8113 cellular growth of human tongue squamous cell carcinoma[J]. Western Journal of Traditional Chinese Medicine, 2019, 32(2): 25-28. |
| [7] |
贾丽. 大蒜素对子宫内膜癌细胞顺铂增敏作用及机制的实验研究[J]. 世界中西医结合杂志, 2018, 13(7): 934-937. JIA L. Experimental research of the sensibilization effect and mechanism of allitridi on Ishikawa cells in endometrial cancer cells treated with cisplatin[J]. World Journal of Integrated Traditional and Western Medicine, 2018, 13(7): 934-937. |
| [8] |
郭燕军. 大蒜素对人舌鳞状细胞癌Tca8113细胞顺铂化疗增敏作用及机制研究[J]. 现代中西医结合杂志, 2018, 27(33): 3663-3666. GUO Y J. Effect of Allitridi on Cisplatin chemotherapy sensitizes of human tongue squamous cell carcinoma Tca8113 cells[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2018, 27(33): 3663-3666. |
| [9] |
余乐涵, 万慧芳, 涂硕, 等. 大蒜素联合紫杉醇对人乳腺癌细胞增殖的影响及其机制[J]. 南昌大学学报(医学版), 2015, 55(5): 26-31. YU L H, WAN H F, TU S, et al. Effects of Diallyl trisulfide combined with paclitaxel on proliferation of human breast cancer cells and their mechanisms of action[J]. Journal of Nanchang University(Medical Sciences), 2015, 55(5): 26-31. |
| [10] |
肖聪, 张懿敏, 孙圣荣, 等. 华蟾素联用顺铂对乳腺癌MDA-MB-231细胞活力、凋亡及周期分布的影响[J]. 中国医药导报, 2019, 16(21): 12-16. XIAO C, ZHANG Y M, SUN S R, et al. Effects of cinabufacini combined with Cisplatin on cell viability, apoptosis and cell cycle distribution of MDA-MB-231 cells[J]. China Medical Herald, 2019, 16(21): 12-16. |
| [11] |
蒋国君, 刘亚明, 王道鑫, 等. 黄芩素联合顺铂对乳腺癌细胞MCF-7增殖和凋亡的影响[J]. 山西医科大学学报, 2018, 49(8): 927-931. JIANG G J, LIU Y M, WANG D X, et al. Baicalein enhances the effect of cisplatin on proliferation and apoptosis of breast cancer cells MCF-7[J]. Journal of Shanxi Medical University, 2018, 49(8): 927-931. |
| [12] |
SHAPIRO G I. Cyclin-dependent kinase pathways as targets for cancer treatment[J]. Journal of Clinical Oncology, 2006, 24(11): 1770-1783. DOI:10.1200/JCO.2005.03.7689 |
| [13] |
ZHANG X, ZHANG Y, LIU X, et al. MicroRNA-203 is a prognostic indicator in bladder cancer and enhances chemosensitivity to cisplatin via apoptosis by targeting Bcl-w and Survivin[J]. PLoS One, 2015, 10(11): e0143441. |
| [14] |
于杰滨, 邵明举. 6-姜辣素对人乳腺癌细胞增殖、凋亡的影响及机制[J]. 中国老年学杂志, 2019, 39(16): 4072-4075. YU J B, SHAO M J. Effect and mechanism of 6-gingerol on human breast cancer cell proliferation and apoptosis[J]. Chinese Journal of Gerontology, 2019, 39(16): 4072-4075. DOI:10.3969/j.issn.1005-9202.2019.16.064 |
| [15] |
SAEEDI B M J, HAMI J, HAGHIR H, et al. Evaluation of Bax and Bcl-2 proteins expression in the rat hippocampus due to childhood febrile seizure[J]. Iranian Journal of Child Neurology, 2016, 10(1): 53-60. |
 2021, Vol. 38
2021, Vol. 38


