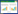文章信息
- 陈雨微, 席雨蒙, 李盼, 罗先钦, 李巍, 王建伟
- CHEN Yuwei, XI Yumeng, LI Pan, LUO Xianqin, LI Wei, WANG Jianwei
- 柴胡配方颗粒对高三酰甘油血症模型大鼠的降脂作用及机制研究
- Effect and mechanism of formulae Bupleuri Radix Granule on hypertriglyceridemia in fructose-fed rats
- 天津中医药, 2021, 38(10): 1330-1337
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(10): 1330-1337
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.10.22
-
文章历史
- 收稿日期: 2021-06-10
2. 重庆医科大学中医药防治代谢性疾病重庆市重点试验室, 重庆 400016
高脂血症是由于体内脂肪代谢或运转异常,进而引起的血脂增高的一种代谢性相关疾病,其包括高胆固醇血症、高三酰甘油血症、低高密度脂蛋白血症和混合型高脂血症等4种类型[1]。其中,高三酰甘油血症是导致动脉粥样硬化的主要危险因素之一,与冠状动脉粥样硬化、心脑血管病等多种疾病的发生和发展密切相关,严重威胁和危害人类的生命健康[2-3]。目前,临床上治疗以使用西药他汀类药物为主,但有临床研究表明,中国患者对大剂量、高强度的他汀类药物治疗耐受性和安全性较差,有肝、肌肉毒性的风险,这也一定程度上限制了中国高血脂患者的临床用药[4]。中医药作为治疗复杂代谢性疾病的优势疗法,目前在诸多代谢性疾病的治疗中取得了良好治疗效果,其中在降血脂方面,中药以其特有的多靶点、多途径调控模式,在诸多临床试验中表现出了良好的疗效[5-7],也表明了从中药中研究降脂类药物具有巨大的潜在开发价值。
柴胡为伞形科植物柴胡Bupleurum chinese DC.或狭叶柴胡Bupleurum scorzonerifolium Willd.的干燥根。柴胡作为常用解表药,已有两千多年的应用历史,始载于《神农本草经》,具有疏散退热,疏肝解郁,升举阳气的传统功效。现代药理学研究发现,柴胡具有抗炎、抗肿瘤、保肝、免疫调节等多种药理作用[8-9]。此外,有研究表明柴胡具有潜在的降血脂作用[10-11],但柴胡对高果糖饮食诱导的高三酰甘油血症模型大鼠的药效作用及相关的机制目前尚不清楚。鉴于此,本研究拟利用10%果糖水诱导并构建高三酰甘油血症模型大鼠,观察柴胡配方颗粒对高三酰甘油血症模型的改善作用。在此基础上,通过实时定量聚合酶链反应(qRT-PCR)及蛋白免疫印迹(Western-blot)分析等分子生物学技术,考察柴胡配方颗粒对高三酰甘油模型大鼠肝脏及脂肪等脂质代谢重要组织相关基因和蛋白表达情况的影响,进一步探究其可能的作用机制,为柴胡及其相关制剂的新适应症的开发研究奠定实验基础,提供科学依据。
1 实验动物与材料 1.1 实验动物SPF级雄性Sprague Dawley(SD)大鼠40只,6~7周龄,体质量(220±20)g,购自重庆医科大学动物实验中心,动物生产许可证号:SCXK(渝)2018-0003,动物使用许可证:SYXK(渝)2018-0003。动物饲养于重庆医科大学动物实验中心SPF等级环境,温度(22±2)℃,湿度(55±5)%,12 h明暗交替。所有动物实验操作符合试验动物伦理委员会要求。
1.2 药物与试剂柴胡配方颗粒剂(批号:9049141),购自重庆医科大学附属第一医院,广东一方制药有限公司;异氟烷(批号:217180801),购自深圳市瑞沃德生命科技有限公司;BCA蛋白浓度测定试剂盒(批号:P0010),购自上海碧云天生物技术有限公司;葡萄糖氧化酶法试剂盒,购自北京普利来基因技术有限公司;三酰甘油含量检测试剂盒,购自南京建成生物工程研究所有限公司;RNA抽提试剂盒、逆转录试剂、PCR试剂盒,均购自大连宝生物工程有限公司;兔抗FGF21(ab171941)、PGC1α(ab54481),鼠抗SIRT1(ab110304)、CPT1α(ab128568),均购自美国Abcam公司;兔抗AMPK(2532S)、p-AMPK(2535S)、β-actin(4970S),均购自美国CST公司;羊抗兔IgG二抗(BA1054)、羊抗鼠IgG二抗(BA1050),均购自武汉博士德生物工程有限公司;化学发光液(批号:1730501),购自美国Millipore公司。
1.3 实验仪器Mini-PROTEAN Tetra System湿转印仪、垂直电泳装置、荧光定量PCR仪,美国Bio-Rad公司;TissueLyserⅡ组织研磨仪,德国Qiagen公司;Synergy HTX全自动酶标仪,美国BioTek公司;NANODEOP 2000微量核酸蛋白测定仪,赛默飞世尔科技(中国)有限公司;金属浴(MK-20)中国杭州奥盛科技有限公司;石蜡切片机(RM2235)德国Leica公司;icEN-24R高速冷冻离心机,杭州奥盛仪器有限公司;Odyssey Fc双色红外荧光成像系统,美国LI-COR公司。
2 实验方法 2.1 实验分组与给药40只雄性大鼠适应性饲养1周后,随机分为正常对照组、果糖诱导组(模型组)及柴胡配方颗粒低、中、高剂量给药组(由临床剂量换算而来,剂量分别为0.675、1.35及2.70 g/kg),每组8只,所有组大鼠均给予基础饲料(饲料由重庆医科大学动物实验中心提供)。实验开始后,正常对照组给予正常饮水,模型组与柴胡配方颗粒低、中、高剂量组给予10%的果糖水溶液,并于每天上午10~11时对大鼠进行灌胃,对照组与模型组灌胃给予等体积的蒸馏水,柴胡配方颗粒用蒸馏水溶解,分为低、中、高剂量组,实验持续5周。每周记录体质量,模型组与给药组根据总计摄入热量调整摄食量和摄入果糖水的含量,保证模型组与给药组实验期间总热量摄入一致。实验4周后,于眼内眦取血,保存于-80 ℃。实验第5周末处死大鼠,取肝和附睾周围脂肪称质量,部分保存于4%多聚甲醛;剩余部分置于液氮后转移至-80 ℃保存,以备后期检测。
2.2 口服葡萄糖耐量实验实验第4周末,所有组别大鼠禁食过夜(12 h,果糖水换为常规饮用自来水),灌胃给予5 g/kg的葡萄糖,分别于灌胃开始0、30、60、120 min后于眼内眦取血,4 000 r/min离心10 min(离心半径=85 mm,下同)分离血浆用于检测葡萄糖含量。
2.3 三酰甘油、葡萄糖含量的检测严格按照葡萄糖氧化酶法试剂盒与三酰甘油含量检测试剂盒说明书操作要求,分别检测各组大鼠血浆葡萄糖含量及血浆/肝脏组织匀浆三酰甘油含量。
2.4 qRT-PCR基因分析严格按照RNA提取试剂盒说明书提取肝、脂肪组织RNA,并根据逆转录试剂盒说明书操作方法,逆转录mRNA。反应条件为:逆转录反应(15 min,37 ℃),逆转录酶失活(5 s,85 ℃),逆转录后的mRNA稀释并用于PCR检测。随后严格按照PCR试剂盒说明书操作方法,在Real-Time PCR仪上进行基因扩增。反应条件为:预变性(30 s,95 ℃),变性(5 s,95 ℃),退火延伸(30 s,60 ℃),40循环次数。以β-Actin为内参基因,根据2-ΔΔCq计算各组目的基因相对表达量。相关基因的引物(上海生工生物工程股份有限公司)序列见表 1。
称取50 mg脂肪组织,加入800 μL RIPA裂解液(使用前加入终浓度为1 mmol/L的PMSF和磷酸酶抑制剂),充分匀浆。并于冰上静置1 h,然后于4 ℃下12 000 r/min离心20 min。取上清液,测定其蛋白浓度。然后,按试剂使用说明书加入5×蛋白上样缓冲液于95 ℃变性5 min,进行SDS-PAGE(8%分离胶,4%浓缩胶)电泳分离,250 mA恒流电转,用5%脱脂牛奶封闭2 h,并分别用以下抗体进行孵育:β-Actin兔抗(稀释:1∶3 000);AMPK兔抗(稀释:1∶2 000,美国CST公司);p-AMPKThr172兔抗(稀释:1∶800);PGC-1α兔抗(稀释:1∶1 000);SIRT1鼠抗(稀释:1∶1 000)。上述一抗4 ℃孵育16 h,TBST洗涤5次,每次5 min,洗膜后加二抗(室温孵育1 h),再以TBST洗涤3次,每次5 min,化学发光液显影。用Odyssey Fc双色红外荧光成像系统扫描条带,Image J软件分析测定各条带的灰度值,将所得目的条带的吸光度值与相应的内参β-Actin蛋白条带的灰度值相比为相应蛋白的相对表达量。
3 统计学分析所有数据运用SPSS 22.0软件进行统计学分析,计量资料以均数±标准差(x±s)表示,多组计量资料的比较用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
4 结果 4.1 柴胡配方颗粒对高三酰甘油血脂大鼠体质量、血浆三酰甘油、葡萄糖及OGTT的影响实验周期末,模型组大鼠体质量明显高于正常对照组(P<0.05);与模型组相比,柴胡配方颗粒(低、中、高)剂量组大鼠体质量具有降低的趋势(P<0.05),见图 1A。模型组血浆三酰甘油、葡萄糖含量明显高于正常对照组(P<0.01或P<0.05),表明果糖能明显诱导SD大鼠三酰甘油及葡萄糖代谢障碍,即造模成功。而柴胡配方颗粒中剂量组(1.35 g/kg)、高剂量组(2.70 g/kg)与模型组相比能显著降低血浆三酰甘油含量(P<0.01),但对大鼠血浆葡萄糖含量无明显影响,见图 1B、1C。OGTT检测结果发现,模型组糖耐量较对照组明显受损,表现在灌胃葡萄糖2 h后血浆葡萄糖含量及其曲线分布下面积(AUC)明显高于正常对照组(P<0.05);而柴胡配方颗粒高剂量组具有一定改善果糖导致的大鼠糖耐量受损的作用,表现在明显降低灌胃葡萄糖2 h后大鼠血浆葡萄糖含量和AUC(P<0.05),见图 1D、1E。
|
| 注:A.大鼠体质量;B.血浆三酰甘油含量;C.血浆葡萄糖含量;D.OGTT血浆葡萄糖随时变化曲线(0~120 min);E.AUC。Control.正常对照组;Model.模型组;CH-L.柴胡配方颗粒低剂量组;CH-M.柴胡配方颗粒中剂量组;CH-H.柴胡配方颗粒高剂量组。n=8。与模型组相比,*P<0.05;与正常对照组相比,#P<0.05,##P<0.01。 图 1 柴胡配方颗粒对高三酰甘油血症大鼠体质量、血浆三酰甘油、葡萄糖及OGTT的影响 Fig. 1 Effects of formulae Bupleuri Radix granules on body weight, plasma triacylglycerol, glucose and OGTT of hypertriglyceridemia rats |
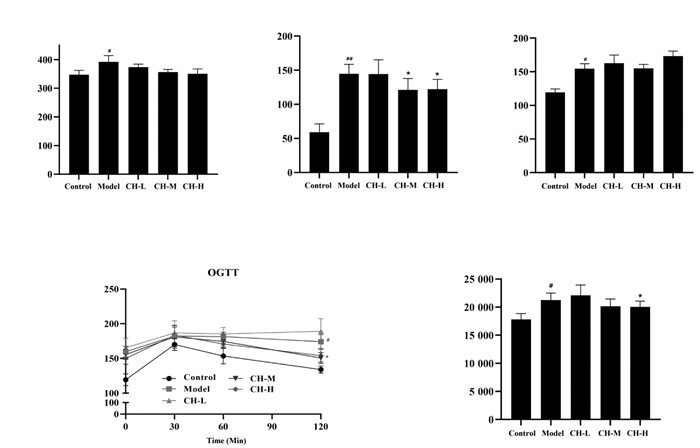
与正常对照组相比,果糖诱导模型组肝体质量比明显增高(P<0.05),提示高果糖诱导可能对SD大鼠肝脏具有一定的损伤作用;而与模型组相比,柴胡配方颗粒组具有降低果糖诱导的SD大鼠肝体质量比的趋势(P>0.05)。此外,肾脏、腹膜后脂肪及附睾白色脂肪组织(eWAT)的体质量比在各组之间均无统计学差异(P>0.05),见图 2。
|
| 注:Control.正常对照组;Model.模型组;CH-L.柴胡配方颗粒低剂量组;CH-M.柴胡配方颗粒中剂量组;CH-H.柴胡配方颗粒高剂量组。n=8。与正常对照组相比,*P<0.05。 图 2 柴胡配方颗粒对高三酰甘油血症大鼠肝、肾、eWAT及腹膜后脂肪等组织的体质系数的影响 Fig. 2 Effect of formulae Bupleuri Radix granules on the constitution coefficients of liver, kidney, eWAT and retroperitoneal fat in rats with hypertriglyceridemia |
鉴于肝脏与高血脂症的密切联系,考察了柴胡配方颗粒对高三酰甘油血症模型大鼠肝脏组织匀浆三酰甘油含量及肝脏脂质代谢相关基因的表达。高果糖摄入对大鼠肝脏组织匀浆三酰甘油含量具有增加的趋势(P>0.05),同时柴胡配方颗粒高、中、低剂量组对果糖诱导大鼠肝脏组织三酰甘油含量具有降低的趋势,但差异无统计学意义(P>0.05)。见图 3。

|
| 注:Control.正常对照组;Model.模型组;CH-L.柴胡配方颗粒低剂量组;CH-M.柴胡配方颗粒中剂量组;CH-H.柴胡配方颗粒高剂量组。n=8。 图 3 柴胡配方颗粒对高果糖诱导的高三酰甘油血症模型大鼠肝脏组织匀浆三酰甘油含量的影响 Fig. 3 Effect of formulae Bupleuri Radix granules on the content of triacylglycerol in liver tissue homogenate of rats with hypertriglyceridemia induced by high fructose |
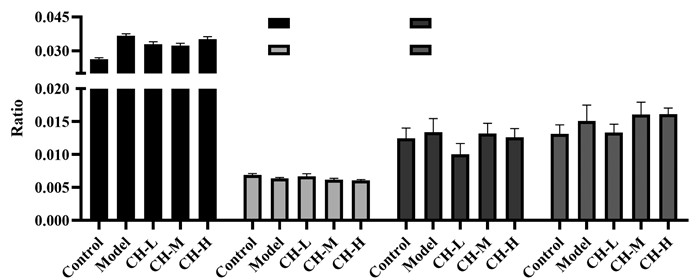
在肝脏脂质代谢基因调控方面,高果糖能显著增加大鼠肝脏组织脂肪酸合成关键基因硬脂酰辅酶A去饱和酶1(SCD1)、脂肪酸合成酶(FASN)及脂肪酸代谢重要细胞因子成纤维细胞生长因子21(FGF21)、乙酰辅酶A羧化酶1(ACC1)等mRNA水平的表达(P<0.05或P<0.01),而柴胡配方颗粒给药组与果糖诱导组相比无显著变化(P>0.05),见图 4。此外,与正常对照组相比,果糖诱导组明显降低肝脏组织转录因子碳水化合物反应元件结合蛋白(CHREBP)、氧化物酶体增殖物激活受体α(PPAR-α)、过氧化物酶体增殖物激活受体Y协同刺激因子1α(PGC1α)、脂肪酸氧化关键酶肉毒碱棕榈酰基转移酶1α(CPT1α)、微粒体三酰甘油转运蛋白(MTTP)及脂酰辅酶A氧化酶(ACO)等mRNA水平的表达(P<0.05或P<0.01),而柴胡配方颗粒对上述基因表达无明显影响(P>0.05)。以上结果表明:高果糖诱导可增加肝脏脂肪酸合成相关基因、降低其氧化基因的表达,可能与诱发高三酰甘油血症的机制有关,而柴胡配方颗粒无明显调节果糖诱导高三酰甘油血症模型大鼠肝脏脂质代谢相关基因的作用。由于高三酰甘油血症的病理机制涉及肝脏中众多因素,因此,尚需进一步研究肝脏其他因子的变化。
|
| 注:Control.正常对照组;Model.模型组;CH-H.柴胡配方颗粒高剂量组。n=6,与正常对照组相比,#P<0.05,##P < 0.01。 图 4 柴胡配方颗粒对高三酰甘油血症大鼠肝脏脂质沉积相关基因表达的影响 Fig. 4 Effects of formulae Bupleuri Radix granules on the expression of hepatic lipid deposition related genes in rats with hypertriglyceridemia |
脂肪细胞与三酰甘油储存和清除具有密切联系,在脂肪组织中三酰甘油的储存增加而清除减少,导致脂肪组织脂质周转异常,是诱发高血脂症的重要因素之一[12]。因此,本研究进一步考察了柴胡配方颗粒对大鼠脂肪组织的影响。在病理形态上,高果糖诱导明显导致大鼠脂肪组织细胞体积增大(与正常对照组相比P<0.01),而柴胡配方颗粒给药后显著降低(P<0.05),见图 5。提示柴胡配方颗粒对高果糖诱导的大鼠e-WAT细胞体积增大具有改善作用。
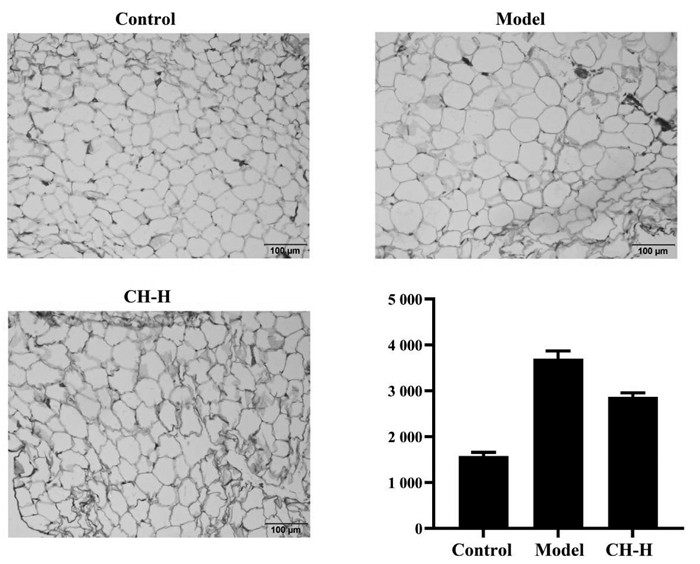
|
| 注:Control.正常对照组;Model.模型组;CH-H.柴胡配方颗粒高剂量组。n=6。与模型组相比,*P<0.05;与正常对照组相比,##P<0.01。 图 5 HE染色考察柴胡配方颗粒对高三酰甘油血症大鼠e-WAT病理形态学的影响 Fig. 5 Study on the effect of formulate B upleuri Radix Granules on e-WAT pathomorphology of hypertriglycer ridemia rats by HE staining |
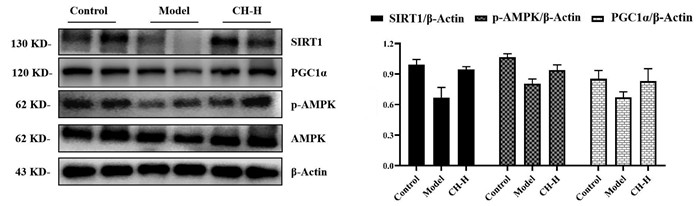
|
| 注:Control.正常对照组;Model.模型组;CH-H.柴胡配方颗粒高剂量组。n=6。与模型组相比,*P<0.05;与正常对照组相比,#P<0.05。 图 6 柴胡配方颗粒对高三酰甘油血症大鼠e-WAT脂质沉积相关蛋白表达的影响 Fig. 6 Effect of formulae Bupleuri Radix Granules on the expression of e-WAT Lipid deposition related proteins in hypertriglyceridemia rats |
进一步考察了柴胡配方颗粒对高三酰甘油模型大鼠脂肪组织能量代谢相关蛋白表达水平的影响。结果如图 5所示:果糖模型组能显著降低脂肪组织沉默调节蛋白1(SIRT1)、PGC1α蛋白水平表达及p-AMPK/AMPK的比值,提示果糖诱导能明显削弱大鼠脂肪组织AMPK/SIRT1/PGC1α的信号传导,进而影响脂肪组织脂质代谢。柴胡高剂量给药组明显激活AMPK,并显著增加脂肪组织SIRT1、PGC1α蛋白水平(与模型组相比,P<0.05),提示柴胡配方颗粒可能通过促进脂肪组织AMPK/SIRT1/PGC1α信号转导,进而改善高三酰甘油血症模型大鼠血脂紊乱。
5 讨论高三酰甘油血症是中国人群常见的脂质代谢异常,常与继发性疾病(如不良饮食、饮酒、肥胖、代谢综合征和2型糖尿病)并存[13]。如前所述,目前临床上常以他汀类药物治疗为主,但临床研究资料表明他汀类药物对中国患者引起的不良反应较为严重。本研究所采用的柴胡配方颗粒源于张仲景的经典古方小柴胡汤,现已在中医临床上作为解表剂广泛使用,具有较高的安全性。本研究发现柴胡配方颗粒对高三酰甘油血症模型大鼠具有一定的改善作用,这对于临床诊疗高三酰甘油血症以及柴胡配方颗粒新适应症的开发具有重要意义。
高含量碳水化合物作为高热量饮食中的重要组成之一,过多摄入与肥胖、糖尿病、高血脂症等多种代谢性疾病的发生和发展密切相关。长期摄入高糖含量的饮料易导致机体代谢功能紊乱,进一步加速代谢性相关疾病的发生。正如研究呈现的结果,大鼠长期摄入高热量的果糖水明显导致大鼠体质量增加、血清三酰甘油水平增加、血清葡萄糖含量增加及OGTT受损。在分子水平上,高果糖诱导可导致大鼠肝脏、脂肪组织脂质代谢相关基因或蛋白的异常表达等,进而导致体内脂质代谢紊乱,这与先前报道的果糖诱导糖脂代谢紊乱结果一致[14-16]。而柴胡配方颗粒对高三酰甘油血症模型大鼠肝脏组织有关脂肪酸转录(ChREBP)及合成基因(FASN、SCD1)和脂肪酸氧化相关基因(PPARɑ、CPT1ɑ、FGF21及PGC1ɑ等)无明显影响。鉴于肝脏在代谢性疾病中的重要地位及柴胡配方颗粒降低高三酰甘油血症的有效作用,后续将进一步研究柴胡降低三酰甘油血症与调控肝脏代谢的关系及其作用机制,如柴胡调控关键蛋白的蛋白水平或翻译后修饰水平的影响等。
脂肪组织作为一个较为活跃的器官,不仅参与能量储存,同时具备一定的分泌功能,可分泌多种与代谢性疾病具有密切联系的细胞因子,因而脂肪组织在代谢性疾病的发生和发展过程中占有重要地位[17-18]。PGC1α是能量代谢途径中众多转录因子的共激活因子(如PPARγ、SREBP及FOXO1等),在线粒体脂肪酸的氧化等能量代谢平衡过程中有重要的作用。在脂肪组织高表达PGC1α可促使脂肪组织产热增多,增加进线粒体合成及与呼吸作用相关基因的表达,增强整体呼吸能力、调节适应性产热,以消耗脂肪酸达到降脂作用[19-20]。SIRT1作为哺乳细胞内的一种依赖于烟酰胺腺苷二核苷酸(NAD+)的去乙酰化酶,可配体依赖性抑制PGC1α的去乙酰化作用,进而减少脂肪的合成及降低脂质蓄积[21-22]。同时SIRT1与能量代谢的重要调节因子——AMPK的活化起相互调节的作用[23]。因此,激活脂肪组织AMPK/SIRT1/PGC1α信号通路能有效减少脂肪的合成与脂质蓄积,改善脂质代谢紊乱[24]。
鉴于柴胡配方颗粒对肝脏脂质蓄积调控作用的结果(即柴胡配方颗粒改善高三酰甘油血症可能不主要依赖于对肝脏脂质蓄积的改善作用),提出柴胡配方颗粒能够通过降低脂肪组织的脂质蓄积进而改善高三酰甘油血症的假说。因此,在大鼠eWAT中检测了AMPK、p-AMPK、SIRT1及PGC1α的蛋白水平表达情况。结果发现高果糖显著削弱AMPK的磷酸化激活,降低SIRT1和PGC1α蛋白水平的表达,而柴胡配方颗粒给药后则显著逆转,提示柴胡配方颗粒可能通过促进脂肪组织AMPK/SIRT1/PGC1α的信号转导,降低脂肪组织脂质蓄积并改善高三酰甘油血症。此外,脂肪细胞肥大与脂肪细胞代谢紊乱具有密切的联系,其肥大的机制可能与脂肪细胞增生有关。脂肪细胞肥大与脂肪细胞胰岛素敏感性、炎症、细胞内氧化应激、代谢分泌、自噬及凋亡等多种脂肪细胞功能有关[25]。而研究结果发现柴胡配方颗粒能明显改善高果糖诱导的脂肪组织脂肪细胞体积增大,同时也进一步证实柴胡配方颗粒对脂肪组织潜在的调节作用。
综上所述,本研究报道了柴胡配方颗粒在改善高三酰甘油血症中的潜在研究价值,其作用机制可能与促进脂肪组织AMPK/SIRT1/PGC1α信号转导有关,为后续针对柴胡配方颗粒新适应症的开发和研究奠定了一定的理论和实验基础。
| [1] |
郭艺芳. 2014年中国胆固醇教育计划血脂异常防治专家建议[J]. 中华心脏与心律电子杂志, 2014, 2(3): 12-16. GUO Y F. China cholesterol education program expert advice for prevention and treatment of dyslipidemia in 2014[J]. Chinese Journal of Heart and Heart Rhythm(Electronic Edition), 2014, 2(3): 12-16. DOI:10.3877/cma.j.issn.2095-6568.2014.3.007 |
| [2] |
O'KEEFE J H, BELL D S. Postprandial hyperglycemia/hyperlipidemia (postprandial dysmetabolism) is a cardiovascular risk factor[J]. American Journal of Cardiology, 2007, 100(5): 899-904. DOI:10.1016/j.amjcard.2007.03.107 |
| [3] |
杨艳, 马俊. 中医药治疗血脂异常的研究进展[J]. 世界最新医学信息文摘, 2019, 19(20): 74, 77. YANG Y, MA J. Research progress of traditional Chinese medicine in treatment of dyslipidemia[J]. World Latest Medicine Information, 2019, 19(20): 74, 77. |
| [4] |
杜海燕, 方振威, 林阳. 他汀类药物防治动脉粥样硬化性心血管疾病相关指南解读及其临床应用现状分析[J]. 中国医院用药评价与分析, 2015, 15(2): 148-153. DU H Y, FANG Z W, LIN Y. Interpretation of the guidelines for the prevention and treatment of atherosclerotic cardiovascular disease with statins and its clinical application analysis[J]. Evaluation and Analysis of Drug-Use in Hospitals of China, 2015, 15(2): 148-153. |
| [5] |
陆炳旭, 高嘉良, 陈光, 等. 中药单体治疗血脂异常的机制研究进展[J]. 中国临床保健杂志, 2019, 22(5): 709-713. LU B X, GAO J L, CHEN G, et al. A review of the mechanism of Chinese medicine herbs and monomers for treating dyslipidemia[J]. Chinese Journal of Clinical Healthcare, 2019, 22(5): 709-713. DOI:10.3969/J.issn.1672-6790.2019.05.037 |
| [6] |
PAN L L, LI Z Z, WANG Y F, et al. Network pharmacology and metabolomics study on the intervention of traditional Chinese medicine Huanglian decoction in rats with type 2 diabetes mellitus[J]. Journal of Ethnopharmacology, 2020, 258(4): 112842. |
| [7] |
董祖木. 中药治疗高脂血症的临床研究进展[J]. 医药前沿, 2019, 9(29): 5-6. DONG Z M. Clinical research progress of traditional Chinese medicine in the treatment of hyperlipidemia[J]. Yiyao Qianyan, 2019, 9(29): 5-6. |
| [8] |
张耀峰. 中药柴胡皂苷药理作用的研究进展[J]. 环球中医药, 2020, 12(33): 120-121. ZHANG Y F. Research progress on pharmacological action of Chinese herb saikosaponin[J]. Global Traditional Chinese Medicine, 2020, 12(33): 120-121. |
| [9] |
孙晓卉, 张量. 柴胡药理作用的研究进展[J]. 中国医药导报, 2017, 14(10): 52-55. SUN X H, ZHANG L. Radix bupleuri research progress of pharmacological effects[J]. China Medical Herald, 2017, 14(10): 52-55. |
| [10] |
王少平, 于盈盈, 宋晓光, 等. 柴胡总皂苷降血脂作用及机制研究[J]. 中国新药杂志, 2020, 29(4): 437-442. WANG S P, YU Y Y, SONG X G, et al. Study on hypolipidemic effect and mechanism of saponins of Bupleurum Chinense[J]. Chinese Journal of New Drugs, 2020, 29(4): 437-442. DOI:10.3969/j.issn.1003-3734.2020.04.013 |
| [11] |
冯彦, 高晓霞, 秦雪梅. 柴胡及其类方降脂疗效和作用机制研究进展[J]. 中药材, 2019, 42(8): 1957-1961. FENG Y, GAO X X, QIN X M. Research progress on the lipid-lowering efficacy and mechanism of Chaihu and its derivatives[J]. Journal of Chinese Medicinal Materials, 2019, 42(8): 1957-1961. |
| [12] |
ARNER P, BERNARD S, SALEHPOUR M, et al. Dynamics of human adipose lipid turnover in health and metabolic disease[J]. Nature, 2011, 478(7367): 110-113. DOI:10.1038/nature10426 |
| [13] |
BRAHM A, HEGELE R A. Hypertriglyceridemia[J]. Nutrients, 2013, 5(3): 981-1001. DOI:10.3390/nu5030981 |
| [14] |
刘长金, 刘磊, 柯大智, 等. 高果糖引起的脂肪肝大鼠肾脏脂质合成相关基因和蛋白的表达[J]. 中国细胞生物学学报, 2014, 36(4): 446-454. LIU C J, LIU L, KE D Z, et al. Renal lipid accumulation and expression of the Proteins/Genes responsible for fatty acid synthesis in rats with fatty liver induced by fructose overconsumption[J]. Chinese Journal of Cell Biology, 2014, 36(4): 446-454. |
| [15] |
陈婷, 姚玲, 柯大智, 等. 生姜乙醇提取物改善果糖所致大鼠脂肪肝的作用机制研究[J]. 中药新药与临床药理, 2016, 27(1): 28-33. CHEN T, YAO L, KE D Z, et al. Mechanism of Ginger ethanol extract in improving fructose-induced rat fatty liver[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2016, 27(1): 28-33. |
| [16] |
YUAN C L, JIN Y Q, YAO L, et al. Rhodiola crenulata root extract ameliorates fructose-induced hepatic steatosis in rats: Association with activating autophagy[J]. Biomedicine & Pharmacotherapy, 2020, 125: 109836. |
| [17] |
HEEREN J, SCHEJA L. Brown adipose tissue and lipid metabo- lism[J]. Current Opinion in Lipidology, 2018, 29(3): 180-185. DOI:10.1097/MOL.0000000000000504 |
| [18] |
FUNCKE J B, SCHERER P E. Beyond adiponectin and leptin: adipose tissue-derived mediators of inter-organ communication[J]. Journal of Lipid Research, 2019, 60(10): 1648-1684. DOI:10.1194/jlr.R094060 |
| [19] |
王慧婷, 张岩晨, 徐梦怡, 等. 能量代谢关键调控因子PGC-1α的研究进展[J]. 生理学报, 2020, 72(6): 804-816. WANG H T, ZHANG Y C, XU M Y, et al. Research progresses on PGC-1α, a key energy metabolic regulator[J]. Acta Physiologica Sinica, 2020, 72(6): 804-816. |
| [20] |
PETTERSSONKA T, IZADI M, FERREIRA D M S, et al. Small molecule PGC-1α1 protein stabilizers induce adipocyte Ucp1 expression and uncoupled mitochondrial respiration[J]. Molecular Metabolism, 2018, 9(3): 28-42. |
| [21] |
SCHULZ T J, HUANG P, HUANG T L, et al. Brown fat paucity due to impaired BMP signaling induces compensatory browning of white fat[J]. Nature, 2013, 495(7441): 379-383. DOI:10.1038/nature11943 |
| [22] |
BOSTRM P, WU J, JEDRYCHOWSKI M P, et al. A PGC1-α-dependent myokine that drives brown-fat-like development of white fat and thermogenesis[J]. Nature, 2013, 481(4): 463-468. |
| [23] |
WANG J, DONG Z H, GUI M T, et al. Huoxue Qianyang Qutan Recipe attenuates left ventricular hypertrophy in obese hypertensive rats by improving mitochondrial function through SIRT1/PGC-1α deacetylation pathway[J]. Bioscience Reports, 2019, 39(12): BSR2019 2909. DOI:10.1042/BSR20192909 |
| [24] |
IWABU M, YAMAUCHI T, OKADA I M, et al. Adiponectin and AdipoR1 regulate PGC-1alpha and mitochondria by Ca2+ and AMPK/SIRT1[J]. Nature, 2010, 464(7293): 1313-1319. DOI:10.1038/nature08991 |
| [25] |
KLÖTING N, BLÜHER M. Adipocyte dysfunction, inflammation and metabolic syndrome[J]. Reviews In Endocrine & Metabolic Disorders, 2014, 15(4): 277-287. |
2. Chongqing Key Laboratory of Traditional Chinese Medicine for Prevention and Cure of Metabolic Diseases, Chongqing Medical University, Chongqing 400016, China
 2021, Vol. 38
2021, Vol. 38