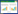文章信息
- 王静, 卓思思, 乔楠
- WANG Jing, ZHUO Sisi, QIAO Nan
- 泽兰提取物调控NDRG2对低糖低氧所致的神经细胞损伤的影响
- Effect of extract of Lycopus lucidus Turcz protect the cell from neuronal ischemic injury model by targeting NDRG2
- 天津中医药, 2021, 38(10): 1338-1344
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(10): 1338-1344
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.10.23
-
文章历史
- 收稿日期: 2021-07-10
脑缺血已成为严重公共卫生威胁,中药通过消除炎症、抑制细胞凋亡、促进血管生成等作用在脑缺血的防治方面发挥越来越重要的作用[1-2]。研究中药防治脑缺血的分子机制,对其靶向治疗具有重要意义。
研究发现,泽兰乙醇提取物对大鼠离体缺氧损伤心肌具有保护作用[3],且发现泽兰对大鼠局灶性脑组织缺血损伤及小鼠急性缺氧有不同程度的保护作用[4],但泽兰对神经细胞脑缺血损伤的影响及具体机制还不清楚。有报道发现,脑缺血再灌注损伤后,NDRG2 mRNA及蛋白表达量显著增多[5]。电针预处理可通过抑制NDRG2表达来诱导脑缺血耐受[6],七氟烷预处理可通过抑制脑组织星形胶质细胞NDRG2的表达和活性,减轻细胞凋亡、改善细胞功能,减轻脑缺血再灌注损伤[7]。本研究假设泽兰提取物可能通过调控NDRG2发挥对神经细胞脑缺血保护作用。
本研究通过对肾上腺嗜铬细胞瘤PC12细胞进行缺糖缺氧处理方式建立神经细胞脑缺血损伤细胞模型,以上调和下调NDRG2表达的方法来检测泽兰提取物影响模型细胞增殖、凋亡的作用机制,探寻泽兰提取物对神经细胞脑缺血损伤的临床意义。
1 材料与方法 1.1 材料大鼠肾上腺嗜铬细胞瘤细胞株PC12细胞购自ATCC;泽兰购自中药材市场,经本院黄尚峰教授鉴定;RPMI-1640培养基和胎牛血清(FBS)购自美国Gibco公司,胰蛋白酶Trypsin、噻唑蓝(MTT)和二甲基亚矾(DMSO)、多聚甲醛购自Sigma-Aldrich公司;兔抗鼠NDRG2抗体(货号:sc-376202)、Cyclin D1抗体(货号:sc-8396)、p21抗体(货号:sc-6246)、Bcl-2抗体(货号:sc-166943)、Bax抗体(货号:sc-7480)和GAPDH抗体(货号:sc-47724)购自美国Santa公司;si-NDRG2、pcDNA3.1-NDRG2、si-NC和pcDNA3.1购自苏州吉玛基因;流式法细胞凋亡检测试剂盒购自美国BD公司;流式细胞仪购自美国BD公司,显微镜购自日本Olympus,全自动酶标仪及Real-time PCR仪购自美国Bio-Rad公司。
1.2 方法 1.2.1 细胞培养和分组将PC12细胞培养在含10% FBS的RPMI1640培养基中(含100 U/mL青霉素+1% 链霉素),于饱和湿度、5% CO2、37 ℃培养箱中常规培养,胰蛋白酶消化传代,传至10~20代时进行实验。
对照组:PC12细胞正常培养;模型组:根据文献[8]的方法,将过夜培养贴壁的PC12细胞用无糖Earles平衡盐溶液洗涤2次,换为无糖氧-糖剥夺(OGD)液,置于密闭OGD罐内通入95%N2-5%CO2气体30 min,然后置培养箱中培养2 h,弃OGD液更换为RPMI1640培养基,培养24 h。检测葡萄糖含量和O2含量,以证明符合缺氧缺糖的缺血模型。转染组:模型组进行处理完成后培养24 h后进行转染。模型组+药物处理组:根据文献[3]的方法制备泽兰提取物,具体方法:称取500 g泽兰,切碎,置于95%乙醇中浸泡24 h,依次采用6倍与4倍药物体积的乙醇回流提取,应用回旋式减压浓缩机浓缩,冷冻干燥后得到粉末状药物,获得泽兰提取物4.75 g,将其置于DMSO(0.1%)溶液中配置母液,调整溶液浓度为10 g/L,用0.1、1、10 mg/mL的提取物对细胞进行处理。
1.2.2 细胞转染将PC12细胞用培养液稀释为2×105个/mL接种于6孔板中,培养至细胞基本融合为一层时按照Lipofectamine 2000说明书进行转染。转染分组:NDRG2抑制组(转染si-NDRG2,以转染si-NC组为对照)和NDRG2过表达组(转染pcDNA3.1-NDRG2,以转染pcDNA3.1为对照)。转染48 h后收集细胞进行验证。
1.2.3 MTT实验测定细胞增殖抑制率收集泽兰提取物处理或转染48 h的PC12细胞,以2×103个/孔接种于96孔板,在培养至24、48和96 h的时候进行MTT实验,加入20 μL(5 g/L)MTT,培养4 h,弃去培养液,每孔加入150 μL DMSO,室温振荡10 min,酶标仪测定OD490 nm处的吸光度(A)值。
1.2.4 流式细胞术测定细胞凋亡率收集各组PC12细胞,以每孔2×104个细胞接种于6孔板中,培养至融合度达到约80%,弃去培养液,洗涤消化,收集细胞,按照Annexin V/PI试剂盒说明书进行操作,先加200 μL binding buffer重悬细胞,然后加入5 μL Annexin V-FITC和5μL碘化丙啶(PI),室温避光孵育20 min,上流式细胞仪测定细胞凋亡率。
1.2.5 蛋白免疫印迹法(Western blot)检测蛋白表达收集各组PC12细胞,超声破碎并离心收集蛋白,测定总蛋白浓度。取蛋白样本进行SDS-PAGE,然后将蛋白转膜,室温封闭2 h,加入稀释的一抗NDRG2(1∶1 000)、Cyclin D1抗体(1∶3 000)、p21抗体(1∶2 000)、Bcl-2抗体(1∶2 000)、Bax抗体(1∶2 000)和GAPDH开头(1∶4 000),4 ℃孵育过夜,TBST洗膜2次,加入稀释的二抗室温孵育1 h,显影拍照,以GAPDH为内参照,分析蛋白表达水平。
1.3 统计学处理数据分析采用SPSS 23.0统计软件,结果以均数±标准差(x±s)表示。多个实验组间的比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 泽兰提取物对脑缺血损伤模型增殖的影响与对照组相比,模型组PC12细胞OD值显著降低,CyclinD1表达降低,p21表达升高,差异均具有统计学意义(P < 0.05);与模型组比较,模型组+泽兰提取物1 mg/mL和模型组+泽兰提取物10 mg/mL组PC12细胞OD值升高,CyclinD1表达升高,p21表达降低,差异均具有统计学意义(P < 0.05),泽兰提取物可促进脑缺血损伤模型PC12细胞增殖,见图 1。
|
| 注:A.泽兰提取物对脑缺血损伤模型增殖的影响;B、C.泽兰提取物对脑缺血损伤模型增殖蛋白表达的影响。与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 1 泽兰提取物对脑缺血损伤模型增殖的影响 Fig. 1 Effects of Lycopus lucidus Turcz extract on proliferation of cerebral ischemicinjury model PC12 cells |
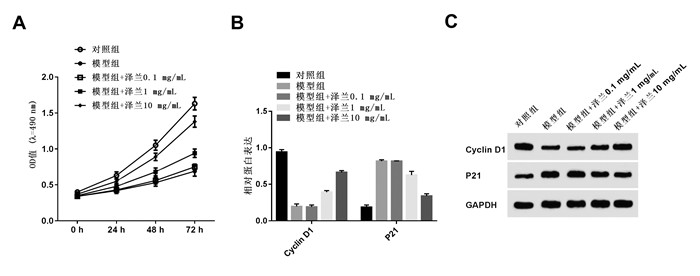
与对照组相比,模型组PC12细胞凋亡率均升高,Bax表达升高,Bcl-2表达下降,差异均具有统计学意义(P < 0.05);与模型组比较,模型组+泽兰提取物1 mg/mL和模型组+泽兰提取物10 mg/mL组PC12细胞凋亡率均降低,Bax表达降低,Bcl-2表达升高,差异均具有统计学意义(P < 0.05),见图 2。泽兰提取物可抑制脑缺血损伤模型PC12细胞凋亡。
|
| 注:A、B.泽兰提取物对脑缺血损伤模型凋亡的影响;C、D. 泽兰提取物对脑缺血损伤模型凋亡蛋白表达的影响。与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 2 泽兰提取物对脑缺血损伤模型凋亡的影响 Fig. 2 Effects of Lycopus lucidus Turcz extract on apoptosis of cerebral ischemic injury model PC12 cells |
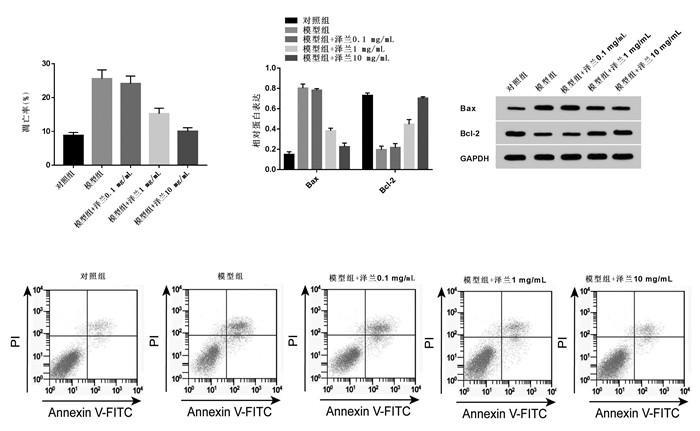
与对照组相比,模型组PC12细胞中NDRG2表达升高(P < 0.05);与模型组比较,模型组+泽兰提取物1 mg/mL和模型组+泽兰提取物10 mg/mL组PC12细胞中NDRG2表达降低(P < 0.05),见图 3。泽兰提取物可抑制脑缺血损伤模型PC12细胞中NDRG2表达。
|
| 注:A.泽兰提取物对脑缺血损伤模型中NDRG2表达的影响;B.NDRG2蛋白的表达。与对照组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 3 泽兰提取物对脑缺血损伤模型中NDRG2表达的影响 Fig. 3 Effects of Lycopus lucidus Turcz extract on expression of NDRG2 in cerebral ischemic injury model PC12 cells |
根据以上结果,泽兰提取物10 mg/mL组效果最佳,选择10 mg/mL泽兰提取物进行后续实验。
2.4 抑制NDRG2对脑缺血损伤模型增殖、凋亡的影响与模型组+si-NC组相比,模型组+si-NDRG2组P12细胞OD值升高,凋亡率下降,NDRG2、p21和Bax表达降低,Cyclin D1和Bcl-2表达升高,差异均具有统计学意义(P < 0.05),见图 4。说明抑制NDRG2表达可促进模型组PC12细胞增殖并抑制细胞凋亡。
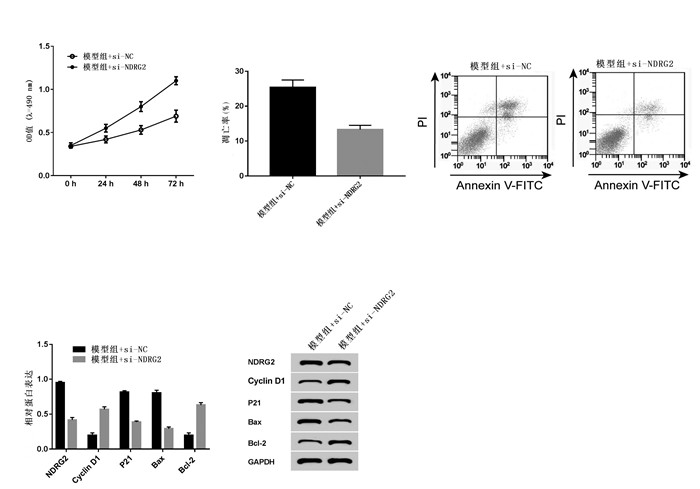
|
| 注:A.抑制NDRG2对脑缺血损伤模型增殖的影响;B、C.抑制NDRG2对脑缺血损伤模型凋亡的影响;D、E.抑制NDRG2对脑缺血损伤模型增殖、凋亡蛋白表达的影响。与模型组+si-NC比较,*P < 0.05。 图 4 抑制NDRG2对脑缺血损伤模型增殖、凋亡的影响 Fig. 4 Effects of NDRG2 inhibition on proliferation and apoptosis of cerebral ischemic injury model PC12 cells |
与模型组相比,模型组+泽兰10 mg/mL组PC12细胞OD值升高,NDRG2和p21表达降低,Cyclin D1表达增多,差异均具有统计学意义(P < 0.05);与模型组+泽兰10 mg/mL+pcDNA3.1组相比,模型组+泽兰10 mg/mL+pcDNA3.1-NDRG2组PC12细胞OD值降低,NDRG2和p21表达增多,Cyclin D1表达降低,差异均具有统计学意义(P < 0.05),见图 5。过表达NDRG2可逆转泽兰提取物对模型组PC12细胞增殖促进作用。
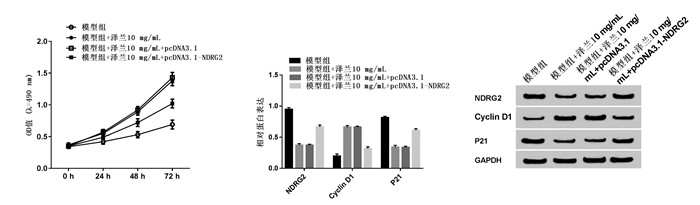
|
| 注:A.过表达NDRG2能逆转泽兰提取物对脑缺血损伤模型增殖的影响;B、C. NDRG2及增殖蛋白的表达。与模型组比较,*P < 0.05;与模型组+泽兰10 mg/mL+pcDNA3.1比较,#P < 0.05。 图 5 过表达NDRG2能逆转泽兰提取物对脑缺血损伤模型增殖的促进作用 Fig. 5 Over-expression of NDRG2 reversed the effect of Lycopus lucidus Turcz extract on proliferation of cerebral ischemic injury model PC12 cells |
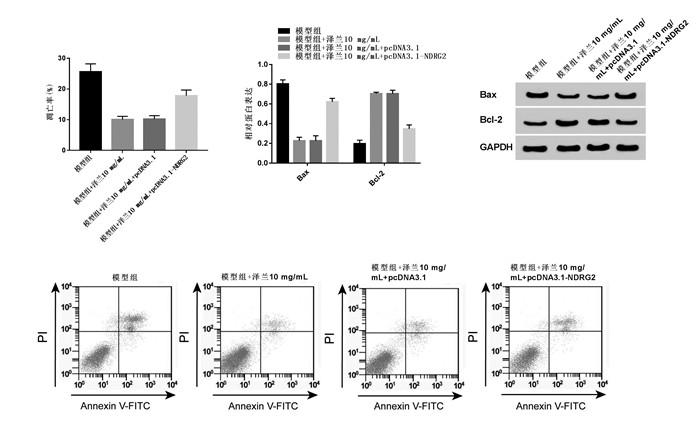
|
| 注:A、B. 过表达 NDRG2 能逆转泽兰提取物对 脑缺血损伤模型凋亡的影响;C、D. 过表达 NDRG2 能逆转泽兰提取物对 脑缺血损伤模型凋亡蛋 白表达的影响。与模型组 比较,*P < 0.05;与模型组 +泽兰 10 mg/mL+pcDNA3.1 比较,#P < 0.05。 图 6 过表达 NDRG2 能逆转泽兰提取物对脑缺血损伤模型凋亡的抑制作用 Fig. 6 Over-expression of NDRG2 reversed the effect of Lycopus lucidus Turcz extract on apoptosis of cerebral ischemic injury model PC12 cells |
与模型组相比,模型组+泽兰10 mg/mL组PC12细胞OD值升高,NDRG2和p21表达降低,Cyclin D1表达增多,差异均具有统计学意义(P < 0.05);与模型组+泽兰10 mg/mL+pcDNA3.1组相比,模型组+泽兰10 mg/mL+pcDNA3.1-NDRG2组PC12细胞OD值降低,NDRG2和p21表达增多,Cyclin D1表达降低,差异均具有统计学意义(P < 0.05),见图 5。过表达NDRG2可逆转泽兰提取物对模型组PC12细胞凋亡抑制作用。
3 讨论泽兰提取物具有抗癌、抗氧化和抗菌活性[9]。泽兰水提取物可能通过调控PI3K/Akt信号通路,调节HIF-1a及其下游蛋白表达,保护心肌细胞H9C2免受H/R诱导的细胞损伤[10]。泽兰对糖尿病大鼠视网膜病变具有保护作用,可减轻氧化应激、炎症和血管生成因子的水平[11]。本研究通过对PC12细胞进行缺糖缺氧处理方式建立神经细胞脑缺血损伤细胞模型,然后用0.1、1、10 mg/mL的泽兰提取物对模型组细胞进行处理,发现1 mg/mL和10 mg/mL泽兰提取物均可使模型组PC12细胞OD值升高,CyclinD1和Bcl-2表达升高,p21和Bax表达降低,促细胞增殖并抑制细胞凋亡,验证了泽兰提取物对脑缺血的保护作用。
NDRG2是一种与肿瘤抑制和细胞应激相关的基因,参与癌症能量代谢和上皮-间质转化(EMT),与肿瘤的发生、进展和转移有关[12-13]。NDRG2在短暂的局灶性脑缺血耐受反应性星形胶质细胞中显著上调,C6来源的星形胶质细胞在OGD暴露后p53相关的凋亡调节因子,沉默NDRG2表达具有促增殖作用,可降低OGD暴露后Bax/Bcl-2比值[14]。2-花生四烯基甘油(2-AG)通过阻断NDRG2信号和STAT3磷酸化来保护缺氧-葡萄糖环境中的原代星形胶质细胞[15]。在实验性脑缺血再灌注(I/R)大鼠模型中,抑制miR-301a可靶向NDRG2改善细胞凋亡和炎症反应,对大鼠脑I/R损伤有神经保护作用[16]。本研究结果发现,模型组PC12细胞中NDRG2蛋白表达量均显著上调,与上述结论[14]一致;1 mg/mL和10 mg/mL泽兰提取物均可抑制模型组细胞中NDRG2表达,抑制NDRG2表达可促进模型组PC12细胞增殖并抑制细胞凋亡;过表达NDRG2可逆转泽兰提取物对模型组PC12细胞增殖和凋亡的作用,证实了泽兰提取物通过调控NDRG2对神经细胞脑缺血起保护作用。
综上,本研究阐述了在脑缺血细胞模型中,泽兰提取物可通过抑制NDRG2的表达,促进细胞增殖并抑制细胞凋亡。说明泽兰提取物对神经细胞脑缺血具有潜在的治疗作用,NDRG2可能是脑缺血的潜在分子靶点。
| [1] |
LONG Y, YANG Q, XIANG Y, et al. Nose to brain drug delivery-a promising strategy for active components from herbal medicine for treating cerebral ischemia reperfusion[J]. Pharmacological Research, 2020, 8(1): 104795-104805. |
| [2] |
FU C, ZHANG X, ZENG Z, et al. Neuroprotective effects of Qingnao Dripping Pill against cerebral ischemia via inhibiting NLRP3 inflammasome signaling pathway: in vivo and in vitro[J]. Frontiers in Pharmacology, 2020, 11(1): 65-75. |
| [3] |
金玉, 张默函, 洪兰, 等. 泽兰乙醇提取物对大鼠离体心肌缺氧损伤的影响及机制[J]. 山东医药, 2017, 57(38): 17-20. JIN Y, ZHANG M H, HONG L, et al. Effect of ethanol extract of Lycopus lucidus Turcz on myocardial hypoxia injury of rats in vitro[J]. Shandong Medical Journal, 2017, 57(38): 17-20. |
| [4] |
孟冰, 闵冬雨, 谷淑玲. 5种中药对脑缺血缺氧损伤的保护作用[J]. 徐州医学院学报, 2009, 29(9): 615-617. MENG B, MIN D Y, GU S L. Protective effect of five Chinese herbs on cerebral ischemia and hypoxia injury[J]. Acta Academiae Medicinae Xuzhou, 2009, 29(9): 615-617. DOI:10.3969/j.issn.1000-2065.2009.09.022 |
| [5] |
曹欢. NDRG2对大鼠脑缺血后神经发生影响的研究[D]. 西安: 第四军医大学, 2013. CAO H. Study on the effect of NDRG2 on neurogenesis after cerebral ischemia in rats[D]. Xi'an: The Fourth Military Medical University, 2013. |
| [6] |
王枫, 李旭颖, 李艳, 等. NDRG2参与电针预处理诱导的大鼠脑缺血损伤的抗凋亡作用[A]. 2012第二届全球华人麻醉大会第五届全国青年麻醉学科医师学术论坛论文集[C]. 西安: 中华医学会, 2012: 143-143. WANG F, LI X Y, LI Y, et al. NDRG2 participates in the anti-apoptotic effect of cerebral ischemic injury induced by electroacupuncture pretreatment in rats[A]. The fifth session of the Second Global Chinese Anesthesia Congress 2012 Proceedings of the National Academic Forum of Young Anesthesiologists[C]. Xi'an: Chinese Medical Association, 2012: 143-143. |
| [7] |
李新. 星形胶质细胞NDRG2在七氟烷预处理神经保护作用中的机制研究[D]. 西安: 第四军医大学, 2015. LI X. The mechanism of astrocyte NDRG2 in the neuroprotective effect of sevoflurane pretreatment[D]. Xi'an: The Fourth Military Medical University, 2015. |
| [8] |
钱晓东. 抗自由基中药对小鼠脑片及PC12细胞脑缺血损伤模型的保护作用及作用机制研究[D]. 杭州: 浙江中医药大学, 2013. QIAN X D. Protective effect and mechanism of anti-free radical Chinese medicine on mouse brain slices and PC12 cell cerebral ischemic injury model[D]. Hangzhou: Zhejiang Chinese Medical University, 2013. |
| [9] |
YU J Q, LEI J C, ZHANG X Q, et al. Anticancer, antioxidant and antimicrobial activities of the essential oil of Lycopus lucidus Turcz. var. hirtus Regel[J]. Food Chemistry, 2011, 126(4): 1593-1598. DOI:10.1016/j.foodchem.2010.12.027 |
| [10] |
张沙沙, 金玉, 崔昊震. 泽兰水提取物对H9C2心肌细胞缺氧/复氧损伤的保护作用研究[J]. 时珍国医国药, 2019, 30(2): 289-292. ZHANG S S, JIN Y, CUI H Z. Protective effect of aqueous extract of Lycopus lycidus Turcz. on hypoxia/reoxygenation Injury in H9C2 Cardiomyocytes[J]. Lishizhen Medicine and Materia Medica Research, 2019, 30(2): 289-292. |
| [11] |
LIU J, BHUVANAGIRI S, QU X. The protective effects of Lycopus lycidus Turcz. in diabetic retinopathy and its possible mechanisms[J]. Artificial Cells Nanomedicine and Biotechnology, 2019, 47(1): 2900-2908. DOI:10.1080/21691401.2019.1640230 |
| [12] |
HU W, FAN C, JIANG P, et al. Emerging role of N-myc downstream-regulated gene 2 (NDRG2) in cancer[J]. Oncotarget, 2016, 7(1): 209-223. DOI:10.18632/oncotarget.6228 |
| [13] |
CHEN X L, LEI L, HONG L L, et al. Potential role of NDRG2 in reprogramming cancer metabolism and epithelial-to-mesenchymal transition[J]. Histology and Histopathology, 2017, 33(7): 11957. |
| [14] |
LI Y, XU N, CAI L, et al. NDRG2 is a novel p53-associated regulator of apoptosis in C6-Originated astrocytes exposed to oxygen-glucose deprivation[J]. PLoS One, 2013, 8(2): e57130. DOI:10.1371/journal.pone.0057130 |
| [15] |
WANG F, LI M, LI X, et al. 2-Arachidonylglycerol protects primary astrocytes exposed to oxygen-glucose deprivation through a blockade of NDRG2 signaling and stat3 phosphorylation[J]. Rejuvenation Research, 2016, 19(3): 215-222. DOI:10.1089/rej.2015.1703 |
| [16] |
FENG T, HAN B H, YANG G L, et al. Neuroprotective influence of miR-301a inhibition in experimental cerebral ischemia/reperfusion rat models through targeting NDRG2[J]. Journal of Molecular Neuroscience, 2019, 68(1): 144-152. DOI:10.1007/s12031-019-01293-0 |
 2021, Vol. 38
2021, Vol. 38