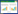文章信息
- 崔勇和, 沈先敏
- CUI Yonghe, SHEN Xianmin
- 白藜芦醇通过PI3K/Akt信号通路协同5-氟尿嘧啶对结肠癌细胞的抑制作用
- Resveratrol synergizes the inhibitory effect of 5-fluorouracil in colon cancer by suppressing PI3K/Akt signaling pathway
- 天津中医药, 2021, 38(10): 1345-1349
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(10): 1345-1349
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.10.24
-
文章历史
- 收稿日期: 2021-06-15
结肠癌是全球第3位常见的恶性肿瘤,病死率较高[1]。针对每位患者肿瘤类型、分期及身体健康情况,其治疗方法的选择也有较大差异。目前,结肠癌最常见的治疗方法包括手术、放疗和化疗[2]。然而,每种治疗方式都存在潜在的风险、益处和不良反应,从而迫切需要开发治疗该疾病的新策略。
5-氟尿嘧啶(5-FU)是极其常见治疗结肠癌的化疗药物之一[3]。5-FU作为一种常见抗肿瘤药物,也存在耐药现象[4]。因此,5-FU与其他药物联合使用,可以提供一种更有效的方法,增强肿瘤细胞化疗敏感性,同时降低对正常细胞的毒性。
白藜芦醇(RES)是一种植物抗毒素,存在于多种植物中(如葡萄、花生和浆果);已有证据表明,RES可以防治多种疾病,包括结肠炎和结肠癌[5-6]。已有研究指出RES可通过抑制磷脂酰肌醇激酶(PI3K)/蛋白激酶B(Akt)信号通路降低肝癌细胞的增殖和迁移[7]。本实验尝试在体外研究5-FU联合RES对人结肠癌SW620细胞的抗肿瘤活性,并观察其作用的分子机制。
1 材料及方法 1.1 主要材料及试剂RES购自Sigma公司,批号:492-37-10;DMEM培养基、胎牛血清(FBS)购自英国Gibco公司;CCK8试剂盒购买于北京智杰方远科技有限公司,批号:WST-8;Annexin V-FITC细胞凋亡检测试剂盒购买于武汉巴菲尔生物有限公司,批号:C1062S;p-p85、p-110β、p-PDK1、p-Akt、Akt、Cle-caspase 9、Cle-caspase 7和Cle-PARP抗体购自英国Abcam公司。
1.2 细胞培养及药物处理结肠癌SW620细胞来源于武汉巴菲尔生物有限公司,采用DMEM完全培养液(含10%FBS、1%的100 U/mL青霉素和100 g/mL链霉素)孵育细胞,培养温度37 ℃、CO2浓度为5%。待细胞生长至瓶底的90%左右,便可进行传代培养。取对数期细胞进行后续实验,RES处理细胞浓度为5、10、20、40 μmol/L,5-FU处理细胞浓度为25、50、100、150 μmol/L,RES和5-FU联合处理浓度分别为40、50 μmol/L,干预细胞时间为24 h。
1.3 细胞活性实验收集各组细胞,PBS清洗细胞一遍,每孔加入10 μL的CCK8试剂,继续培养2 h后,在450 nm波长处检测每孔吸光度OD值,并计算细胞相对活力。细胞相对活力(%)=药物组OD值/对照组A值×100%。
1.4 细胞克隆实验收集各组细胞,倒置显微镜观察细胞形态,并拍照。并随机选择10个视野,计数细胞,计算平均值作为细胞的克隆数。
1.5 细胞凋亡检测收集各组细胞,PBS清洗2次,PBS重悬后,分别加入Annexin-V FITC和PI处理细胞(按照试剂盒操作说明书进行),最后用流式细胞仪检测细胞凋亡情况。
1.6 蛋白免疫印迹(Western blot)实验收集各组细胞,PBS清洗细胞3次,裂解、超声破碎、12 000 r/min离心12 min后收集上清(离心半径=20 cm),BCA试剂盒测定上清蛋白浓度。每个样本上样50 μg进行凝胶电泳,待蛋白完全分离后进行转膜实验。结束后加入5%脱脂奶粉封闭液于摇床上室温封闭1 h后,分别加入对应一抗抗体(体积稀释比例均为1∶1 000)4 ℃反应过夜。次日TBST洗膜3次后加入HRP标记的山羊抗兔IgG(体积稀释比例为1∶3 000),室温反应1 h。再用TBST洗膜3次,每次10 min,以ECL试剂显影后进行蛋白条带灰度值分析。
1.7 PI3K抑制剂LY294002对SW620细胞生长的影响取对数期细胞,接种于6孔板,将细胞分为对照组、LY294002(2 μmol/L)、RES+5-FU组和LY294002+RES+5-FU组。首先采用LY294002预处理SW620细胞8 h,然后采用40 μmol/L的RES和50 μmol/L的5-FU处理细胞24 h,最后检测细胞活力、克隆数及凋亡率。
1.8 PI3K过表达对SW620细胞生长的影响取对数期细胞,接种于6孔板,将细胞分为对照组、PI3K mimics组、RES+5-FU组和PI3K mimics+RES+5-FU组。将PI3K mimics质粒转染SW620细胞16 h,然后采用40 μmol/L的RES和50 μmol/L的5-FU处理细胞24 h,最后检测细胞活力、克隆数及凋亡率。
1.9 统计学分析采用SPSS 20.0软件统计,实验数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为差异具有统计学意义。
2 结果 2.1 RES增强5-FU对SW620细胞增殖的抑制作用不同浓度RES(5~40 μmol/L)处理SW620细胞24 h,各浓度药物均能够明显抑制细胞活力(P < 0.05),见图 1A。然后采用不同5-FU(25~150 μmol/L)与40 μmol/L的RES共同处理SW620细胞24 h,发现与单独5-FU处理组比较,不同浓度5-FU+RES组中SW620细胞活力均明显降低(P < 0.05),见图 1B。另外,SW620细胞克隆检测表明,单独RES(40 μmol/L)、单独5-FU(50 μmol/L)和RES+5-FU联合处理均能明显减少SW620细胞克隆数(P < 0.05),并且RES+5-FU组相比于RES组和5-FU组细胞克隆数也显著降低(P < 0.05),见图 1C、1D。

|
| 注:A.细胞相对活力;B.细胞相对活力;C.细胞生长图片;D.细胞克隆数。与0 μmol/L的RES组或对照组比较,*P < 0.05;与RES+5-FU组比较,#P < 0.05。 图 1 RES和5-FU联合处理对SW620细胞活力和克隆的影响 Fig. 1 Effects of RES and 5-FU combination on the ability and colonies of SW620 cells |
与对照组比较,RES组、5-FU组和RES+5-FU组SW620细胞凋亡率及凋亡相关蛋白Cle-caspase 9、Cle-caspase 7和Cle-PARP表达水平显著升高(P < 0.05);与RES+5-FU组比较,RES组和5-FU组SW620细胞凋亡率及凋亡相关蛋白Cle-caspase 9、Cle-caspase 7和Cle-PARP表达水平则明显降低(P < 0.05),见图 2。

|
| 注:A.细胞凋亡图;B.细胞凋亡率;C.凋亡相关蛋白条带图;D.凋亡相关蛋白相对表达水平。与对照组比较,*P < 0.05;与RES+5-FU组比较,#P < 0.05。 图 2 RES和5-FU联合处理对SW620细胞凋亡的影响 Fig. 2 Effects of RES and 5-FU combination on the apoptosisof SW620 cells |
与对照组比较,RES组、5-FU组和RES+5-FU组SW620细胞中PI3K亚基p85、110β和PDK1及Akt磷酸化水平显著降低(P < 0.05);与RES+5-FU组比较,RES组和5-FU组SW620细胞中p85、110β和PDK1及Akt磷酸化水平则明显升高(P < 0.05),见图 3。
|
| 注:A.蛋白条带图;B.蛋白相对表达水平。与对照组比较,*P < 0.05;与RES+5-FU组比较,#P < 0.05。 图 3 RES和5-FU联合处理对PI3K/Akt信号转导的影响 Fig. 3 Effects of RES and 5-FU combination on the transduction of PI3K/Akt pathway |
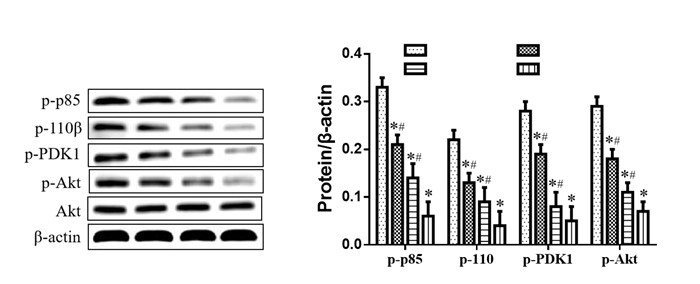
与对照组比较,LY294002组、RES+5-FU组和RES+5-FU+LY294002组SW620细胞活力和克隆数明显降低,而细胞凋亡率显著升高(P < 0.05);与RES+5-FU组比较,RES+5-FU+LY294002组SW620细胞活力和克隆数明显降低,而细胞凋亡率显著升高(P < 0.05),见图 4。
|
| 注:A.细胞活力;B.细胞凋亡率;C.细胞克隆数。与对照组比较,*P < 0.05;与RES+5-FU组比较,#P < 0.05。 图 4 LY294002处理SW620细胞生长的影响 Fig. 4 Effects of LY294002 on the growth of SW620 cells |
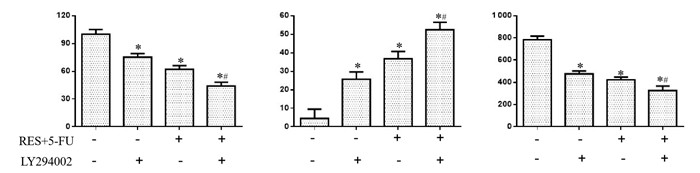
与对照组比较,PI3K mimics组SW620细胞活力和克隆数显著升高(P < 0.05),RES+5-FU组和RES+5-FU+PI3K mimics组SW620细胞活力和克隆数显著降低,而细胞凋亡率明显升高(P < 0.05)。与RES+5-FU组比较,RES+5-FU+PI3K mimics组SW620细胞活力和克隆数明显升高,而细胞凋亡率显著降低(P < 0.05),见图 5。
|
| 注:A.细胞活力;B.细胞凋亡率;C.细胞克隆数。与对照组比较,*P < 0.05;与RES+5-FU组比较,#P < 0.05。 图 5 PI3K过表达对SW620细胞生长的影响 Fig. 5 Effect of PI3K overexpression on the growth of SW620 cells |
5-FU作为结肠癌临床化疗的一线药物,有效的提高了总体生存率。然而,5-FU治疗也存在严重的局限性,如广泛的肿瘤耐药和毒性,导致治疗效果受到限制,迫切需要提高其化疗的效果。
已有研究指出,RES具有抗结肠癌细胞增殖和促凋亡的作用,还可以通过靶向多条信号通路治疗胃肠道肿瘤[6]。本项研究主要探讨结肠癌SW620细胞对RES和5-FU联合治疗的反应。研究已证实5-FU和RES分别能抑制肿瘤细胞生长[8],但是联合作用抗结肠癌的活性尚不清楚。本实验结果提示,RES和5-FU增强对结肠癌细胞生长的抑制作用是通过同时调节Caspase/PARP和PI3K/Akt信号通路实现的。该研究证实RES增强了人结肠癌细胞对5-FU化疗的敏感性,并考察了其联合作用潜在的分子机制。实验结果可作为天然化合物辅助治疗提高肿瘤化疗药物疗效的依据,并支撑RES和5-FU的协同作用。
流式细胞术分析表明,RES和5-FU对SW620细胞毒性的增强作用于诱导细胞凋亡相关。细胞凋亡或细胞程序性死亡是结肠癌发生发展和组织内环境稳定的重要生物学过程[9]。caspase信号途径的激活是细胞凋亡的基础,其中细胞色素c从线粒体膜间隙释放至细胞质中是caspase依赖性凋亡通路的前提。释放的细胞色素c可与ATP结合,并与pro-caspase 9结合形成凋亡小体,从而切断caspase 9前体,激活效应因子caspase 3[10]。本研究发现,RES显著增强5-FU介导的半胱氨酸蛋白酶Cle-caspase 9、Cle-caspase 7和Cle-PARP的激活作用。因此,结果提示5-FU和RES联合抑制结肠癌细胞增殖与caspase依赖性凋亡通路的激活有关。
PI3K/Akt信号通路与多种肿瘤的增殖、凋亡、迁移和侵袭等生物学行为密切相关,抑制其激活已被证实能阻断生存信号通路,加速肿瘤细胞的死亡[11-12]。针对PI3K/Akt信号通路及其相关关键信号分子的有效靶向作用,有望成为肿瘤治疗的重要方式。本实验发现,RES和5-FU联合处理可抑制结肠癌细胞中PI3K/Akt信号通路。另外,PI3K抑制剂干预可部分促进RES和5-FU介导的结肠癌细胞凋亡,而PI3K过表达则部分降低对细胞增殖的抑制作用。然而,早期已有相关报道指出RES可通过激活PI3K/Akt信号转导降低髓核细胞凋亡[13-14]。该结论与本研究结果不一致的主要原因是,PI3K/Akt在不同细胞类型中发挥的生物学效应不同,并且RES可通过不同途径去调节PI3K/Akt信号活化,进而调节相关的生物学行为。
综上所述,RES通过增强化疗药物抗肿瘤细胞增殖及促其凋亡活性,协同5-FU抑制结肠癌细胞的生长。此外,实验发现,RES协同5-FU对结肠癌SW620细胞的抑制作用,可以通过同时靶向caspase/PARP和PI3K/Akt信号通路实现。这些发现为RES协同5-FU治疗结肠癌的分子机制提供了新见解,并表明这种组合干预可能成为结肠癌治疗的一种更有效方法。
| [1] |
LORDICK F, MOSSNER J. Current standard diagnosis and treatment ofcolon cancer[J]. Deutsche Medizinische Wochenschrift, 2017, 142(7): 487-490. DOI:10.1055/s-0042-123913 |
| [2] |
STOCCHI L. The role of surgeons and oncologists combined to properly applycolon cancerguidelines[J]. Diseases of the Colon & Rectum, 2017, 60(1): 5-6. |
| [3] |
GULER Y, OVEY I S. Synergic and comparative effect of 5-fluorouraciland leucoverin on breast and colon cancercells through TRPM2 channels[J]. Bratislava Medical Journal-Bratislavske Lekarske Listy, 2018, 119(11): 692-700. |
| [4] |
LIU M N, LIU A Y, PEI F H, et al. Functional mechanism of the enhancement of 5-fluorouracil sensitivity by TUSC4 in colon cancer cells[J]. Oncology Letters, 2015, 10(8): 3682-3688. |
| [5] |
ALRAFAS H R, BUSBEE P B, NAGARKATTI M, et al. Resveratrolmodulates the gut microbiota to prevent murinecolitis development through induction of Tregs and suppression of Th17 cells[J]. Journal of Leukocyte Biology, 2019, 106(2): 467-480. DOI:10.1002/JLB.3A1218-476RR |
| [6] |
YUAN L, ZHOU M, HUANG D, et al. Resveratrolinhibits the invasion and metastasis of colon cancer through reversal of epithelial-mesenchymal transition via the AKT/GSK-3β/Snail signaling pathway[J]. Molecular Medicine Reports, 2019, 20(3): 2783-2795. |
| [7] |
CHAI R, FU H, ZHENG Z, et al. Resveratrolinhibits proliferation and migration through SIRT1 mediated post-translational modification of PI3K/AKT signaling in hepatocellular carcinoma cells[J]. Molecular Medicine Reports, 2017, 16(6): 8037-8044. DOI:10.3892/mmr.2017.7612 |
| [8] |
ELMESHAD A N, MORTAZAVI S M, MOZAFARI M R. Formulation and characterization of nanoliposomal 5-fluorouracil for cancernanotherapy[J]. Journal of Liposome Research, 2014, 24(1): 1-9. DOI:10.3109/08982104.2013.810644 |
| [9] |
NEGRONI A, CUCCHIARA S, STRONATI L. Apoptosis, necrosis, and necroptosis in the gut and intestinal homeostasis[J]. Mediators of Inflammation, 2015, 45(5): 250-262. |
| [10] |
LI P, ZHAO L, ZHAO T, et al. Caspase-9:structure, mechanisms and clinical application[J]. Oncotarget, 2017, 8(14): 23996-24008. DOI:10.18632/oncotarget.15098 |
| [11] |
CHEN H, ZHOU L, WU X, et al. The PI3K/AKT pathway in the pathogenesis of prostate cancer[J]. Frontiers in Bioscience-Landmark, 2016, 21(4): 1084-1091. |
| [12] |
MARTINI M, DE SANTIS M C, BRACCINI L, et al. PI3K/AKT signaling pathway and cancer: an updated review[J]. Annals of Medicine, 2014, 46(6): 372-383. DOI:10.3109/07853890.2014.912836 |
| [13] |
JIANG Y, XIE Z, YU J, et al. Resveratrol inhibits IL-1β-mediated nucleus pulposus cell apoptosis through regulating the PI3K/Akt pathway[J]. Bioscience Reports, 2019, 39(3): 209-213. |
| [14] |
WANG W, LI P, XU J, et al. Resveratrol attenuates high glucose-induced nucleus pulposus cell apoptosis and senescence through activating the ROS-mediated PI3K/Akt pathway[J]. Bioscience Reports, 2018, 38(2): 321-326. |
 2021, Vol. 38
2021, Vol. 38