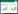文章信息
- 张丽丽, 杜凯, 王洋, 王文慧, 赵孟雄, 沈燕
- ZHANG Lili, DU Kai, WANG Yang, WANG Wenhui, ZHAO Mengxiong, SHEN Yan
- 电针人迎、太冲穴对自发性高血压大鼠模型肾脏组织FoxP3和RORγt的影响
- Effect of electroacupuncture at Renying and Taichong on kidney tissue Foxp3 and RORγt in spontaneous hypertension rats model
- 天津中医药, 2021, 38(11): 1421-1425
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(11): 1421-1425
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.11.13
-
文章历史
- 收稿日期: 2021-05-20
2. 国家中医针灸临床医学研究中心, 天津 300193;
3. 天津市针灸学重点实验室, 天津 300193;
4. 天津市针灸研究所, 天津 300193
高血压已成为全球重大公共卫生问题,是引起心脑血管、肾脏疾病的重要危险因素[1],研究表明,高血压前期的发生率约占成人50%,远期并发症使患者寿命减少5年[2]。高血压病前期是高血压和正常血压之间的一种临界状态,其危害主要表现在极易进展为临床高血压,此期已存在靶器官损害,如微量白蛋白尿、视网膜小动脉狭窄、颈动脉内中膜厚度增加,左室肥厚等[3]。因此,深入研究高血压病的发病机制,积极探索有效的干预方法,是当前高血压防治的重点和难点。针灸干预疏通经络,平衡人体气血阴阳。因此,在高血压病早期或尚未发生靶器官损害及并发症发生的情况下,采用针灸治疗以调和经络气血,使机体达到阴平阳秘的状态,是有效防治高血压病的重要手段。
近年来,越来越多的研究发现免疫-炎症机制对高血压病的发生、发展起重要的作用[4],Th17细胞和Treg细胞在高血压病中的关系日益受到重视,肾组织免疫炎性细胞的浸润与高血压病发生密切相关[4]。高血压病前期大鼠Treg细胞比例降低,Treg细胞下降促进高血压病的发生发展[5]。正常情况下两种细胞效应处于一种平衡状态,两者失衡是促进高血压病发生发展的重要因素。叉头状转录因子(FoxP3)、维甲酸相关孤独核受体-γt(RORγt)分别为Treg细胞和Th17细胞特异性转录因子。干预FoxP3、RORγt这一重要环节可能起到缓解疾病进展的作用。为此,本研究采用“活血散风”针刺法干预4周龄自发性高血压大鼠模型,从FoxP3、RORγt蛋白及mRNA的调节作用角度,观察电针对自发性高血压大鼠(SHRs)的治疗效果,为电针干预高血压前期大鼠效应机制的阐明提供实验依据。
1 材料与方法 1.1 动物与分组健康雄性SHR大鼠16只,4周龄,由北京维通利华实验动物技术有限公司提供,适应性喂养2 d。SHR大鼠经筛选后分为即模型对照组(SHR组)、电针+SHR组,每组8只;健康雄性WKY 8只,4周龄,作为正常对照组(WKY组)。实验动物于二级动物房饲养,室温20~25 ℃,光照时间07:00~19:00,自由摄食饮水。
1.2 主要试剂和仪器ROR兔多抗(Abcam公司,ab278099),FoxP3兔多抗(Abcam公司,ab215206),β-actin鼠单克隆抗体(北京中杉金桥生物技术有限公司,TA-09),山羊抗兔IgG(H+L)HRP(北京中杉金桥生物技术有限公司,ZB2301)。电针仪(HANS-200E,南京济生医疗科技有限公司),血压仪(北京软隆生物技术有限公司,中国),LightCycler® 96实时荧光定量聚合酶链反应(PCR)仪(罗氏公司,瑞士)。
1.3 治疗方法 1.3.1 穴位及针具的选择大鼠人迎穴定位参照沈雪勇《经络腧穴学》和王增涛《Wistar大鼠解剖图谱》,位于颈部三角区内、平耳垂,当胸骨舌骨肌与胸锁乳突及上缘交点、颈动脉搏动处。太冲穴位于后肢足背1、2趾骨间凹陷处。
针具选用“华佗牌”毫针(苏州医疗用品厂生产)。电针仪选用韩氏神经穴位刺激仪HANS-200E(南京济生医疗科技有限公司,产品标准编YZB/苏0049- 2008)。
1.3.2 干预方法及电针刺激参数1)电针+SHR组:采用鼠衣束缚固定大鼠,暴露针刺部位,针刺双侧人迎穴,针刺深度5 mm,双侧太冲穴,针刺深度2 mm;刺激参数:疏密波,频率2/15 Hz,电流1 mA,持续时间15 min。每日上午10点针刺1次,5日/周,共2周。2)SHR组和WKY组:均不给予任何干预,仅于每日针刺干预同一时间点给予相同方法及强度的束缚固定。
1.4 观察指标及检测方法 1.4.1 血压测量使用日本Softron无创血压仪进行鼠尾血压测量。在室温(22±2)℃条件下,测量大鼠安静、清醒状态鼠尾血压,待血流波形稳定后,开始记录数据,共记录5组,去掉最高值和最低值,取平均值。测量干预前、干预1周后、干预2周后大鼠的血压。
1.4.2 肾脏组织形态在治疗结束后2周时,各组大鼠禁食24 h,按3.5 mL/kg的比例腹腔注射10%水合氯醛,深度麻醉后颈椎离断处死,固定在大鼠手术台上,常规消毒,沿腹正中线剪开腹腔,迅速取出大鼠肾脏,剥离包膜,左肾称量质量后放入固定瓶内(4%多聚甲醛固定液)备用,右肾立即放入液氮冻存,置于-80 ℃冰箱内保存备用。
将制备好的部分肾脏组织固定于4%多聚甲醛固定液24 h以上,梯度乙醇及二甲苯脱水,石蜡浸蜡,包埋,切片机上切片,片厚4 μm;二甲苯脱蜡20 mim,梯度乙醇各5 min,流水冲洗15 min,苏木精染色8 min,清水冲洗10 min,伊红染液染色1~3 min。梯度乙醇脱水,二甲苯透明,中性树胶封片,光镜下观察肾脏组织形态。
1.4.3 FoxP3、RORγt表达水平检测 1.4.3.1 蛋白免疫印迹(Western blot)法测定肾脏FoxP3、RORγt蛋白的表达取肾脏100 mg,剪碎,加入裂解液,充分研磨,冰上裂解30 min,7800 g,离心20 min取上清液,BCA法计算样本蛋白浓度。加入蛋白上样缓冲液,沸水浴中10 min使蛋白变性,制备分离胶和浓缩胶,用微量加样器将样品加入样品槽中,上样量为30 μg,电泳:浓缩胶80 V 30 min,分离胶12 V 50 min;湿转法将蛋白电转至PVDF膜上,电流为300 mA 2 h,用5%脱脂奶粉封闭,TBST洗膜3×5 min,稀释一抗:β-actin 1∶1 000,RORγt 1∶500,FoxP3 1∶1 000;将膜放入杂交袋中加入一抗,4 ℃孵育过夜;室温平衡30 min,TBST洗膜3×5 min,稀释二抗:辣根酶标记的山羊抗兔1∶20 000,辣根酶标记的山羊抗小鼠1∶20 000,将膜浸在二抗中,于摇床上室温孵育1 h。洗膜后进行ECL反应,凝胶成像分析系统摄像分析。用Image J软件读取灰度值对蛋白进行半定量分析。
1.4.3.2 RT-PCR技术测定肾脏组织FoxP3、RORγt mRNA表达取100 mg肾脏组织,加入液氮研碎组织,收集组织粉于EP管;加入1 mL Trizol裂解液轻轻震荡,使组织充分裂解,冰上静置5 min;12 000 g,4 ℃离心5 min,吸取上清液,移入新的EP管中。每管加入200 μL氯仿,颠倒混匀,室温静置5 min,12 000 g,4 ℃离心15 min;吸取上层水相移至新的EP管中,每管加入500 μL异丙醇,颠倒混匀,室温静置10 min,12 000 g,4 ℃离心10 min,弃上清液;加入1 mL 75%的乙醇,涡旋混合,7 500 g,4 ℃离心5 min,弃上清液,室温干燥10 min;加入20 μL的DEPC水溶解RNA(或置于-80 ℃冰箱保存备用);取少量总RNA用微量核酸蛋白分析仪分析RNA含量和纯度;将提取的RNA反转录成cDNA,进行实时荧光定量PCR扩增反应。反应体系为:MIX 10 μL,上游引物0.5 μL,下游引物0.5 μL,模板cDNA 2 μL,水7 μL;反应参数为:预变性95 ℃,3 min;变性95 ℃,5 s;退火56 ℃,10 s;延伸72 ℃,25 s;39个循环;溶解曲线分析;引物序列如下:RORγt-F:ATGGAGCTCTGCCAGAATGA,RORγt-R:TGCGGTTGTCAGCATTGTAG;FoxP3-F:CAGCGTGGTTTTTCTTCTCGGTATA,FoxP3-R:TGGTGAAGTGGACTGACAGAAAAG;GAPDH-F:TGAGTCCTTCCACGATACCA;GAPDH-R:ATCCCATCACCATCTTCCAG。
1.5 统计学方法数据应用统计软件SPSS 22.0进行统计分析,统计描述采用均数±标准差(x±s)表示,组间比较采用单因素方差分析(One-way ANOVA),各个实验组之间的两两比较采用最小显著性差异法(LSD test),P < 0.05代表差异有统计学意义。
2 结果 2.1 大鼠血压水平变化干预前3组大鼠收缩压比较,SHR组、电针+SHR组大鼠收缩压水平显著高于WKY组(P < 0.05),提示4周龄SHR大鼠血压明显高于WKY大鼠;干预2周后,与SHR组比较,电针+SHR组收缩压水平降低,具有统计学差异(P < 0.05),提示电针有延缓收缩压上升的趋势。见表 1。
|
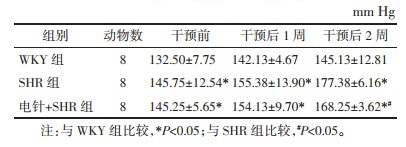
WKY组肾脏组织可见肾小管排列紧密,肾小管上皮细胞形态正常,肾小球毛细血管界限较清晰;SHR组、电针+SHR组肾脏组织肾小球形态尚正常,少量的肾小管上皮细胞胞质疏松,少量肾小管上皮细胞脱落入管腔(箭头示)。见图 1。
|
| 注:A.WKY组;B.SHR组;C.电针+SHR组。 图 1 各组大鼠肾脏组织HE染色 Fig. 1 HE staining of rat kidney in the WKY, SHR and Acupuncture+SHR groups |
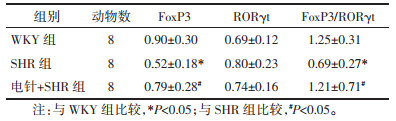
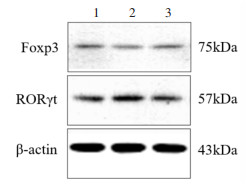
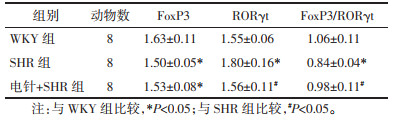
肾脏FoxP3蛋白表达水平比较,SHR组低于WKY组,电针+SHR组高于SHR组,差异均有统计学意义(P < 0.05);肾脏RORγt蛋白表达水平比较,SHR组高于WKY组,电针+SHR组低于SHR组,但差异均无统计学意义(P > 0.05);FoxP3/RORγt蛋白表达的比值组间比较,SHR组低于WKY组,电针+SHR组高于SHR组,差异均有统计学意义(P < 0.05)。见表 2、图 2。
|
|
| 注:1.WKY组;2.SHR组;3.电针+SHR组。 图 2 各组大鼠肾脏组织中FoxP3和RORγt蛋白的相对表达(x±s,n=8) Fig. 2 Relative expression of FoxP3 and RORγt protein in kidney tissues of rats in each group (x±s, n=8) |
肾脏FoxP3 mRNA表达水平比较,SHR组、电针+SHR组低于WKY组,差异均有统计学意义(P < 0.05);肾脏RORγt mRNA表达水平比较,SHR组高于WKY组,电针+SHR组低于SHR组,差异均有统计学意义(P < 0.05);FoxP3/RORγt mRNA表达的比值比较,SHR组低于WKY组,电针+SHR组高于SHR组,差异均有统计学意义(P < 0.05)。见表 3。
|
高血压病前期仍处于萌芽状态,既可发展成高血压病,又可在这个阶段逆转,所以高血压病前期是非常重要的干预介入时点。针刺治疗作为中医学特色疗法之一,可疏通经络气血,激发人体正气,调整机体阴阳平衡。石学敏院士提出的“活血散风”针刺降压法,以人迎和太冲穴为主穴,临床研究证实降压效应确切。人迎穴最早载于《灵枢·本输》,为足阳明胃经经穴,为足阳明少阳之会,与肾、脾、肝、心、三焦、胆、小肠、冲脉、任脉、阴跷脉等经脉相通,是调节气海的“营运之输”,是“气海”之门户,有宽胸理气、调和气血,调节血压的功能。太冲为足厥阴之原穴,具有宽胸理气、平肝息风、活血化瘀、调和气血阴阳平衡之功。
近年来,越来越多的文献报道T细胞在原发性高血压病的发病中发挥重要作用[6],肾脏、血管壁及血管外周免疫细胞浸润和炎症因子的释放是高血压病的重要特征[7-8]。血管紧张素Ⅱ、醛固酮和盐等刺激中枢和直接作用于肾脏、血管系统,导致血压轻度上升,此时为高血压病前期。此期轻微组织损伤、新抗原或损伤相关性分子形成,激活抗原呈递细胞,发生免疫反应,T淋巴细胞被激活。Th17细胞释放细胞因子IL-17等,引起前炎性反应,导致血管收缩,促进钠水吸收,进而促进高血压病的发展,导致血管重构和心脑肾等重要脏器损害[9-11]。FoxP3是Terg细胞的特异性标志物,该因子不仅对T细胞具有活性调节作用,而且还是体内重要的抗炎因子。研究发现,Tregs的保护性作用可能主要通过FoxP3的直接调节,FoxP3及RORγt分别是Treg和Th17细胞分化的关键转录因子,敲除RORγt会影响Th17细胞的分化,减轻炎症反应[12-13]。FoxP3与RORγt的表达异常是导致Treg/Th17失衡的关键。研究发现,替米沙坦与瑞舒伐他汀联合治疗可改善高血压病颈动脉粥样硬化患者Th17/Treg功能平衡[14],然而以高血压病前期大鼠为研究对象,从FoxP3/RORγt失衡角度探索针刺降压机制的研究鲜有报道。
SHR是通过自然筛选的:1963年日本京都大学医学院利用有自发性高血压的Wistar雄性鼠和高血压水平稍高的雌性Wistar鼠交配,从所得的F1代开始近交筛选,随着代数增加,自发性高血压发生率逐渐增大。1969年美国国立卫生研究院(NIH)引入了SHR。SHR除有高血压自发率为100%特点外,还有高血压性心血管病变,适于人类的高血压病研究。本研究结果发现,与WKY组大鼠相比,6周龄高血压病模型大鼠肾脏组织RORγt mRNA表达升高,FoxP3蛋白和mRNA的表达、FoxP3/RORγt的比值明显降低,当电针干预后,肾脏组织FoxP3蛋白表达增加,RORγt mRNA表达降低;电针还可提高FoxP3/ RORγt的比值,使其趋于正常。结合收缩压水平的下降,说明FoxP3和RORγt在电针治疗低周龄高血压病大鼠的效应机制中发挥了重要作用。因此,电针可降低高血压前期大鼠的血压水平,其机制可能与调节FoxP3/RORγt的动态平衡有关。
高血压可以直接造成肾脏形态的损害,主要表现为肾小球和肾小管受损[15]。本研究发现6周龄的SHR肾脏形态改变并不十分明显,其肾小球形态正常,少量肾小管上皮细胞胞质疏松,少量肾小管上皮细胞脱落入管腔。可能与周龄偏小,尚未出现显著的肾脏损害有关。
SHR是公认的最接近人类原发性高血压的动物模型,SHR 5周龄后收缩压开始升高,10周后收缩压水平显著上升,20周后收缩压稳定在较高水平。为了研究电针对高血压病前期大鼠的效应及其调节机制,故本研究选择了4~6周龄的SHR大鼠。这与其他关于高血压前期的研究类似,Liang等[16]采用了4周龄的SHR大鼠,Kvandova M等[17]研究者采用了5周龄的SHR大鼠。
然而本研究也存在不足,由于经费有限,本研究观察了该周龄段大鼠的FoxP3和RORγt的蛋白和mRNA表达情况,未来可以检测Treg、Th17细胞及其相关炎症因子的水平;此外,鉴于2周的干预可能对靶器官损害的改变不明显,本研究只观察了干预结束时肾脏组织结构情况,未对干预前后的肾功能进行检测对比。未来可以增加治疗疗程及观察时点,从而从免疫炎症角度系统阐述电针对高血压病前期大鼠的效应机制。
| [1] |
BLACHER J, LEVY B I, MOURAD J J, et al. From epidemiological transition to modern cardiovascular epidemiology: hypertension in the 21st century[J]. Lancet, 2016, 388(10043): 530-532. DOI:10.1016/S0140-6736(16)00002-7 |
| [2] |
SCHUNKERT H. Pharmacotherapy for prehypertension-mission accomplished?[J]. New England Journal of Medicine, 2006, 354(16): 1742-1744. DOI:10.1056/NEJMe068057 |
| [3] |
PIMENTA E, OPARIL S. Prehypertension: epidemiology, consequences and treatment[J]. Nature Reviews Nephrology, 2010, 6(1): 21-30. DOI:10.1038/nrneph.2009.191 |
| [4] |
SOLAK Y, AFSAR B, VAZIRI N D, et al. Hypertension as an autoimmune and inflammatory disease[J]. Hypertension Research, 2016, 39(8): 567-573. DOI:10.1038/hr.2016.35 |
| [5] |
KATSUKI M, HIROOKA Y, KISHI T, et al. Decreased proportion of Foxp3+ CD4+ regulatory T cells contributes to the development of hypertension in genetically hypertensive rats[J]. Journal of Hypertension, 2015, 33(4): 773-783. DOI:10.1097/HJH.0000000000000469 |
| [6] |
LEE E, KIM N, KANG J, et al. Activated pathogenic Th17 lymphocytes induce hypertension following high-fructose intake in Dahl salt-sensitive (SS) but not Dahl salt-resistant (SR) rats[J]. Disease Models and Mechanisms, 2020, 13(5): dmm044107. |
| [7] |
SCHIFFRIN E L. Immune mechanisms in hypertension and vascular injury[J]. Clinical Science, 2014, 126(4): 267-274. DOI:10.1042/CS20130407 |
| [8] |
MIAN M O, PARADIS P, SCHIFFRIN E L. Innate immunity in hypertension[J]. Current Hypertension Reports, 2014, 16(2): 413. DOI:10.1007/s11906-013-0413-9 |
| [9] |
WENZEL U O, BODE M, KURTS C, et al. Salt, inflammation, IL-17 and hypertension[J]. British Journal of Pharmacology, 2019, 176(12): 1853-1863. DOI:10.1111/bph.14359 |
| [10] |
HARRINGTON L E, HATTON R D, MANGAN P R, et al. Interleukinl7 producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J]. Nature Immunology, 2005, 6(11): 1123-1132. DOI:10.1038/ni1254 |
| [11] |
IDRISKHODJA N, MIAN M O, PARADIS P, et al. Dual opposing roles of adaptive immunity in hypertension[J]. European Heart Journal, 2014, 35(19): 1238-1244. DOI:10.1093/eurheartj/ehu119 |
| [12] |
Cmara N O, Sebille F, Lechler RI. Human CD4+, CD25+ regulatory cellshave marked and sustained effects on CD8+ T cell activation[J]. Eur J Immunol, 2003, 33(12): 3483-3483. |
| [13] |
ETESAM Z, NEMATI M, EBRAHIMIZADEH M A, et al. Altered expression of specific transcription factors of Th17(RORγt, RORα) and Treg lymphocytes (FOXP3) by peripheral blood mononuclear cells from patients with multiple sclerosis[J]. Journal of Molecular Neuroscience, 2016, 60(1): 94-101. DOI:10.1007/s12031-016-0789-5 |
| [14] |
LIU Z, ZHAO Y, WEI F, et al. Treatment with telmisartan/rosuvastatin combination has a beneficial synergistic effect on ameliorating Th17/Treg functional imbalance in hypertensive patients with carotid atherosclerosis[J]. Atherosclerosis, 2014, 233(1): 291-299. DOI:10.1016/j.atherosclerosis.2013.12.004 |
| [15] |
贾晓娟, 袁建喜. 高血压病患者早期肾损害病理改变及诊断方法的进展[J]. 中国医学创新, 2013, 10(8): 154-155. JIA X H, YUAN J X. Progress in pathological changes and diagnostic methods of early renal damage in patients with hypertension[J]. Medical Innovation of China, 2013, 10(8): 154-155. |
| [16] |
LIANG X, XING W, HE J, et al. Magnolol administration in normotensive young spontaneously hypertensive rats postpones the development of hypertension: role of increased PPAR gamma, reduced TRB3 and resultant alleviative vascular insulin resistance[J]. Plos One, 2015, 10(3): e0120366. DOI:10.1371/journal.pone.0120366 |
| [17] |
KVANDOVA M, BARANCIK M, BALIS P, et al. The peroxisome proliferator-activated receptor gamma agonist pioglitazone improves nitric oxide availability, renin-angiotensin system and aberrant redox regulation in the kidney of pre-hypertensive rats[J]. J Physiol Pharmacol, 2018, 69(2). |
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300193, China;
3. Tianjin Key Laboratory of Acupuncture and Moxibustion Science, Tianjin 300193, China;
4. Tianjin Acupuncture and Moxibustion Research Institute, Tianjin 300193, China
 2021, Vol. 38
2021, Vol. 38