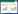文章信息
- 郑东翔, 钟喨, 黄智峰, 曾建峰, 吴松
- ZHENG Dongxiang, ZHONG Liang, HUANG Zhifeng, ZENG Jianfeng, WU Song
- 芍药甘草汤灌肠治疗大鼠氯胺酮相关性膀胱炎的实验研究
- Effect of enema of Shaoyao Gancao Decoction in ketamine cystitis rats
- 天津中医药, 2021, 38(11): 1443-1448
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(11): 1443-1448
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.11.18
-
文章历史
- 收稿日期: 2021-05-13
氯胺酮是一种临床常见的麻醉药物,主要应用于小儿外科麻醉[1]。由于氯胺酮的兴奋及致幻作用,其逐渐成为娱乐场所滥用的新型毒品[2]。氯胺酮滥用患者多出现明显的泌尿系统损害,临床表现为尿频、尿急、血尿及膀胱区疼痛等,称为氯胺酮相关性膀胱炎(KC)[3]。目前针对KC的治疗药主要包括抗胆碱药物、非甾体类及甾体类抗炎药物,但部分患者药物疗效不佳[4]。多项研究发现,氯胺酮能够通过多种通路增强氧化应激反应,从而导致膀胱炎症的发生。在氯胺酮诱导的KC大鼠模型中,可见膀胱组织环氧化酶-2(COX-2)、一氧化氮合酶(iNOS)和内皮细胞一氧化氮合酶(eNOS)的表达上调,这些氧化应激酶的增加可能在KC发展中起到重要作用[5]。氯胺酮还可引起核因子κB(NF-κB)向核内易位,从而激活COX-2,导致大鼠膀胱炎症[6]。另有研究发现[7],氯胺酮可升高线粒体和内质网介导的氧化应激酶活性,从而导致溃疡性膀胱炎和膀胱细胞凋亡。中医认为KC归属为“淋症”范畴,治以清热利湿、活血祛瘀、通淋止痛为主。芍药甘草汤有养血敛阴,缓急止痛之效,为临床治疗石淋绞痛的常用方。现代药理学研究证明[8],其具有抗氧化、镇痛止痉及抗炎等作用,对尿路感染及尿路结石患者具有较好的疗效。本研究观察芍药甘草汤灌肠对KC模型大鼠的治疗作用,并通过NF-κB/COX-2/Nrf2通路探讨其抑制氧化应激及炎症反应,改善膀胱功能,减轻膀胱组织损伤的作用机制。
1 材料与方法 1.1 实验动物雄性SD大鼠共40只,SPF级,体质量(200±20)g,饲养于室温18~25 ℃,相对湿度45%~55%环境中,实验前适应性饲养1周。
1.2 药物与试剂盐酸氯胺酮注射液(2 mL∶0.1 g)购自武汉久安药业有限公司,批号:19011015。左氧氟沙星胶囊(100 mg/片)购自安徽三精万森制药有限公司,批号:181229。芍药甘草汤处方为:白芍30 g,生甘草10 g,由中山市中医院门诊部药房提供实验用生药,经广州中医药大学张丹雁教授鉴定,分别为毛茛科芍药属植物芍药(Paeonia lactiflora Pall.)的干燥根及豆科甘草属植物甘草(Glycyrrhiza uralensis Fisch.)的干燥根及根茎。药材参照《中国药典》2015年版现行标准,经薄层色谱法鉴别,甘草以乙酸乙酯-甲酸-冰醋酸-水(15∶1∶1∶2)为展开剂,甘草酸单铵盐(质量分数98.0%)为对照品;白芍以三氯甲烷-乙酸乙酯-甲醇-甲酸(40∶5∶10∶0.2)为展开剂,芍药苷(质量分数98.8%)为对照品,结果均具有鉴别特征,符合国家标准,可以入药。实验前将药材加水煎煮浓缩,贮存于4 ℃冰箱备用。苏木精-伊红(HE)染色试剂盒购自上海生工生物工程有限公司;IL-6、IL-8、肿瘤坏死因子-α(TNF-α)酶联免疫吸附法(ELISA法)检测试剂盒购自上海酶科生物科技有限公司;总蛋白提取试剂盒购自美国Sigama公司,Anti-NF-κB p65、Anti-COX-2、Anti-Nrf2、Anti-β-actin购自美国R & D公司,TransAMTM NF-κB p65、Nrf2活性检测试剂盒购自Active Motif公司。
1.3 实验方法 1.3.1 实验动物分组与给药将40只SD大鼠随机分为4组:空白组、模型组、左氧氟沙星组、芍药甘草汤组,每组10只。以左氧氟沙星为阳性对照组,模型组、左氧氟沙星组及芍药甘草汤组采用氯胺酮(30 mg/kg)腹腔注射制备KC模型,每日1次,持续12周。造模停药3 d后,胶体金法检测大鼠尿液标本中氯胺酮浓度,质控区(C)检测线处出现红色条带,而测试区(T)未出现紫红色条带为阳性,证实造模成功。模型制备成功后,芍药甘草汤组按生药量3.6 g/kg保留灌肠,药液临用前用生理盐水稀释至终浓度为0.72 g/mL,加热至30 ℃,采用2 mL注射器连接小儿导尿管缓慢推入。左氧氟沙星组给予40 mg/kg灌肠,正常组给予生理盐水灌肠,给药体积均按5 mL/kg计,每日1次,持续4周。
1.3.2 膀胱尿流动力学检测各组大鼠腹腔注射水合氯醛(200 mg/kg)麻醉,固定大鼠四肢,行耻骨上缘纵向切口,以直径1 mm的硬膜外导管经尿道插入膀胱,导管连接三通管,三通管与微量灌注泵相连,用生理盐水以0.2 mL/min速率灌注,另一端连接尿动力检测仪的压力换能器,记录大鼠膀胱残余尿量、膀胱最大容量、最大膀胱内压及膀胱顺应性变化,膀胱顺应性=膀胱最大容量/最大膀胱内压。
1.3.3 疼痛阈值检测参照文献[9]方法,将大鼠单独放置于有金属网格的透明塑料测试笼,适应30 min后,分别以1.0、2.0、4.0、8.0、15.0、20.0 g的纤维细丝依次刺激大鼠肛门与尿道口之间区域,每根纤维刺激10次,每次持续1~2 s,大鼠出现弓背、跳跃,舔咬下腹部等动作为有反应,将反应次数大于5次的纤维力度定为大鼠的疼痛阈值。
1.3.4 HE染色观察膀胱组织病理学变化取部分膀胱组织于4%多聚甲醛中固定,脱水、透明后石蜡包埋,作5 μm厚切片,再经烤片、脱蜡至水、HE染色、70%盐酸乙醇分化、脱水透明、中性树胶封片等操作后完成制片,光学显微镜下观察膀胱组织的形态学变化。
1.3.5 血清中炎性因子含量检测大鼠眼球取血,离心后取血清于-20 ℃冰箱保存待测。血清常温下放置1 h后3 000 r/min离心15 min,离心半径13.5 cm,加入样品稀释剂40 μL,抗体100 μL,血清10 μL,置于37℃孵育1 h,洗涤液清洗5次,加入显色液100 μL,37 ℃避光孵育15 min,加入终止液50 μL,于酶标仪450 nm下检测各反应孔OD值,绘制标准曲线,计算血清中白介素-1β(IL-1β)、白介素-6(IL-6)及TNF-α的含量。
1.3.6 膀胱组织中NF-κB p65、COX-2、Nrf2蛋白表达检测取大鼠膀胱组织100~200 mg,剪碎后置于裂解液中,使用组织匀浆器冰上匀浆,4 ℃离心机12 000 r/min离心20 min,离心半径8 cm,提取总蛋白,BCA法测定蛋白浓度。进行制胶、上样、电泳、转膜和封闭后,一抗4 ℃孵育过夜,TBST洗膜,辣根过氧化物酶(HRP)标记的二抗37 ℃孵育1 h,TBST洗膜。ECL发光液孵育后,凝胶成像分析系统曝光图像,计算目标蛋白与相应内参的光密度比值,分析NF-κB p65、核因子E2相关因子2(Nrf2)、环氧化酶-2(COX-2)的蛋白含量。
1.3.7 膀胱组织中NF-κB p65、Nrf2的活性检测将蛋白提取液A和B分别加入蛋白酶抑制剂混匀备用,大鼠膀胱组织解冻后,取100~200 mg加入预冷磷酸盐缓冲液(PBS)匀浆,4 ℃离心机离心5 min,离心半径8 cm,后弃上清液,加入蛋白提取液A,高速涡旋震荡,PBS洗涤后离心弃上清液,加入蛋白提取液B,高速涡旋震荡,离心后吸取上清液即得到核蛋白。采用BCA法测定核蛋白浓度,参照Trans AMTM检测试剂盒说明书测定膀胱组织NF-κB p65、Nrf2的DNA活性:分别设置空白孔、样本孔、特异性结合孔、非特异性竞争孔和阳性对照孔,按操作步骤加入反应试剂,于450 nm下测定各孔OD值,根据标准曲线计算NF-κB p65、Nrf2相对结合活性。
1.4 统计学方法采用SPSS 24.0统计软件进行分析,实验数据以均值±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法。P<0. 05为差异有统计学意义。
2 结果 2.1 膀胱尿动力学检测结果模型组大鼠膀胱最大容量、残余尿量及膀胱顺应性较空白组显著增加,最大膀胱内压显著降低,差异有统计学意义(P<0.05)。左氧氟沙星组及芍药甘草汤组大鼠膀胱最大容量、残余尿量及膀胱顺应性均低于模型组,最大膀胱内压均高于模型组,差异有统计学意义(P<0.05)。见表 1。
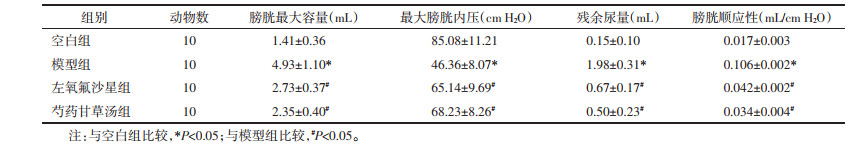
模型组大鼠与空白组大鼠比较,疼痛阈值明显降低,差异有统计学意义(P<0.05)。左氧氟沙星组及芍药甘草汤组大鼠与模型组相比,疼痛阈值明显升高,差异有统计学意义(P<0.05)。见表 2。
光镜下可见,空白组大鼠膀胱平滑肌肌束排列有序,肌束间结构紧密,膀胱组织未见异常变化。模型组大鼠与空白组相比,膀胱平滑肌明显增生肥大,固有层充血、水肿,可见大量炎性细胞浸润。左氧氟沙星组及芍药甘草汤组大鼠膀胱组织损伤较模型组减轻,平滑肌增生肥大明显减轻,固有层可见少量炎性细胞浸润,膀胱炎症减轻。见图 1。
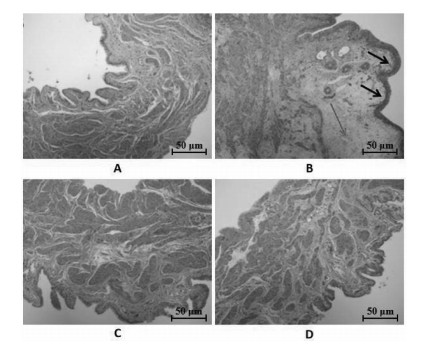
|
| 注:A.空白组;B.模型组;C.左氧氟沙星组;D.芍药甘草汤组。 图 1 各组大鼠膀胱组织病理形态学改变(HE,×200) Fig. 1 Histopathological changes of bladder of rats(HE, ×200) |
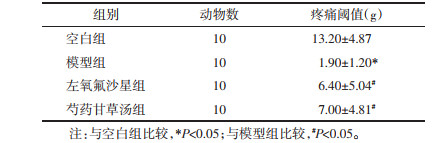
模型组大鼠血清中IL-1β、IL-6、TNF-α的含量较空白组明显升高,差异有统计学意义(P<0.05)。左氧氟沙星组及芍药甘草汤组大鼠与模型组比较,IL-1β、IL-6、TNF-α的含量有所降低,差异有统计学意义(P<0.05)。见表 3。
模型组大鼠膀胱组织中NF-κB p65、COX-2的蛋白表达显著升高,而Nrf2的表达明显降低,差异有统计学意义(P<0.05)。与模型组比较,左氧氟沙星组及芍药甘草汤组大鼠膀胱组织中NF-κB p65、COX-2的蛋白表达均明显降低,Nrf2的表达显著增加,差异有统计学意义(P<0.05)。见图 2。
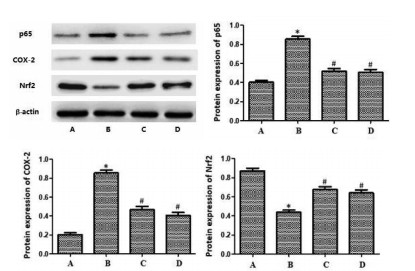
|
| 注:A.空白组;B.模型组;C.左氧氟沙星组;D.芍药甘草汤组。 图 2 各组大鼠膀胱组织中NF-κB p65、COX-2、Nrf2的表达 Fig. 2 Expression of NF-κB p65, COX-2, Nrf2 in bladder tissue of rats in each group |
模型组膀胱组织核蛋白中NF-κB p65的DNA结合活性显著升高,Nrf2的结合活性明显降低(P<0.05)。与模型组比较,左氧氟沙星及芍药甘草汤明显降低了NF-κB p65的DNA结合活性,升高了Nrf2的结合活性(P<0.05)。见表 4。
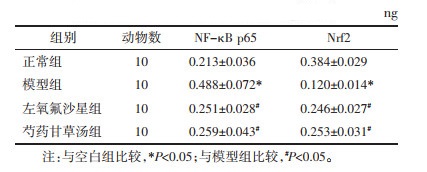
|
氯胺酮具有麻醉、镇痛效用,常作为麻醉药物用于临床外科手术中,还可用于顽固性癌性疼痛的止痛治疗[1]。由于氯胺酮的中枢神经兴奋及致幻作用,使其成为娱乐场所滥用的新型毒品之一,俗称“K粉”。长期吸食氯胺酮会造成神经系统、心血管系统、泌尿系统等多系统组织器官的毒性损害[2]。近年来,氯胺酮相关性泌尿系统损害逐渐受到国内外学者的关注,尤其对KC的研究逐渐增多。KC临床表现为尿频、尿急、血尿及膀胱区疼痛等症状,目前的治疗方法以戒断氯胺酮为主,配合抗胆碱药物、非甾体类及甾体类抗炎药物,但仍有部分患者药物疗效不佳[3-4]。中医将KC归属为“淋症”范畴,症见小便短赤频数,淋沥刺痛,少腹拘急,或痛引腰腹,治以清热利湿,通淋止痛为主。芍药甘草汤最早记载于张仲景《伤寒论》,由白芍、甘草两味药组成。芍药性酸寒,具有敛阴养血之效,甘草性甘温,有缓急止痛之功,两者配伍可用于治疗肝脾不和,脘腹疼痛,及筋脉失养,腿脚挛急等症。后世医家用其治疗石淋绞痛,发现止痛效果突出[10]。现代药理学研究证实本方具有明显的抗氧化、镇痛止痉及抗炎等作用[6],方中有效成分芍药苷能显著抑制TNF-α的表达,减少炎症细胞浸润,从而缓解炎性疼痛[11]。甘草酸能够降低炎性细胞因子IL-6、IL-10的水平,提高抗氧化能力,缓解炎症症状[12]。
KC发生的确切机制尚不清楚,目前发现的可能机制主要有膀胱黏膜毒性损伤、自身免疫反应及氧化应激等[13-15]。氧化应激相关酶COX-2可能在KC的发生过程中具有重要作用[16]。COX-2能够催化花生四烯酸转化为前列腺素,进而诱导炎症反应发生[17]。研究发现[18],氯胺酮能够促进膀胱组织中COX-2的表达,其表达的增加可能是通过NF-κB通路实现的。NF-κB是炎症过程中炎症介质的重要转录因子,与IL-6、TNF-α等多种促炎细胞因子的表达密切相关[19]。Nrf2则是调控抗氧化基因的重要调节因子,能够抑制氧化应激和NF-κB激活对炎症反应起到保护作用[20]。由此可见,NF-κB/COX-2/Nrf2通路在机体炎症反应过程中起着重要作用。
中药保留灌肠是一种中医外治疗法,能够使药物通过直肠静脉丛迅速吸收,并可经门静脉进入体循环,达到整体治疗的效果,与口服给药相比具有药物利用率高,不良反应少的优势[21]。本研究在前期临床试验中采用芍药甘草汤灌肠结合常规治疗方案,发现对KC患者效果显著,患者经治疗后临床症状明显减轻[22]。在此基础上,本研究通过腹腔注射氯胺酮建立大鼠KC模型,探讨芍药甘草汤灌肠治疗对KC的作用机制。实验结果显示,芍药甘草汤灌肠能够降低膀胱最大容量、残余尿量及膀胱顺应性,升高最大膀胱内压,并提高大鼠疼痛阈值,提示其能改善大鼠下尿路功能,减轻膀胱区及尿道疼痛。病理学结果显示,芍药甘草汤治疗后大鼠膀胱组织损伤明显改善,炎性细胞浸润减少,同时,芍药甘草汤能够有效降低IL-1β、TNF-α、IL-6炎症因子水平,降低膀胱组织中NF-κB p65、COX-2的蛋白表达上调Nrf2的表达。模型组大鼠膀胱组织NF-κB p65 DNA结合活性较空白组显著增高,Nrf2结合活性明显降低,提示氯胺酮通过激活NF-κB通路,促进了大鼠膀胱组织氧化应激的发生。芍药甘草汤治疗降低了NF-κB p65的脱氧核糖核酸结合活性,使Nrf2的结合活性增高,表明芍药甘草汤能够通过激活Nrf2增强大鼠抗氧化能力,抑制NF-κB介导的氧化应激及其诱导的炎症反应,从而起到对KC的治疗作用。
| [1] |
曹帅, 王韵. 氯胺酮的临床作用与机制研究进展[J]. 科学通报, 2017, 62(1): 9-15. CAO S, WANG Y. Research progress on clinical effect and mechanism of ketamine[J]. Chinese Science Bulletin, 2017, 62(1): 9-15. |
| [2] |
彭澎. 氯胺酮成瘾者成瘾过程和滥用危害的调查[J]. 中国医药指南, 2018, 16(22): 297-298. PENG P. Investigation on the addiction process and abuse harm of ketamine addicts[J]. Guide of China Medicine, 2018, 16(22): 297-298. |
| [3] |
陈志健. 氯胺酮相关性膀胱炎临床研究新进展[J]. 中外医学研究, 2018, 16(4): 182-183. CHEN Z J. New progress in clinical research of ketamine associated cystitis[J]. Chinese and Foreign Medical Research, 2018, 16(4): 182-183. |
| [4] |
谭伟明, 米华. 氯胺酮相关性膀胱炎发生机制的研究进展[J]. 广东医学, 2016, 37(8): 1243-1245. TAN W M, MI H. Research progress on pathogenesis of ketamine associated cystitis[J]. Guangdong Medical Journal, 2016, 37(8): 1243-1245. |
| [5] |
CHUANG S M, LIU K M, LI Y L, et al. Dual involvements of cyclooxygenase and nitric oxide synthase expressions in ketamine-induced ulcerative cystitis in rat bladder[J]. Neurourol Urodyn, 2013, 32(8): 1137-1143. DOI:10.1002/nau.22367 |
| [6] |
YUNG S J, YI L L, CHENG Y L, et al. Translocation of NF-κB and expression of cyclooxygenase-2 are enhanced by ketamine-induced ulcerative cystitis in rat bladder[J]. American Journal of Pathology, 2015, 185(8): 2269-2285. DOI:10.1016/j.ajpath.2015.04.020 |
| [7] |
LIU K M, CHUANG S M, YU L C, et al. Ketamine-induced ulcerative cystitis and bladder apoptosis involve oxidative stress mediated by mitochondria and the endoplasmic reticulum[J]. Am J Physiol Renal Physiol, 2015, 309(4): F318-331. DOI:10.1152/ajprenal.00607.2014 |
| [8] |
朱广伟, 张贵君, 汪萌, 等. 中药芍药甘草汤基原及药效组分和药理作用研究概况[J]. 中华中医药杂志, 2015, 30(8): 2865-2869. ZHU G W, ZHANG G J, WANG M, et al. Research situation about origin, active components alignment and phramacological actions of Shaoyao Gancao Decoction[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2015, 30(8): 2865-2869. |
| [9] |
ASFAHA S, CENAC N, HOULE S, et al. Protease-activated receptor-4:a novel mechanism of inflammatory pain modulation[J]. British Journal of Pharmacology, 2007, 150(2): 176-185. DOI:10.1038/sj.bjp.0706975 |
| [10] |
刘淼, 庞立健, 吕晓东. 芍药甘草汤临证理论再探讨[J]. 中医药通报, 2018, 17(5): 10-13. LIU M, PANG L J, LYU X D. Further discussion on clinical theory of Shaoyao Gancao Decoction[J]. Traditional Chinese Medicine Journal, 2018, 17(5): 10-13. |
| [11] |
冯伟科, 郭平. 芍药苷药理作用研究进展[J]. 山东中医杂志, 2019, 38(1): 105-108. FENG W K, GUO P. Research progress on pharmacological action of paeoniflorin[J]. Shandong Journal of Traditional Chinese Medicine, 2019, 38(1): 105-108. |
| [12] |
李想, 李冀. 甘草提取物活性成分药理作用研究进展[J]. 江苏中医药, 2019, 51(5): 81-86. LI X, LI J. Research progress on pharmacological action of active components of licorice extract[J]. Jiangsu Journal of Traditional Chinese Medicine, 2019, 51(5): 81-86. DOI:10.3969/j.issn.1672-397X.2019.05.029 |
| [13] |
许宁, 吴志辉, 瞿根义. 氯胺酮相关泌尿系统损害研究现状[J]. 现代泌尿外科杂志, 2017, 22(2): 152-156. XU N, WU Z H, QU G Y. Research status of ketamine related urinary system damage[J]. Journal of Modern Urology, 2017, 22(2): 152-156. DOI:10.3969/j.issn.1009-8291.2017.02.018 |
| [14] |
袁源, 李晓东, 王乾兴. 氯胺酮诱导中枢神经/泌尿系统损伤的中药治疗机制研究进展[J]. 遵义医科大学学报, 2020, 43(3): 412-418. YUAN Y, LI X D, WANG Q X. Research progress of traditional Chinese medicine treatment mechanism of ketamine induced central nervous/urinary system injury[J]. Journal of Zunyi Medical University, 2020, 43(3): 412-418. |
| [15] |
谭伟明, 米华. 褪黑素对氯胺酮相关性大鼠膀胱损伤的保护作用[J]. 中国现代医药杂志, 2016, 18(3): 13-16. TAN W M, MI H. Role of melatonin in protecting ketamine related rat bladder injury[J]. Modern Medicine Journal of China, 2016, 18(3): 13-16. DOI:10.3969/j.issn.1672-9463.2016.03.003 |
| [16] |
贺飞, 杨青山, 陈宋林, 等. 滥用氯胺酮导致膀胱功能障碍患者膀胱组织中COX-2的表达及意义[J]. 国际泌尿系统杂志, 2018, 38(5): 776-778. HE F, YANG Q S, CHEN S L, et al. Expression of COX-2 in ketamine induced bladder dysfunction and its clinical significance[J]. International Journal of Urology and Nephrology, 2018, 38(5): 776-778. DOI:10.3760/cma.j.issn.1673-4416.2018.05.020 |
| [17] |
谢翔, 应炜阳, 金胜威. COX-2在炎症消退中的研究进展[J]. 生命的化学, 2016, 36(4): 461-464. XIE X, YING W Y, JIN S W. Research progress of COX-2 in the regression of inflammation[J]. Chemistry of life, 2016, 36(4): 461-464. |
| [18] |
卢勇, 谭伟明, 牛得草, 等. 褪黑素对氯胺酮所致大鼠膀胱氧化应激损伤的保护作用[J]. 右江民族医学院学报, 2018, 40(1): 13-15. LU Y, TAN W M, NIU D C, et al. Protective effects of melatonin on oxidative stress injury induced by ketamine in rat bladder[J]. Journal of Youjiang Medical University for Nationalities, 2018, 40(1): 13-15. DOI:10.3969/j.issn.1001-5817.2018.01.004 |
| [19] |
孙伟东, 张志强, 朴大勋. NF-κB信号通路抑制结肠炎及炎症相关结肠癌的研究[J]. 医学综述, 2020, 26(8): 1521-1525. SUN W D, ZHANG Z Q, PIAO D X. Research progress of NF-κB signaling pathway inhibition on colitis and inflammation-associated colon cancer[J]. Medical Recapitulate, 2020, 26(8): 1521-1525. DOI:10.3969/j.issn.1006-2084.2020.08.013 |
| [20] |
周秋丽, 周燕. Nrf2/ARE信号通路在氧化应激性疾病的作用研究进展[J]. 世界最新医学信息文摘, 2020, 20(26): 104-105. ZHOU Q L, ZHOU Y. The research progress of Nrf2/ARE signaling pathway in oxidative stress diseases[J]. World Latest Medicine Information, 2020, 20(26): 104-105. DOI:10.3969/j.issn.1671-3141.2020.26.046 |
| [21] |
徐菊, 陆梅, 蒋丽娜, 等. 浅谈中药保留灌肠疗法的临床应用现状[J]. 影像研究与医学应用, 2017, 1(11): 7-8. XU J, LU M, JIANG L N, et al. A brief discussion on the clinical application of TCM retention enema therapy[J]. Journal of Imaging Research and Medical Applications, 2017, 1(11): 7-8. DOI:10.3969/j.issn.2096-3807.2017.11.004 |
| [22] |
郑东翔, 钟喨, 黄智峰, 等. 芍药甘草汤灌肠治疗氯胺酮相关性膀胱炎的临床研究[J]. 中国实用医药, 2021, 16(7): 186-188. ZHENG D X, ZHONG L, HUANG Z F, et al. Clinical study of Shaoyao Gancao Decoction enema in the treatment of ketamine associated cystitis[J]. China Practical Medicine, 2021, 16(7): 186-188. |
 2021, Vol. 38
2021, Vol. 38