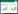文章信息
- 范栢爽, 吴梓君, 刘世豪, 李思勤, 王丽莉, 何新
- FAN Baishuang, WU Zijun, LIU Shihao, LI Siqin, WANG Lili, HE Xin
- 黄芩素衍生物对大鼠急性肝性脑病模型的干预
- Study on the intervention effect of baicalein derivative on acute hepatic encephalopathy in rats
- 天津中医药, 2021, 38(11): 1456-1462
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(11): 1456-1462
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.11.20
-
文章历史
- 收稿日期: 2021-07-21
2. 中国医学科学院/北京协和医学院药物研究所, 天然药物活性物质与功能国家重点实验室, 北京 100050;
3. 广东药科大学, 广州 510006
肝性脑病又称肝昏迷,是由肝功能严重障碍和/或门静脉—体循环分流异常引起的脑功能障碍,表现为一系列从亚临床改变到昏迷程度不等的神经精神异常综合征,包括认知功能、情绪、行为和运动功能的异常改变[1-2]。临床上主要分为A、B、C 3型,其中A型是由于急性肝衰竭导致的肝性脑病,其特点为起病急、病程长、病死率高达80%[3]。目前肝性脑病的治疗主要为去除诱因、脱氨、人工肝及肝移植,已取得较好的治疗效果[4],但各有其局限性,因此探索新的预防及治疗方法有重要的现实意义。
黄芩素,是从中药黄芩Scutellaria baicalensis Georgi的干燥根分离出来的黄酮类单体化合物,是黄芩中最主要的活性成分之一,也是主要的药效物质基础[5-6]。现代研究表明黄芩素具有许多药理活性,如抗病毒、抗菌、清除自由基、抗过敏、治疗癌症等[7]。此外,黄芩素还具有较好的保肝和神经保护作用,有研究显示黄芩素对四氯化碳(CCl4)、药物等诱导的许多急慢性肝炎、肝纤维化和肝癌有良好的防治作用,对神经毒性有较强的神经保护作用[8-9]。但由于其生物利用度低、水溶性差,限制了其临床应用[10]。有报道,对黄芩素进行磺酸化改造后,应用到CCl4诱导的小鼠急性肝损伤实验中,结果与黄芩素相比,磺酸化黄芩素有更好的保肝效果,且增加其体内吸收量[11]。A型肝性脑病模型有多种,在药物诱导方法中,硫代乙酰胺(TAA)诱导的动物模型,具有可重复性、易观察分期、成功率高、与人类肝性脑病相似度高等优点[12]。故本研究采用TAA法诱导大鼠急性肝性脑病模型,探讨黄芩素衍生物二磺酸基黄芩素(DB)对急性肝性脑病大鼠的干预作用及其可能的作用机制,以期为肝性脑病的治疗提供实验依据。
1 材料 1.1 动物SPF级Wistar雄性大鼠,72只,体质量220~240 g,购买于北京维通利华实验动物技术有限公司,许可证号[SCXK(京)2016-0006],动物批号1100112011037688,于中国医学科学院放射医学研究所饲养,动物实验室许可证号SYXK(津)2018-0008。饲养条件:温度20~25 ℃,湿度40%~60%,每日光照12 h,自由摄食饮水,均用标准饲料。所有大鼠适应性饲养1周后进行实验。所有实验符合天津中医药大学动物实验伦理学规定。
1.2 实验药物与试剂DB(实验室自制,经核磁测定纯度高于98%[13]);硫代乙酰胺(上海生工生物工程股份有限公司,批号F514BA0026);乳果糖口服溶液(北京韩美药品有限公司,批号20050006);γ-氨基丁酸(GABA)试剂盒(美国MyBiosource公司,批号36361656);谷氨酸(Glu)试剂盒(美国MyBiosource公司,批号20200929C);肿瘤坏死因子-α(TNF-α)试剂盒(美国R&D Systems公司,批号P219559);白介素-6(IL-6)试剂盒(武汉华美生物工程有限公司,批号X23014810);BCA试剂盒(北京索莱宝科技有限公司,批号20200817);β-肌动蛋白/β-Actin(内参)抗体,羊抗兔IgG二抗(北京博奥森生物技术有限公司,批号分别为AG07197903、BJ05217694);磷脂酰肌醇3激酶(PI3K)抗体(万类生物科技有限公司,批号I05182196);磷酸化蛋白激酶B(p-AKT)抗体(美国Cell Signaling Technology公司,批号23)。
1.3 主要仪器DB001 Morris水迷宫视频分析系统,北京智鼠多宝生物科技有限责任公司;NX10N快速血氨测定仪,日本Fujifilm公司;7020型全自动生化分析仪,日本Hitach公司;Microfuge-22R型高速离心机,美国Beckman公司;AX205型十万分之一天平,瑞士Mettler Toledo公司;GL-88B涡旋混合器,海门市其林贝尔仪器制造有限公司;PowerPac型电泳仪,美国Bio-Rad公司;VILBER Fusion FX5凝胶成像仪,北京五洲东方科技发展有限公司;FE28型FiveEasy Plus台式pH计,上海屹利科学仪器有限公司。
2 方法 2.1 分组、造模及给药大鼠适应性饲养1周后,随机分为6组,每组12只,分别为对照组,模型组,DB低、中、高剂量(6.25、25、100 mg/kg,给药剂量为前期的预实验结果)组和阳性药(乳果糖,6 g/kg)组。DB组和阳性药组每天灌胃给药1次,连续给药7 d,对照组和模型组均灌胃等体积生理盐水。于给药第6天开始造模,除对照组外,各组大鼠均腹腔注射硫代乙酰胺(TAA,300 mg/kg[14])1次,连续2 d,对照组腹腔注射等体积生理盐水。造模期间,为防止大鼠发生电解质紊乱等并发症,从首次腹腔注射TAA后,每12 h皮下注射3 mL 10%葡萄糖、2 mL生理盐水和20 μmol氯化钾的等量混合液。末次腹腔注射TAA后将全部大鼠禁食12 h,次日以10%水合氯醛麻醉,腹主动脉采血,于冰上迅速取肝、脑组织。
2.2 指标检测 2.2.1 大鼠一般状态、分期评分及死亡率观察各组大鼠在造模前后精神状态、毛色、活动、死亡情况并记录。根据大鼠肝性脑病诊断标准[15],若大鼠出现嗜睡、反应迟缓,自主活动减少、共济失调、昏迷等症状之一,则可诊断为肝性脑病,并根据Zimmermann法[15]对大鼠肝性脑病分级进行评分,见表 1。
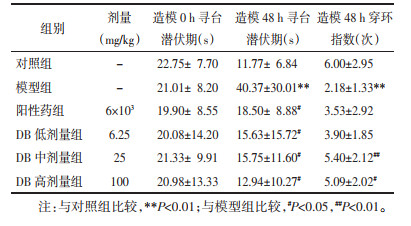
将水注入直径130 cm、高50 cm的圆形黑色内壁水池中,水深25 cm、水温(25±1)℃,水下1.5 cm处放置黑色平台(8 cm×8 cm),池壁上贴有不同颜色的4个数字:1、2、3、4,它们将水池平分为4个象限。测试前1 d将所有大鼠放入水池中自由游泳90 s。随后将所有大鼠每天训练4次,每次90 s,共训练5 d,将大鼠头朝向池壁依次从4个象限入水,当90 s已到或大鼠已找到平台,停止录像,并让大鼠在平台上休息20 s,记录大鼠寻找并爬上平台的时间(寻台潜伏期),未找到平台的大鼠记为90 s。于第6天,记录大鼠寻台潜伏期和撤掉平台后90 s内穿越原平台位置的次数(即穿环指数)。
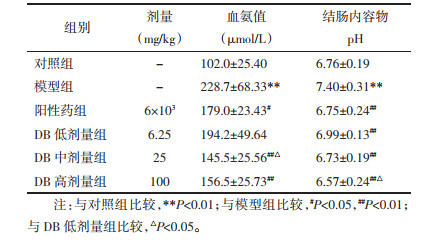
2.2.3 血氨和结肠内容物pH测定末次腹腔注射TAA 24 h后进行取眼眶血,应用快速血氨测定仪检测大鼠全血中氨的含量。取大鼠回盲肠后端结肠大约10 cm,采用pH计法检测结肠内容物pH值。
2.2.4 血清及肝生化指标测定采用全自动生化仪检测血清中天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、总胆红素(TBiL)的浓度。通过酶联免疫吸附实验(ELISA)检测血清中TNF-α和IL-6水平。
2.2.5 肝组织病理检查剪取肝组织左叶,置于4% 多聚甲醛中固定,脱水、包埋和切片,进行苏木精-伊红(HE)染色,在光学显微镜下(×100)观察肝脏病理变化。
2.2.6 神经递质含量检测称取大鼠前额叶皮质组织,制成10% 的匀浆,按照试剂盒说明书测定前额叶皮质中GABA和谷氨酸含量。
2.2.7 蛋白免疫印迹法检测大鼠前额叶皮质中PI3K,p-AKT蛋白的表达取各组大鼠前额叶皮质组织,加入细胞裂解液,裂解后离心取上清液,采用BCA定量试剂盒法进行蛋白测定。然后进行SDS凝胶电泳,转膜、封闭、一抗孵育4 ℃过夜,二抗室温孵育1 h后使用化学发光剂曝光,应用Image-Pro Plus 6.0软件进行结果计算。
2.3 统计学方法应用GraphPad Prism 5.01统计软件进行统计学分析,结果用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,采用Tukey法进行组间两两比较。P < 0.05为差异有统计学意义。
3 结果 3.1 对大鼠一般状态、分期评分及死亡率的影响对照组大鼠活动无异常,神经反射灵敏。模型组大鼠首次腹腔注射TAA 24 h后,出现食欲下降,行动减缓,皮毛疏松;第2次腹腔注射TAA 24 h后,大鼠体毛明显变黄,呼吸频率加快,步态不稳,共济失调,甚至昏迷。各给药组大鼠活动减少、行动迟缓、昏迷等情况较模型组有改善。与模型组相比,DB低、中、高剂量组均可显著改善肝性脑病大鼠分级评分(P<0.01),且可显著降低死亡率。见表 2。
比较各组大鼠在造模0 h寻台潜伏期,差异无统计学意义(P > 0.05),说明组间具有可比性。末次腹腔注射TAA 24 h后,发现与模型组相比,DB低、中、高剂量组均能明显降低大鼠寻台潜伏期(P<0.05);DB中、高剂量组能明显增加穿环指数(P<0.01或P < 0.05)。可以推测DB可改善肝性脑病大鼠的学习和记忆能力,见表 3。
|
与对照组相比,模型组大鼠血氨和结肠内容物pH水平均显著升高(P<0.01),说明TAA成功诱导大鼠急性肝性脑病。与模型组相比,DB中、高剂量组和阳性药组均能明显降低大鼠血氨水平(P<0.01或P<0.05);低、中、高剂量组和阳性药组均能明显降低大鼠结肠内容物pH值(P<0.01)。结果表明DB能降低大鼠体内氨的含量,具有改善肝性脑病作用。见表 4。
|
与对照组相比,模型组大鼠血清中ALT、AST、TBiL、ALP水平均显著升高(P<0.01),说明TAA诱导的急性肝性脑病模型大鼠出现严重肝脏损伤。与模型组相比,阳性药组可显著降低ALT、AST、TBiL水平(P<0.05或P<0.01)。DB中、高剂量组显著降低ALT、AST、TBiL、ALP水平(P<0.05或P<0.01);低剂量组可显著降低ALT、TBiL水平(P<0.01)。表明DB有较好的保护肝细胞、改善肝功能作用。与对照组相比,模型组大鼠血清中TNF-α和IL-6水平显著提高(P<0.01或P<0.05)。与模型组相比,DB中、高剂量组能显著降低TNF-α水平(P<0.01);DB低、中、高剂量组均能显著降低IL-6水平(P<0.05或P<0.01)。结果说明DB可通过抑制促炎细胞因子的表达来发挥对肝性脑病的干预作用。见表 5。
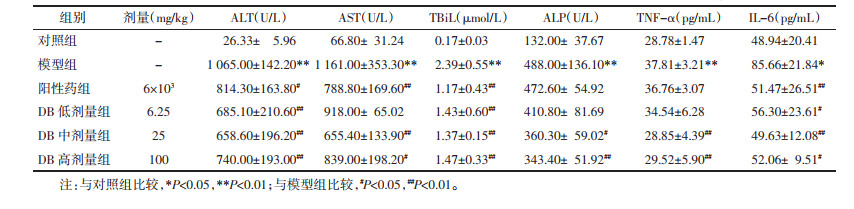
|
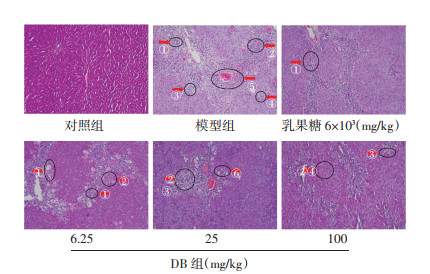
光学显微镜下观察各组大鼠肝织病理切片,结果见图 1。对照组大鼠肝小叶结构完整,未见肝细胞变性坏死,肝细胞排列整齐,肝索以中央静脉为中心呈放射状排列。模型组大鼠肝细胞水样变性明显,可见明显的肝细胞溶解、坏死,以小叶中心性坏死为主,桥接坏死多见,坏死区可见中重度炎细胞浸润(混合细胞浸润,以淋巴细胞为主),坏死及坏死后纤维组织增生明显,发生纤维化,小叶结构失常。与模型组相比,阳性药组肝细胞坏死及炎细胞浸润稍减轻。DB低、高剂量组水样变性减轻,炎细胞浸润减轻,坏死后肝纤维化为主;DB中剂量组炎细胞浸润,坏死,肝纤维化较模型组减轻,坏死后纤维组织增生较明显,小叶结构尚正常。
|
| 注:①炎细胞浸润;②肝细胞纤维化;③肝细胞溶解、坏死;④肝细胞水样变性;⑤桥接坏死;⑥纤维组织增生。 图 1 DB对肝性脑病大鼠肝组织病理变化的影响(HE,×100) Fig. 1 Effect of DB on pathological changes of liver tissue in hepatic encephalopathy rats (HE, ×100) |
ELISA检测结果见表 6。与对照组相比,模型组大鼠前额叶皮质中GABA水平显著增加(P<0.01)。与模型组相比,DB低、中、高剂量组和阳性药组均能显著降低GABA水平(P<0.05或P<0.01)。与对照组相比,模型组大鼠前额叶皮质中Glu水平出现下降趋势,各给药组大鼠Glu水平较模型组有升高趋势,但差异无统计学意义(P > 0.05)。结果表明,DB可以通过调节大鼠前额叶皮质中GABA及Glu的含量来发挥对肝性脑病的干预作用。
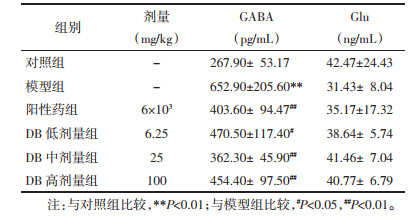
|
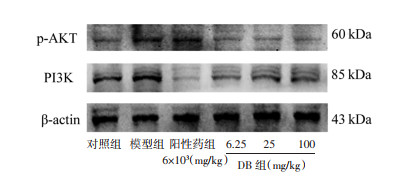
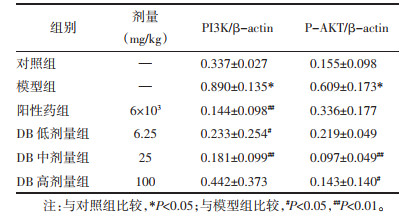
为进一步探讨DB的作用机制,利用Western blot技术对与肝性脑病相关的关键蛋白进行分析。与对照组相比,模型组大鼠前额叶皮质中PI3K和p-AKT蛋白水平显著升高(P<0.05);与模型组相比,DB低、中剂量组可显著降低PI3K蛋白水平(P<0.01或P<0.05);DB中、高剂量组可显著降低p-AKT蛋白水平(P<0.05或P<0.01)。说明DB可以通过调控前额叶皮质中PI3K和p-AKT的蛋白表达来发挥对肝性脑病的干预作用。见图 2、表 7。
|
| 图 2 大鼠前额叶皮质中PI3K、p-AKT蛋白表达情况 Fig. 2 Expression of PI3K and p-AKT in the prefrontal cortex of rats |
|
本实验采用TAA诱导法建立急性肝性脑病大鼠模型,其机制为TAA被肝细胞内细胞色素P450氧化酶代谢,产生有毒的TAA- 硫氧化合物,进而引起脂质过氧化、肝脏代谢紊乱等损伤,导致炎细胞浸润、肝细胞坏死及肝纤维化等改变,最终引起急性肝功能衰竭诱发A型肝性脑病[16]。该模型的3个判断标准为大鼠行为学,血氨值和肝功能指标的变化[17]。本实验发现TAA造模后,模型组大鼠行为学、血氨、肝生化指标与对照组相比,均有显著性改变,说明急性肝性脑病大鼠模型造模成功。
临床上评价药物治疗肝性脑病的效果时,主要观察指标为患者的认知功能、血氨水平和肝功能指标。本实验选择Morris水迷宫实验,它是研究动物空间学习和记忆能力常用的模型工具[18],通过测定寻台潜伏期来评价大鼠的空间学习能力、测定穿环指数来评价大鼠的空间记忆能力。结果显示,TAA造模后,与空白组相比,模型组大鼠寻台潜伏期出现显著延长,穿环指数显著减少;预防性给予DB治疗后,中、高剂量组可显著降低寻台潜伏期,增加穿环指数,说明DB可以改善肝性脑病大鼠的学习和记忆能力。此实验选择血氨和结肠内容物pH值这两个指标来反映肝性脑病大鼠体内氨水平。结果显示,DB中、高剂量组可显著降低肝性脑病大鼠血氨水平,且低、中、高剂量组均可降低结肠内容pH值,推测其发挥作用的方式可能为DB酸化肠道后,导致肠道内细菌产氨减少,同时减少氨分子的吸收,促进血氨渗入肠道排出[19]。故DB可有效降低肝性脑病大鼠体内氨含量。本研究选择ALT、AST、ALP、TBiL作为肝功能检测指标,其中ALT和AST是血清肝生物标志物,是早期急性肝损伤的主要生化指标[20],ALP和TBiL在肝损伤或胆汁淤积时会出现升高[21]。实验结果显示,与对照组相比,模型组上述肝功指标出现显著升高,说明模型组大鼠肝损伤严重,DB中、高剂量组可显著降低上述4个指标,说明其有较好的保护肝细胞、改善肝功能作用。此外,由于急性肝性脑病有死亡率高的特点[3],故本研究考察了各组大鼠死亡情况,发现DB可以显著降低急性肝性脑病大鼠的死亡率,其原因与改善上述提及的指标有关。
炎症反应在肝性脑病的病理过程中发挥着重要作用,当肝脏损伤后,体内出现严重的炎症反应,大量的炎症介质与高血氨协同对大脑产生影响,其中TNF-α和IL-6能增加脑血管内皮细胞的通透性、破坏血脑屏障功能,从而引发中枢神经系统内的炎症反应。此实验结果显示,与模型组相比,DB中、高剂量组可显著降低血清中TNF-α和IL-6水平,说明DB可通过减少促炎细胞因子的表达来发挥对肝性脑病的干预作用。
神经递质异常在肝性脑病发病机制中的作用愈受关注,Jones[22]指出肝性脑病的发生是因为抑制性神经递质如GABA和兴奋性神经递质如谷氨酸功能失衡[23]。肝性脑病发生时,GABA入脑增多,影响肝性脑病大鼠学习、记忆[24]。Glu,作为兴奋性神经递质,对突触可塑性的维持、神经发育、神经元回路的形成和学习过程起重要作用[25]。本实验结果显示,DB能显著降低肝性脑病大鼠前额叶皮质中GABA含量,增加前额叶皮质中谷氨酸水平,表明DB可以通过调节大鼠前额叶皮质中GABA和谷氨酸含量,起到改善肝性脑病的作用。
为进一步研究DB对急性肝性脑病大鼠的干预作用机制,结合文献研究表明,黄芩素可通过调节PI3K/AKT通路来发挥神经保护作用[26-27]。本实验结果显示,模型组大鼠前额叶皮质中PI3K和pAKT蛋白表达较对照组显著上升,DB中剂量组可显著降低PI3K和pAKT蛋白表达,说明DB可能通过调节PI3K/Akt通路发挥神经保护作用,起到改善肝性脑病作用。
综上所述,DB能够改善TAA诱导的急性肝性脑病大鼠的学习记忆能力和肝功能,降低体内氨水平,抑制炎症因子表达,调节前额叶皮质中神经递质(GABA和谷氨酸)水平,其作用机制可能与调控PI3K/AKT信号通路有关。
| [1] |
VILSTRUP H, AMODIO P, BAJAJ J, et al. Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the American association for the study of liver diseases and the European association for the study of the liver[J]. Hepatology, 2014, 60(2): 715-735. DOI:10.1002/hep.27210 |
| [2] |
王峻瑶, 刘玉兰. 肝性脑病研究现状与展望[J]. 中华肝脏病杂志, 2014, 22(2): 81-83. WANG J Y, LIU Y L. Prospective study to assess the current state of hepatic encephalopathy in China[J]. Chinese Journal of Hepatology, 2014, 22(2): 81-83. DOI:10.3760/cma.j.issn.1007-3418.2014.02.001 |
| [3] |
WENDON J, MEMBERS P, CORDOBA J, et al. EASL clinical practical guidelines on the management of acute (fulminant) liver failure[J]. Journal of Hepatology, 2017, 66(5): 1047. DOI:10.1016/j.jhep.2016.12.003 |
| [4] |
黄云义, 张群, 时克, 等. 中医药治疗肝性脑病的研究进展[J]. 中国中西医结合杂志, 2020, 40(5): 638-640. HUANG Y Y, ZHANG Q, SHI K, et al. Progress of Chinese medicine and pharmacy in treating hepatic encephalopathy[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2020, 40(5): 638-640. |
| [5] |
单慧, 杜胤骁, 白鹤群, 等. 黄芩素的研发进展及其临床药理学[J]. 中国临床药理学与治疗学, 2020, 25(6): 701-704. SHAN H, DU Y X, BAI H Q, et al. Progress in the development of baicalein and its clinical pharmacology study[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2020, 25(6): 701-704. |
| [6] |
关皎, 朱鹤云, 王佳林, 等. UFLC法同时测定黄芩中4种活性成分的含量[J]. 中华中医药学刊, 2017, 35(7): 1864-1866. GUAN J, ZHU H Y, WANG J L, et al. UFLC simultaneous determination of four active components in scutellaria radix[J]. Chinese Archives of Traditional Chinese Medicine, 2017, 35(7): 1864-1866. |
| [7] |
张海丽, 游雷鸣, 刘慧, 等. 汉黄芩素对LPS和ATP联合诱导的巨噬细胞炎症反应的抑制作用[J]. 中国免疫学杂志, 2019, 35(9): 1059-1063. ZHANG H L, YOU L M, LIU H, et al. Wogonin-mediated inhibition of LPS and ATP-induced inflammation in mouse macrophages[J]. Chinese Journal of Immunology, 2019, 35(9): 1059-1063. DOI:10.3969/j.issn.1000-484X.2019.09.007 |
| [8] |
白庆云, 陶思敏, 田锦鸿, 等. 黄芩对肝病的防治作用及机制研究进展[J]. 中国中药杂志, 2020, 45(12): 2808-2816. BAI Q Y, TAO S M, TIAN J H, et al. Progress of research on effect and mechanism of scutellariae radix on preventing liver diseases[J]. China Journal of Chinese Materia Medica, 2020, 45(12): 2808-2816. |
| [9] |
刘骥飞, 苏刚, 高娟, 等. 黄芩素神经保护作用机制的研究进展[J]. 中国临床药理学杂志, 2019, 35(21): 2773-2776. LIU J F, SU G, GAO J, et al. Research advances on the neuroprotective effect of baicalein[J]. The Chinese Journal of Clinical Pharmacology, 2019, 35(21): 2773-2776. |
| [10] |
杜姣姣, 杨松霖, 赵丽娟, 等. 黄芩素、汉黄芩素与环糊精包合物的研究进展[J]. 化工管理, 2018, 31(22): 52-53. DU J J, YANG S L, ZHAO L J, et al. Progress on inclusion complexes of baicalein and wogonin with cyclodextrins[J]. Chemical Enterprise Management, 2018, 31(22): 52-53. DOI:10.3969/j.issn.1008-4800.2018.22.033 |
| [11] |
韩泳. 类黄酮及其磺化衍生物对小鼠肝损伤的保护作用研究[D]. 西安: 第四军医大学, 2013. HAN Y. The hepatoprotection study of flavonoids and its sulfonation on liver injury in mice[D]. Xi'an: Air Force Military Medical University, 2013. |
| [12] |
逄菲, 胡瑾华. 肝性脑病的动物模型及分子生物学机制研究进展[J]. 国际消化病杂志, 2014, 34(2): 84-86. PANG F, HU J H. Advances in animal models and molecular mechanisms of hepatic encephalopathy[J]. International Journal of Digestive Diseases, 2014, 34(2): 84-86. DOI:10.3969/j.issn.1673-534X.2014.02.004 |
| [13] |
车庆明. 黄芩素磺酸化衍生物的降血氨作用及其医药用途:CN201810859967.3[P]. 2019-01-04. CHE Q M. Anti ammonia effect of sulfonated derivatives of baicalein and its pharmaceutical use: CN201810859967.3[P]. 2019-01-04. |
| [14] |
黄楠楠, 胡鹏, 吴增光, 等. 6, 7-二乙酰黄芩素对大鼠急性肝性脑病的防治作用及机制研究[J]. 药物评价研究, 2020, 43(10): 1957-1963. HUANG N N, HU P, WU Z G, et al. Preventive effect and mechanism of baicalein 6, 7-diacetate on acute hepatic encephalopathy in rats[J]. Drug Evaluation Research, 2020, 43(10): 1957-1963. |
| [15] |
ZIMMERMANN C, FERENCI P, PIFL C, et al. Hepatic encephalopathy in thioacetamide-induced acute liver failure in rats: characterization of an improved model and study of amino acid-ergic neurotransmission[J]. Hepatology, 1989, 9(4): 594-601. DOI:10.1002/hep.1840090414 |
| [16] |
段志军, 张春乐. 大鼠肝性脑病模型的研究进展[J]. 世界华人消化杂志, 2010, 18(30): 3204-3209. DUAN Z J, ZHANG C L. Progress in developing rat models of hepatic encephalopathy[J]. World Chinese Journal of Digestology, 2010, 18(30): 3204-3209. |
| [17] |
谭琳玲. 醒脑静对A型肝性脑病大鼠肝功能、内毒素及GS、NOS表达影响的研究[D]. 广州: 广州医科大学, 2014. TAN L L. Study on the influence of Xingnaojing on liver function, endotoxin and the expression of GS and NOS with hepatic encephalopathy of type A in rats[D]. Guangzhou: Guangzhou Medical University, 2014. |
| [18] |
ZHAN H, TADA T, NAKAZATO F, et al. Spatial learning eransiently disturbed by intraventricular administration of ouabain[J]. Neurological Research, 2004, 26(1): 35-40. DOI:10.1179/016164104773026507 |
| [19] |
LLAMAS M A, ALLER M A, MARQUINA D, et al. Bacterial translocation to mesenteric lymph nodes increases in chronic portal hypertensive rats[J]. Digestive Diseases & Sciences, 2010, 55(8): 2244-2254. |
| [20] |
UCHIDA N S, SILVA-FILHO S E, AGUIAR R P, et al. Protective effect of cymbopogon citratus essential oil in experimental model of acetaminophen-induced liver injury[J]. American Journal of Chinese Medicine, 2017, 45(3): 515-532. DOI:10.1142/S0192415X17500318 |
| [21] |
LIU W, ZHENG J, XING R. Clinical significance of a scoring formula of liver injury for the preoperative evaluation of patients with liver cirrhosis[J]. European Journal of Gastroenterology & Hepatology, 2014, 26(1): 95-100. |
| [22] |
JONES E A. Pathogenesis of hepatic encephalopathy[J]. Clinics in Liver Disease, 2000, 4(2): 467-485. DOI:10.1016/S1089-3261(05)70119-7 |
| [23] |
陈军梅, 张赤志, 陈军喜. 氨、神经递质与肝性脑病[J]. 中西医结合肝病杂志, 2004, 14(3): 192-193. CHEN J M, ZHANG C Z, CHEN J X. Ammonia, neurotransmitter and hepatic encephalopathy[J]. Chinese Journal of Integrated Traditional and Western Medicine on Liver Diseases, 2004, 14(3): 192-193. DOI:10.3969/j.issn.1005-0264.2004.03.034 |
| [24] |
张丽. 轻微肝性脑病大鼠海马内Glu、GluR1、GABA及GABARA表达的实验研究[D]. 太原: 山西医科大学, 2005. ZHANG L. A research of expressions of Glu, GABA, GluR1 and GABARA in hippocampus of MHE rats[D]. Taiyuan: Shanxi Medical University, 2005. |
| [25] |
LEE I, KESNER R P. Differential contribution of NMDA receptors in hippocampal subregions to spatial working memory[J]. Nature Neuroscience, 2002, 5(2): 162-168. DOI:10.1038/nn790 |
| [26] |
SOWNDHARARAJAN K, DEEPA P, KIM M, et al. Baicalein as a potent neuroprotective agent: a review[J]. Biomed Pharmacother, 2017, 95: 1021-1032. DOI:10.1016/j.biopha.2017.08.135 |
| [27] |
SOWNDHARARAJAN K, DEEPA P, KIM M, et al. Neuroprotective and cognitive enhancement potentials of baicalin: a review[J]. Brain ences, 2018, 8(6): 104. |
2. State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China;
3. Guangdong Pharmaceutical University, Guangzhou 510006, China
 2021, Vol. 38
2021, Vol. 38