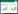文章信息
- 明静, 李芋锦, 杨二鹏, 王子卿, 刘为易, 胡晓梅
- MING Jing, LI Yujin, YANG Erpeng, WANG Ziqing, LIU Weiyi, HU Xiaomei
- 基于数据挖掘及网络药理学探讨胡晓梅主任治疗真性红细胞增多症的用药规律及机制
- Research on prescription regulation and mechanisms of Dr HU Xiaomei in the treatment of polycythemia vera based on data-mining and network pharmacology
- 天津中医药, 2021, 38(11): 1463-1471
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(11): 1463-1471
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.11.21
-
文章历史
- 收稿日期: 2021-05-21
2. 中国中医科学院博士后科研流动站, 北京 100700;
3. 北京中医药大学, 北京 100029
真性红细胞增多症(PV)属于BCR-ABL阴性骨髓增殖性肿瘤(MPNs)范畴,以骨髓及外周血中红细胞异常增殖为主要特点,同时伴有血红蛋白、红细胞压积、白细胞和血小板增多。本病起病缓慢,临床主要表现为皮肤黏膜暗红、皮肤瘙痒、头晕、头胀、目赤、耳鸣、手足发麻、疲劳、虚弱、盗汗等症状,常伴有肝脾肿大,严重者出现心肌梗死、脑血栓、肺栓塞等血栓事件,危及患者的生命。本病晚期可进展为骨髓纤维化(MF)或急性髓系白血病(AML)/骨髓异常综合征(MDS),少数可伴发淋巴瘤[1]。本病发病率为0.84/10万[2],而由于部分患者无症状,实际发病率可能高于这一数据。PV属于获得性克隆性造血干细胞疾病,发病机制为造血干细胞的恶性扩增,但具体机制尚未明确。在本病的治疗上,西医主要以降低血细胞、预防血栓为主要治疗目标,主要药物包括羟基脲、干扰素、芦可替尼、阿司匹林等。上述方法多能短期内降低患者的血细胞,但均有潜在的不良反应,且长期疗效欠佳[3-5]。
近年来,临床实践证明中医药在血液病的防治上安全有效。研究名中医辨治PV的遣方用药规律在探索本病的有效治疗方法上具有重要意义。胡晓梅主任是中国中医科学院名中医,从事血液病临床工作30余年,在中医治疗血液病方面积累了丰富的经验,尤其在治疗PV方面具有中医特色及显著疗效。笔者曾有幸跟随胡晓梅主任学习,现收集其门诊治疗PV的有效方剂202首,应用中医传承辅助平台系统(V2.5),总结用药规律和诊疗经验,并采用网络药理学的方法对其方中的核心药物进行分析,探讨其潜在的作用机制,现将结果报道如下,以供同行交流共进。
1 资料与方法 1.1 处方来源收集2018年4月1日—2020年11月30日中国中医科学院西苑医院胡晓梅主任医师门诊治疗PV的有效处方202首。
1.2 分析软件中医传承辅助系统(V2.5)软件,由中国中医科学院中药研究所提供。
1.3 处方录入与审核将上述筛选的处方录入中医传承辅助系统,在录入完成后,由第2人负责录入数据源的审核,以确保录入信息的准确性。
1.4 数据分析通过“中医传承辅助平台”中的“统计报表系统”及“数据分析系统”进行数据的统计分析。
1.4.1 药物性味归经统计在“统计报表系统”,对药物的性味归经进行统计分析。
1.4.2 药物频次统计在“数据分析系统”,对录入处方的药物频次进行统计,其中用药频次≥40次的中药进行记录。
1.4.3 组方规律分析在“数据分析系统”,对录入的处方进行组方规律分析,在软件中将“支持度个数”设为85,“置信度”设为0.8,再分别点击“用药模式”“规则分析”“网络展示”按键,即得出相应分析结果。
2 网络药理学研究 2.1 药物靶点预测提取中医传承辅助系统药物频次分析得到的前10位的药物作为核心药物。运用中药系统药理学数据库和分析平台(TCMSP,http://tcmspw.com/tcmsp.php)筛选核心中药的相应化合物[筛选标准:口服生物利用度(OB)≥20%,药物相似度(DL)≥0.1],并对化合物进行靶点预测,借助PubChem(https://pubchem.ncbi.nlm.nih.gov)和SwissTargetPrediction(http://www.swisstargetprediction.ch)数据库对预测不到靶点的化合物进行靶标补充。
2.2 PV疾病基因在GeneCards(http://www.genecards.org/)、DisGenet(https://www.disgenet.org)、OMIM( http://www.ncbi.nlm.nih.gov/omim)、TTD(http://db.idrblab.net/ttd/)4个数据库,以“polycythemia vera”为检索词,搜索与PV相关的疾病靶点。使用在线韦恩图绘制平台Venny2.1(http://bioinfogp.cnb.csic.es/tools/venny/index.html,Version 2.1)对PV和核心药物靶点进行映射并绘图。
2.3 GO功能和KEGG通路富集分析将核心中药的靶点导入R平台4.0.2,应用clusterProfileR包(3.14.3)[6],进行基因本体论(GO)分析和京都基因与基因组百科全书(KEGG)通路富集分析,根据P<0.05由低到高筛选出前24条可能性较高的信号通路并进行可视化分析。
2.4 蛋白互作网络(PPI)的构建与分析将交集靶点上传至STRING数据库(http://string-db.org/),物种选为Homo sapiens,评分条件设定为0.9,绘制蛋白互作网络图。
3 结果 3.1 性味归经分布情况202首处方中,药性以寒性使用频次最高,为1 713次,其次为温性(696次),平性(656次),凉性(93次),热性(16次)。药味以苦味使用频次最高为1 974次,其次为甘味(1 294次),辛味(1 093次),酸味(195次),咸味(173次),涩味(117次)。药物归经以肝经频次最高,为2 116次,见表 1。
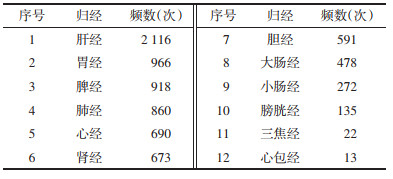
录入系统的202首处方,共包含中药155味,对其进行频次统计,提示方中频次大于40次的药物有29味,具体见表 2。本研究将频次排在前10位的药物作为胡晓梅主任治疗PV的核心药物,依次为生地黄、柴胡、白花蛇舌草、赤芍、龙葵、半枝莲、龙胆、夏枯草、黄芩、牛膝。
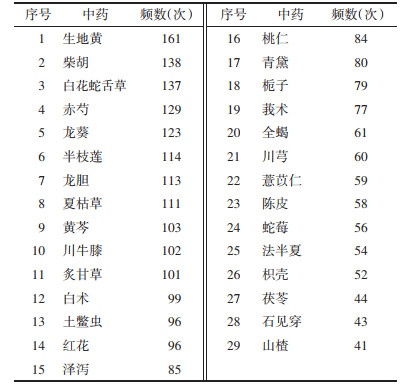
设置“支持度个数”为85,“置信度”为0.8,得到常用药对48个,包含13味中药,见表 3。得到2味药物的核心组合28种,3味药物的核心组合为18种,4味药物的核心组合2种。此外,进行关联规则分析,得到用药规则80条,其中大于0.950以上有19条,见表 4。
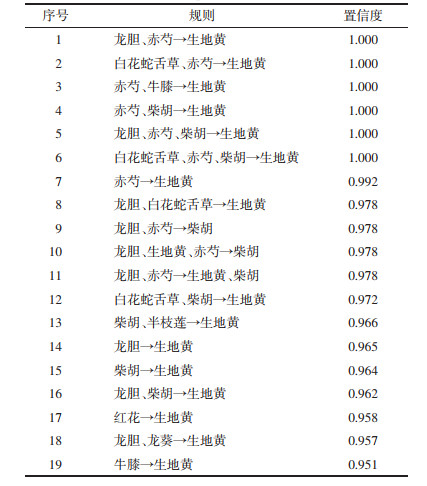
通过软件的网络展示功能,将“支持度个数”设为85,“置信度”设为0.8,对用药模式中所包含的13味中药之间的关联性进行网络可视化展示,见图 1。
|
| 图 1 治疗PV常用药物组合网络图 Fig. 1 Network diagram of drug combinations commonly used to treat PV |
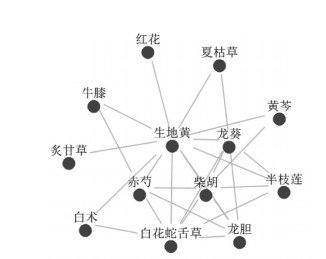
按OB≥20%,DL≥0.1的标准在TCMSP检索到各药物的化合物分别为生地黄19个,柴胡56个,白花蛇舌草15个,赤芍46个,龙葵7个,半枝莲41个,龙胆20个,夏枯草19个,黄芩56个,川牛膝11个,去除重复值,总共得到化合物是229个,预测到靶点378个。在GeneCards、OMIM、DisGenet、TTD数据库检索到与PV疾病相关的靶点为589个,韦恩图显示核心药物与PV相关的靶点为114个,见图 2。
|
| 注:浅紫色代表核心药物靶点,黄色代表疾病靶点,重叠部分为药物与疾病相关靶点。 图 2 韦恩图 Fig. 2 Venn diagram |
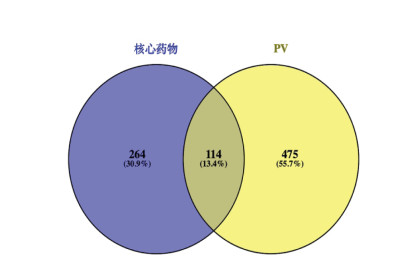
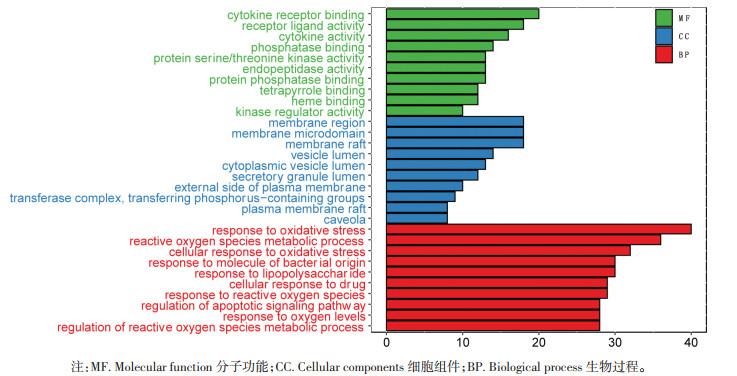
利用R平台对核心药物的靶点进行富集分析,共得到2 579条GO条目,其中生物过程(BP)2 422个,细胞组成(CC)37个,分子功能(MF)120个,并根据P值分别选取前10条目进行可视化分析。如图 3所示,核心药物治疗PV主要涉及氧化应激、药物反应及细胞凋亡等生物过程,它们通过细胞因子受体-配体结合、磷酸化作用、血红素结合、蛋白结合、激酶调节等分子功能在细胞膜、分泌囊泡等部位发挥作用。
|
| 注:MF. Molecular function 分子功能;CC. Cellular components 细胞组件;BP. Biological process 生物过程。 图 3 GO分析条状图 Fig. 3 GO analysis bar graph |
KEGG通路分析共富集到157条信号通路,根据P<0.05由低到高筛选出前24条可能性较高的信号通路,其中PI3K-Akt、HIF-1、JAK-STAT、P53等信号通路均是显著富集的通路,见图 4。
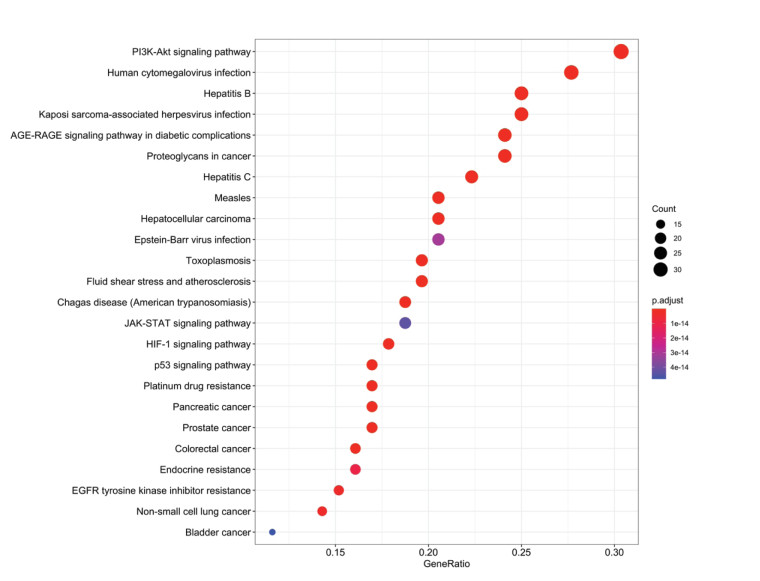
|
| 图 4 KEGG富集气泡图 Fig. 4 Bubble diagram of KEGG enrichment |
蛋白-蛋白互作网络图通过STRING(www.string.db)构建,总共包含114个节点和429条边,展示了STAT3、AKT1、TP53、MAPK1、TNF、VEGFA、MAPK14、IL6等分子在作用机制中的核心地位,见图 5A。图 5B展示了蛋白互作网络节点度值位于前25位的靶点。
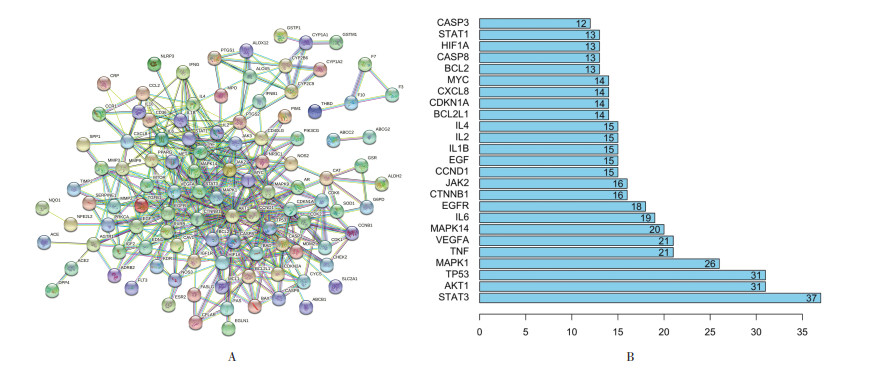
|
| 图 5 蛋白-蛋白互作图 Fig. 5 Protein-protein interaction map |
PV属于中医“血证”“癥瘕”“眩晕”“头痛”等范畴,中医血液病专家于2008年建议将该病规范命名为“血积”[7]。本病的病理改变是血脉瘀阻,气滞血瘀,肝胆实火,热入营血等,关于本病的描述散见于各类医籍中。如《黄帝内经·灵枢》云:“若内伤于忧怒,则气上逆,气上逆则六输不通,温气不行,凝血蕴里而不散,津液涩渗,着而不去,而积皆成矣。”《证治汇补》中载:“热极沸腾发为斑。”《黄帝内经》云:“大怒则血形气绝,而血菀于上。”《血证类·脏腑病机论》中曰:“设木郁为火,则血不和,火发为怒,则血横决,吐血、错经、血痛诸证作焉,火太甚则颊肿面青,目赤头痛。”《类证治裁》载:“血从清道出于鼻则为衄,症多火迫血逆……火亢则治宜清降。”《景岳全书》载有:“血本阴精,不宜动也,而动则为病……概动则多由于火,火盛则迫血妄行。”本病病因分为内、外两端,外因为外感温热邪毒,或外感风寒邪毒入里化热,伤及血分;内因为七情内伤、情志郁结,或体质阳盛、郁久化热、伤及血分。国内外众多的临床及基础研究证实中医药治疗本病的良好效果及独特优势[8-10],但均缺乏广泛推广应用。该病病程较长,中医药“多靶点”,且可“标本兼治”,可在该病的治疗中发挥重要作用。因此,从中医基本理论和本病的发病机制出发,积极发挥中医优势,开发新的中医治疗方法,具有重要的现实意义。朱世荣[11]观察胡晓梅主任运用经验方治疗MPNs患者40例,结果显示治疗完全缓解12例,占比30%,部分缓解22例,占比55%,2例患者病情稳定,占比5%,且可显著缩短活化部分凝血活酶时间(APTT),改善患者的高凝状态,预防血栓形成,临床疗效显著。
中医传承辅助平台(V2.5)是研究名家医方的科学、有效工具。本研究采用中医传承辅助平台总结了胡晓梅主任治疗PV的用药规律。药物频数统计分析显示位于前20位的药物为生地黄、柴胡、白花蛇舌草、赤芍、龙葵、半枝莲、龙胆、夏枯草、黄芩、川牛膝、炙甘草、白术、土鳖虫、红花、泽泻、桃仁、青黛、栀子、莪术、全蝎,主要包含了血府逐瘀汤、龙胆泻肝汤以及当归龙荟丸中的主要药物。胡晓梅主任认为认为PV的病理因素可归结为“热毒”“瘀”“郁”,多属肝热血瘀,血气盛实之证,以瘀血为本,肝火血热为标,治疗上以清肝泻火,活血化瘀为主,辅以清热解毒。PV辨证不论虚实,总以瘀血为要,瘀既为病理产物又是致病原因,PV主要表现为红细胞增多,血液黏稠,常有颜面、唇舌暗紫、目赤、肝脾肿大、舌底静脉迂曲扩张,脉弦或涩等气滞血瘀证的表现,故予桃仁、红花、赤芍、柴胡等药物活血化瘀,理气行滞,其中桃仁入心、肝血分,常用于治疗瘀血阻滞病证,红花活血通经,祛瘀止痛,两者常相须为用;赤芍苦寒入肝经血分,善清泻肝火,泄血分郁热而奏凉血、止血之功。气为血之帅,气行则血行,柴胡性善条达肝气,疏肝解郁,善理气行滞,使气行则血行。柴胡和赤芍,一入血分,一入气分,常常相互为用,以行气活血,在方中同时出现的频率较高。此外,本病初期患者常有目赤、眩晕等肝阳上亢、肝火旺盛的见症,故在活血化瘀的基础上配以泻肝火平肝阳的药物可增强疗效,方中常用龙胆、夏枯草、赤芍清泻肝胆实火,天麻、钩藤、石决明平抑肝阳。龙胆草大苦大寒,为清泻肝胆实火第一药,是PV治疗的常用药物,肝体阴而用阳,性喜疏泄条达而恶抑郁,火邪内郁,肝胆之气不舒,骤用大剂量苦寒降泄之品,既恐肝胆之气被抑,又虑折伤肝胆生发之机,故用柴胡舒畅肝胆之气,并能引诸药归于肝胆之经,故龙胆、柴胡是胡晓梅主任治疗PV方中较常使用的药对。PV为克隆性肿瘤性疾病,95%以上存在JAK2突变,该突变与本病发生发展相关,具有毒的病性,故胡晓梅主任认为本病的治疗应辨病与辨证相结合,在化瘀的同时不忘解毒,常予白花蛇舌草、龙葵、半枝莲、夏枯草、黄芩、青黛、栀子等清热解毒且具有抗癌作用的中药,往往能达到事半功倍的效果。结合西医病理及中医病机,胡晓梅主任认为活血化瘀、解毒抗癌应贯穿本病治疗的始终。《景岳全书·积聚》:“凡有脾肾不足及虚弱失调之人,多有积聚之病。”本病发病多因虚而生,故予白术健脾益气,既可防清热解毒药物苦寒败胃,亦可扶正补虚。生地黄是胡晓梅主任治疗PV的重要药物,不仅在方中使用频次最高,且常用柴胡、赤芍、龙胆作为药对使用,关联规则也显示,方中有龙胆、赤芍、柴胡时,生地黄出现的概率为100%,胡晓梅主任认为方中长期使用清肝泻火及活血化瘀的药物可耗伤阴血,故予生地黄养血滋阴,使邪祛而阴血不伤。综上,借助中医传承辅助平台可以很好地总结胡晓梅主任治疗PV的用药经验,为临床用药提供参考。
此外,本研究基于网络药理学的方法,对频数排在前10位的核心药物(生地黄、柴胡、白花蛇舌草、赤芍、龙葵、半枝莲、龙胆、夏枯草、黄芩、川牛膝)进行了分析。PV患者中95%存在JAK2V617F突变[12],因此JAK2V617F突变成为PV发生和发展的核心问题。JAK2是一种酪氨酸蛋白激酶,能够介导多种细胞因子的信号转导,调控细胞增殖。JAK2V617F突变使JAK2持续活化,激活JAK2-STAT3信号通路,使STAT3磷酸化,进而引起红细胞、血小板以及白细胞的增多[13]。JAK2V617F突变还可通过下游JAK-STAT信号通路激活多种炎性细胞因子产生,包括白介素(IL)-1、IL-2、IL-6、IL-8、IL-12、肿瘤坏死因子-α(TNF-α)和γ-干扰素(IFN-γ)等[14-15]。HIF-1可以诱导下游血管内皮生长因子A(VEGFA)表达,促进血管新生,使肿瘤等微环境发生重塑,从而促进肿瘤细胞的增殖、转移和耐药[16-17]。研究表明,缺氧诱导因子-1(HIF-1)能够促进小鼠JAK2V617F突变细胞增殖[18]。MPNs患者的造血干细胞中也发现了HIF-1和血管内皮生长因子(VEGF)的异常升高,并且在羟基脲治疗后明显降低。芦可替尼可抑制JAK2V617F阳性的HEL细胞的生长,降低HIF-1及其下游靶基因VEGF的表达。而HIF-1抑制剂可选择性抑制MPN细胞的存活和增殖,而不影响正常细胞[18],因此,HIF-1有可能是JAK2V617F阳性PV的新治疗靶点[18],调控HIF-1/VEGFA通路有可能成为PV治疗的关键环节。网络药理学结果显示,共得到核心药物治疗PV的活性成分137个,这些活性成分包含了已知对PV有效的多种机制,例如柴胡中的主要成分柴胡皂苷有很好的抗炎抗肿瘤作用[19],研究表明其可明显抑制JAK2V617F阳性的HEL细胞的增殖,诱导细胞凋亡,调控ATK和STAT3分子的表达[20]。槲皮素已被证实能够通过下调PI3K-Akt通路及JAK-STAT通路诱导血液系统肿瘤细胞凋亡[21]。芹菜素能够调节PI3K-Akt,MAPK-ERK,JAK-STAT,NF-κB和Wnt/β-catenin等多条恶性肿瘤相关通路[22]。葛根素能通过抑制PI3K/mTOR信号通路抑制人类乳头瘤病毒(HPV)阳性宫颈癌细胞的生长和迁移[23]。GO富集分析中,分子功能(MF)富集于细胞因子和蛋白磷酸化激活途径,与PV发病机制中JAK2病理性磷酸化和IL-6等细胞因子改变有关[24-25]。细胞组件(CC)富集于细胞膜结构和细胞囊泡转运结构,与PV病理过程中的JAK2受体结构性激活和进一步级联反应有关[26]。生物过程(BP)富集于活性氧和氧化应激等过程,与PV关于红细胞氧代谢异常的机制相一致[27]。KEGG富集于PI3K-Akt、HIF-1、JAK-STAT、P53等信号通路,皆为PV发病机制中的重要信号通路[18, 28-29]。蛋白互作网络图显示,STAT3、AKT1、TP53、MAPK1、TNF、VEGFA、MAPK14、IL6等分子在作用机制中居核心地位,这些基因有可能是核心药物治疗PV的关键靶点。
本研究运用数据挖掘和网络药理学分析方法,获得胡晓梅主任治疗PV的高频核心药物,并揭示了核心药物具有多成分、多靶点、多通路治疗PV的潜在作用机制,为临床治疗PV提供了参考方案,并为进一步深入研究物质基础和分子机制提供了思路。
| [1] |
MASAROVA L, CHERRY M, NEWBERRY K J, et al. Secondary solid tumors and lymphoma in patients with essential thrombocythemia and polycythemia vera-single center experience[J]. Leukemia & Lymphoma, 2016, 57(1): 237-239. |
| [2] |
TITMARSH G J, DUNCOMBE A S, MCMULLIN M F, et al. How common are myeloproliferative neoplasms? A systematic review and meta-analysis[J]. American Journal of Hematology, 2014, 89(6): 581-587. DOI:10.1002/ajh.23690 |
| [3] |
DEMUYNCK T, VERHOEF G, DELFORGE M, et al. Polycythemia vera and hydroxyurea resistance/intolerance: a monocentric retrospective analysis[J]. Annals of hematology, 2019, 98(6): 1421-1426. DOI:10.1007/s00277-019-03654-6 |
| [4] |
MASAROVA L, PATEL K P, NEWBERRY K J, et al. Pegylated interferon alfa-2a in patients with essential thrombocythaemia or polycythaemia vera: a post-hoc, median 83 month follow-up of an open-label, phase 2 trial[J]. Lancet Haematology, 2017, 4(4): e165-e175. DOI:10.1016/S2352-3026(17)30030-3 |
| [5] |
BOSE P, VERSTOVSEK S. JAK2 inhibitors for myeloproliferative neoplasms: what is next?[J]. Blood, 2017, 130(2): 115-125. DOI:10.1182/blood-2017-04-742288 |
| [6] |
YU G, WANG L G, HAN Y, et al. ClusterProfiler: an R package for comparing biological themes among gene clusters[J]. Omics-a Journal of Integrative Biology, 2012, 16(5): 284-287. DOI:10.1089/omi.2011.0118 |
| [7] |
陈信义, 麻柔, 李冬云. 规范常见血液病中医病名建议[J]. 中国中西医结合杂志, 2009, 29(11): 1040-1041. CHEN X Y, MA R, LI D Y. Proposal on the standardized name of commonly encountered hematological diseases and syndromes in Chinese medicine[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2009, 29(11): 1040-1041. DOI:10.3321/j.issn:1003-5370.2009.11.020 |
| [8] |
李慧, 代喜平, 李达. 梁冰中医辨治真性红细胞增多症经验[J]. 中华中医药杂志, 2018, 33(11): 5008-5011. LI H, DAI X P, LI D. Experience of LIANG Bing in treating polycythemia vera based on syndrome differentiation[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2018, 33(11): 5008-5011. |
| [9] |
臧奉娇, 王树庆, 王念德, 等. 活血通脉颗粒对真性红细胞增多症患者血栓弹力图K值的影响[J]. 安徽中医药大学学报, 2017, 36(2): 22-25. ZANG F J, WANG S Q, WANG N D, et al. Effect of Huoxue Tongmai Granule on K value in thromboelastogram in patients with polycythemia vera[J]. Journal of Anhui University of Chinese Medicine, 2017, 36(2): 22-25. DOI:10.3969/j.issn.2095-7246.2017.02.007 |
| [10] |
王宝金, 刘宝文, 刘欣. 关于柴胡诱发红系祖细胞凋亡来治疗真性红细胞增多症的科学论证[J]. 辽宁中医药大学学报, 2009, 11(10): 46-47. WANG B J, LIU B W, LIU X. The scientific argumentation about the thing that chaihu can cure polycythemia vera by inducing apoptosis of ancestoral unit-erytbroid[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2009, 11(10): 46-47. |
| [11] |
朱世荣. 龙柴降血方治疗BCR-ABL阴性骨髓增殖性肿瘤的靶向性及对凝血功能影响[D]. 北京: 北京中医药大学, 2020. ZHU S R. Targeting effect of Longchai Jiangxue Formula on BCR-ABL negative myeloproliferative neoplasms and its influence on blood coagulation function[D]. Beijing: Beijing University of Chinese Medicine, 2020. |
| [12] |
TEFFERI A, PARDANANI A. Myeloproliferative neoplasms: a contemporary review[J]. Jama Oncology, 2015, 1(1): 97-105. DOI:10.1001/jamaoncol.2015.89 |
| [13] |
LOSCOCCO G G, GUGLIELMELLI P, VANNUCCHI A M. Impact of mutational profile on the management of myeloproliferative neoplasms: a short review of the emerging data[J]. Onco Targets and Therapy, 2020, 13: 12367-12382. DOI:10.2147/OTT.S287944 |
| [14] |
POURCELOT E, TROCME C, MONDET J, et al. Cytokine profiles in polycythemia vera and essential thrombocythemia patients: clinical implications[J]. Experimental Hematology, 2014, 42(5): 360-368. DOI:10.1016/j.exphem.2014.01.006 |
| [15] |
GADOMSKA G, STANKOWSKA K, BOINSKA J, et al. Activation of the tissue factor-dependent extrinsic pathway and its relation to JAK2 V617F mutation status in patients with essential thrombocythemia[J]. Blood Coagulation & Fibrinolysis, 2016, 27(7): 817-821. |
| [16] |
KACHAMAKOVA-TROJANOWSKA N, PODKALICKA P, BOGACZ T, et al. HIF-1 stabilization exerts anticancer effects in breast cancer cells in vitro and in vivo[J]. Biochemical Pharmacology, 2020, 175: 113922. DOI:10.1016/j.bcp.2020.113922 |
| [17] |
DEWANGAN J, SRIVASTAVA S, MISHRA S, et al. Salinomycin inhibits breast cancer progression via targeting HIF-1α/VEGF mediated tumor angiogenesis in vitro and in vivo[J]. Biochemical Pharmacology, 2019, 164: 326-335. DOI:10.1016/j.bcp.2019.04.026 |
| [18] |
BAUMEISTER J, CHATAIN N, HUBRICH A, et al. Hypoxia-inducible factor 1(HIF-1) is a new therapeutic target in JAK2V617F-positive myeloproliferative neoplasms[J]. Leukemia, 2020, 34(4): 1062-1074. DOI:10.1038/s41375-019-0629-z |
| [19] |
张耀峰. 中药柴胡皂苷药理作用的研究进展[J]. 中医临床研究, 2020, 12(33): 120-121. ZHANG Y F. Advances in pharmacological effects of saikosaponins from bupleurum Chinense[J]. Clinical Journal of Chinese Medicine, 2020, 12(33): 120-121. DOI:10.3969/j.issn.1674-7860.2020.33.047 |
| [20] |
MING J, LIU W Y, WU H W, et al. The active ingredients and mechanisms of Longchai Jiangxue Formula in treating PV, based on UPLC/Q-TOF-MS/MS, systematic pharmacology, and molecular biology validation[J]. Biomedicine & Pharmacotherapy, 2021, 140: 111767. |
| [21] |
SHI H, LI X Y, CHEN Y, et al. Quercetin induces apoptosis via downregulation of vascular endothelial growth factor/Akt signaling pathway in acute myeloid leukemia cells[J]. Frontiers in Pharmacology, 2020, 11: 534171. DOI:10.3389/fphar.2020.534171 |
| [22] |
AHMED S A, PARAMA D, DAIMARI E, et al. Rationalizing the therapeutic potential of apigenin against cancer[J]. Life Sci, 2021, 267: 118814. DOI:10.1016/j.lfs.2020.118814 |
| [23] |
JIA L, HU Y, YANG G, et al. Puerarin suppresses cell growth and migration in HPV-positive cervical cancer cells by inhibiting the PI3K/mTOR signaling pathway[J]. Experimental and Therapeutic Medicine, 2019, 18(1): 543-549. |
| [24] |
BONGARTZ H, HESSENKEMPER W, MÜLLER C, et al. The multi-site docking protein Gab1 is constitutively phosphorylated independent from its recruitment to the plasma membrane in Jak2-V617F-positive cells and mediates proliferation of human erythroleukaemia cells[J]. Cellular Signalling, 2017, 35: 37-47. DOI:10.1016/j.cellsig.2017.03.021 |
| [25] |
SUBOTIČKI T, MITROVIĆ AJTIĆ O, BELESLIN-ČOKIĆ B B, et al. IL-6 stimulation of DNA replication is JAK1/2 mediated in cross-talk with hyperactivated ERK1/2 signaling[J]. Cell Biol Int, 2019, 43(2): 192-206. DOI:10.1002/cbin.11084 |
| [26] |
FUJITA H, SAKUMA R, TOMIYAMA J, et al. Relationship between clotting activity and phosphatidylserine expression on erythrocyte membranes in polycythemia vera patients with the JAK2 V617F mutation[J]. Arch Physiol Biochem, 2011, 117(4): 231-235. DOI:10.3109/13813455.2011.571262 |
| [27] |
ALLEGRA A, PIOGGIA G, TONACCI A, et al. Synergic crosstalk between inflammation, oxidative stress, and genomic alterations in BCR-ABL-Negative myeloproliferative neoplasm[J]. Antioxidants, 2020, 9(11): 1037. DOI:10.3390/antiox9111037 |
| [28] |
BARTALUCCI N, GUGLIELMELLI P, VANNUCCHI A M. Rationale for targeting the PI3K/Akt/mTOR pathway in myeloproliferative neoplasms[J]. Clin Lymphoma Myeloma Leuk, 2013, 13: S307-309. DOI:10.1016/j.clml.2013.07.011 |
| [29] |
FENERICH B A, FERNANDES J C, RODRIGUES ALVES A, et al. NT157 has antineoplastic effects and inhibits IRS1/2 and STAT3/5 in JAK2(V617F)-positive myeloproliferative neoplasm cells[J]. Signal Transduction and Targeted Therapy, 2020, 5(1): 5. DOI:10.1038/s41392-019-0102-5 |
2. Postdoctoral Research Programme of China Academy of Chinese Medical Sciences, Beijing 100700, China;
3. Beijing University of Chinese Medicine, Beijing 100029, China
 2021, Vol. 38
2021, Vol. 38