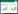文章信息
- 胡亚丽, 杨杰, 庞茜茜
- HU Yali, YANG Jie, PANG Qianqian
- 葛根素诱导人肝癌HepG2细胞凋亡与自噬及其分子机制研究
- Study of puerarin induce apoptosis and autophagy in human liver cancer HepG2 cells and its molecular mechanism
- 天津中医药, 2021, 38(11): 1472-1477
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(11): 1472-1477
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.11.22
-
文章历史
- 收稿日期: 2021-06-28
肝癌是威胁中国人民生命健康的主要恶性肿瘤之一,发病率居恶性肿瘤第4位、病死率居第3位[1]。手术切除并辅以放化疗是临床治疗肝癌的首选方案,但术后5年复发率超过60%、5年生存率不足40%[2]。中医药抗肿瘤逐渐得到人们的关注与认可,葛根素(Puerarin)是从中药葛根中提取的1类具有异黄酮类化合物,包括葛根素、胡萝卜苷、β-谷甾醇等活性成分,呈白色至微黄色结晶性粉末、微溶于水,具有抗炎、抗氧化、降血压、调节血脂、抗心律失常等多种药理学作用[3]。近年来葛根素抗肿瘤活性很受关注,对胰腺癌、非小细胞肺癌、结肠癌等均具有一定的抑制作用[4]。阻滞肿瘤细胞周期进程、诱导肿瘤细胞凋亡和自噬是葛根素抗肿瘤的作用机制[5-6]。本实验以临床治疗肝癌一线化疗用药顺铂为阳性对照,设葛根素3个剂量组进行干预,研究不同剂量葛根素对人肝癌HepG2细胞凋亡、自噬的影响并探讨其可能的分子机制。
1 材料与方法 1.1 细胞人肝癌HepG2细胞购自上海中科院细胞库。HepG2细胞接种于含10%胎牛血清和双抗(100 U/mL链霉素-青霉素)的DMEM培养基,置细胞培养箱(37℃、5% CO2)中进行培养,细胞贴壁生长,细胞汇合度约80%时进行传代。取第3代对数生长期HepG2细胞开展实验研究,设空白组、葛根素(50、100、200 μg/mL)组和顺铂20 μg/mL组[7-8]。
1.2 药物与试剂葛根素购自上海源叶生物科技有限公司(纯度≥99%,批号:B21028);注射用顺铂购自齐鲁制药有限公司(国药准字H37021357,规格20 mg/支,批号:1905016);DMEM培养基、二甲基亚砜(DMSO)、胰酶、胎牛血清购自上海源叶生物科技有限公司;CCK-8试剂盒购自北京索莱宝科技有限公司;Annexin V-FITC/PI凋亡试剂盒、BCA蛋白浓度测定试剂盒、山羊抗兔IgG二抗购自上海碧云天生物技术研究所;兔抗人蛋白激酶B(Akt)、磷酸化Akt(p-Akt)、激活型半胱氨酸蛋白酶(Cleaved Caspase-3)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)、酵母ATG6同源物(Beclin1)、微管相关蛋白1轻链3(LC3)抗体购自北京中杉金桥生物技术有限公司;二氨基联苯胺(DAB)显色试剂盒购自杭州四季青生物工程材料有限公司。
1.3 主要仪器BB15型细胞培养箱(德国Heraeus公司);LB940型酶标仪(德国Berthold公司);SE300型电泳仪、TE22型转膜仪(美国Hoefer公司);FACSAria型流式细胞仪(美国BD公司);BX53型荧光显微镜(日本Olympus公司)。
1.4 细胞增殖抑制率检测取对数生长期HepG2细胞,消化、重悬并计数后调整细胞浓度为1×105个/mL,100 μL/孔接种于96孔培养板,培养24 h后更换培养液,并以DMSO(空白组)和终浓度(50、100、200 μg/mL)葛根素、20 μg/mL顺铂进行干预,每组设10个复孔,继续培养48 h后每孔10 μL加入CCK-8溶液,放回培养箱继续培养2 h后通过酶标仪检测450 nm处吸光度值(A),细胞增殖抑制率(%)=(1-A药物组/A空白组)×100%
1.5 细胞凋亡水平检测取浓度1×105个/mL的HepG2细胞悬液,500 μL/孔接种于6孔细胞培养板,培养24 h后更换培养液,分组并分别以相应浓度药物进行干预,每组设10个复孔,继续培养48 h后通过不含乙二胺四乙酸(EDTA)的胰酶消化、离心(2 000 r/min,离心半径8 cm,5 min)收集细胞,经磷酸盐缓冲液(PBS)洗涤后,按照Annexin V-FITC/PI试剂盒操作说明依次处理,通过流式细胞仪分析细胞凋亡水平。
1.6 细胞自噬溶酶体水平检测取浓度1×105个/mL的HepG2细胞悬液,200 μL/孔接种于24孔板,培养24 h后更换培养液,分组并分别以相应浓度药物进行干预,每组设10个复孔,继续培养48 h后弃培养液、PBS洗涤3次,500 μL/孔滴加吖啶橙溶液(1 mg/L)避光孵育15 min,PBS洗涤3次后通过荧光显微镜观察(自噬溶酶体呈红色荧光)。
1.7 细胞蛋白表达检测取对数生长期HepG2细胞,消化、重悬并计数后调整细胞浓度为1×106个/mL,每孔1 mL接种于60 mm培养皿,放回细胞培养箱继续培养24 h后更换培养液,分组并分别以相应浓度药物进行干预,每组设10个皿,继续培养48 h后消化、离心(2 000 r/min,离心半径8 cm,5 min)收集细胞,冰上裂解30 min,低温4 ℃离心(12 000 r/min,离心半径8 cm,15 min)取上清液,BCA法检测总蛋白浓度、95 ℃水浴10 min蛋白变性,取总蛋白30 μg行十二烷基硫酸钠聚丙烯酰胺凝胶电泳、湿转法将蛋白转移到聚偏二氟乙烯(PVDF)膜上、置5%蛋白免疫印迹封闭液室温封闭2 h,滴加Akt、p-Akt、Cleaved Caspase-3、Bcl-2、Bax、p-mTOR、Beclin1、LC3、β-actin抗体4 ℃孵育过夜,洗膜后滴加二抗室温孵育1 h,洗膜后滴加DAB显色,应用ImageJ软件进行分析,以β-actin为内参半定量目标蛋白相对表达量。
1.8 统计学处理采用GraphPad prism 6软件进行统计分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法检测,P < 0.05为差异有统计学意义。
2 结果 2.1 各组HepG2细胞增殖抑制率比较与空白组比较,葛根素50、100、200 μg/mL组和顺铂20 μg/mL组HepG2细胞增殖抑制率显著升高(P < 0.01);与顺铂20 μg/mL组比较,葛根素200 μg/mL组细胞增殖抑制率升高(P < 0.05)。见表 1。
|
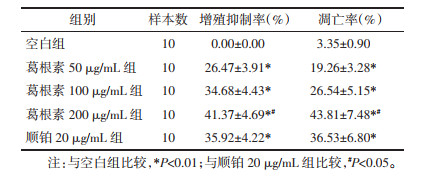
与空白组比较,葛根素50、100、200 μg/mL组和顺铂20 μg/mL组HepG2细胞凋亡数量明显增多,凋亡率显著升高(P < 0.01);与顺铂20 μg/mL组比较,葛根素200 μg/mL组HepG2细胞凋亡率升高(P < 0.05)。见图 1、表 1。
|
| 注:A.空白组;B.葛根素50 μg/mL组;C.葛根素100 μg/mL组;D.葛根素200 μg/mL组;E.顺铂20 μg/mL组。 图 1 各组HepG2细胞凋亡水平比较 Fig. 1 Comparison of apoptosis levels of HepG2 cells in each group |
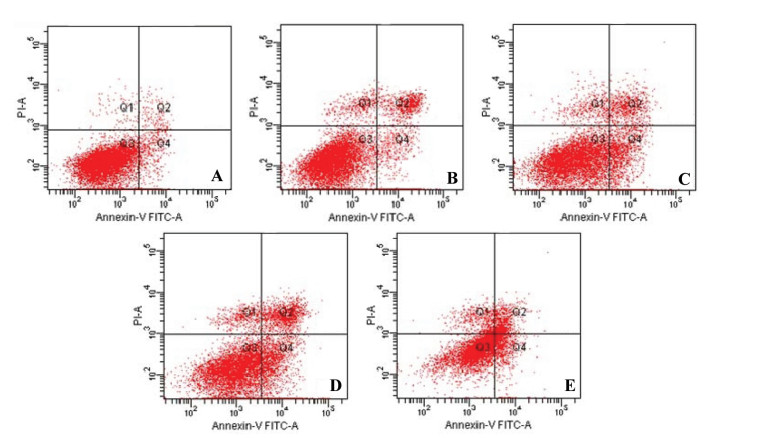
与空白组比较,葛根素50、100、200 μg/mL组和顺铂20 μg/mL组自噬溶酶体(亮红色荧光)呈不同程度增多,葛根素作用呈现一定剂量依赖性,葛根素200 μg/mL组自噬溶酶体数量明显多于其他组,提示葛根素具有诱导HepG2细胞自噬的作用。见图 2。
|
| 注:A.空白组;B.葛根素50 μg/mL组;C.葛根素100 μg/mL组;D.葛根素200 μg/mL组;E.顺铂20 μg/mL组。 图 2 各组HepG2细胞自噬水平比较(吖啶橙染色,×200倍) Fig. 2 Comparison of autophagy levels of HepG2 cells in each group (acridine orange staining, ×200) |
与空白组比较,葛根素100、200 μg/mL组和顺铂20 μg/mL组HepG2细胞p-Akt、p-mTOR表达明显下调(P < 0.01),Akt表达差异无统计学意义(P > 0.05),Akt磷酸化明显降低(P < 0.01);与顺铂20 μg/mL组比较,葛根素200 μg/mL组p-Akt、p-mTOR表达下调(P < 0.05或P < 0.01),Akt磷酸化降低(P < 0.01)。见图 3、表 2。

|
| 注:A.空白组;B.葛根素50 μg/mL组;C.葛根素100 μg/mL组;D.葛根素200 μg/mL组;E.顺铂20 μg/mL组。 图 3 各组HepG2细胞Akt、p-Akt、p-mTOR表达比较 Fig. 3 Comparison of Akt, p-Akt, p-mTOR expression of HepG2 cells in each group |
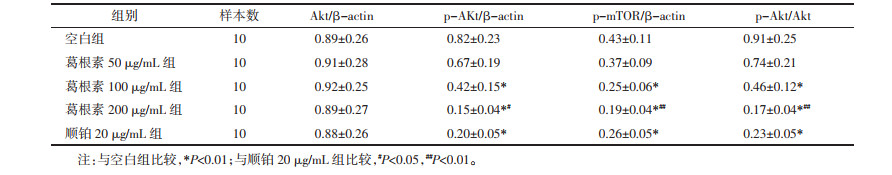
|
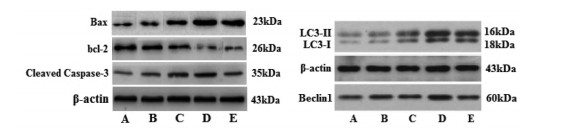
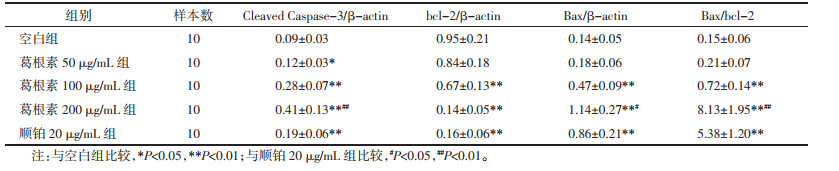
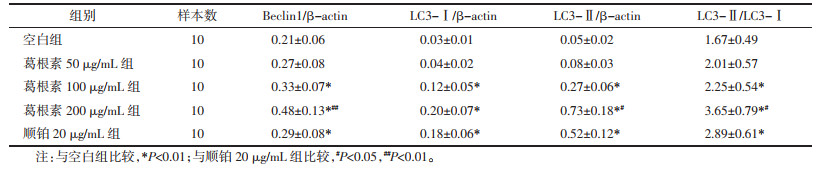
与空白组比较,葛根素100、200 μg/mL组和顺铂20 μg/mL组HepG2细胞Cleaved Caspase-3、Bax、Beclin1、LC3-Ⅰ、LC3-Ⅱ表达明显上调而Bcl-2表达下调(P < 0.01),Bax/Bcl-2、LC3-Ⅱ/LC3-Ⅰ比值显著升高(P < 0.01);与顺铂20 μg/mL组比较,葛根素200 μg/mL组Cleaved Caspase-3、Bax、Beclin1、LC3-Ⅱ上调(P < 0.05或P < 0.01),两组间Bcl-2表达差异无统计学意义(P > 0.05),Bax/Bcl-2、LC3-Ⅱ/LC3-Ⅰ比值升高(P < 0.05或P < 0.01)。见图 4、表 3和表 4。
|
| 注:A.空白组;B.葛根素50 μg/mL组;C.葛根素100 μg/mL组;D.葛根素200 μg/mL组;E.顺铂20 μg/mL组。 图 4 各组HepG2细胞Cleaved Caspase-3、bcl-2、Bax、Beclin1、LC3表达比较 Fig. 4 Comparison of Cleaved Caspase-3, bcl-2, Bax, Beclin1, LC3 expression of HepG2 cells in each group |
|
|
肝癌是世界范围内常见恶性肿瘤之一,每年新发病例超过100万,其中40%以上的患者分布在中国,中国肝癌发病率居恶性肿瘤第四位、病死率居第3位[9]。虽然近年来人民生活条件明显改善、乙型肝炎疫苗得到普及,但肝癌发病率并未出现下降趋势。因此,寻找新型高效的抗肝癌药物仍是目前医药工作者的研究热点。
肝癌在中医属“癥瘕”“臌胀”“黄疸”等范畴,中药葛根以豆科植物野葛的干燥根入药,收入《中国药典》,是长期应用于临床的中药品种,葛根素是提取自葛根的一种异黄酮类化合物,目前临床上主要用于缺血性心脑血管疾病的治疗,近年来葛根素抗肿瘤活性得到广泛关注。本实验研究发现,经葛根素干预能够明显提高人肝癌HepG2细胞增殖抑制率和凋亡率,诱导自噬溶酶体生成;葛根素200 μg/mL组效果优于顺铂20 μg/mL组,提示葛根素具有诱导HepG2细胞凋亡和自噬的药理学作用。
凋亡和自噬是细胞程序性自主死亡的两种主要途径,均由多种基因调控[10]。线粒体介导的内源性凋亡途径由Bcl-2家族、Caspase家族蛋白等参与调控[11]。肿瘤发病过程中,由于肿瘤细胞过度增殖但新生血管相对缺乏而局部缺氧,引发氧化应激、炎症反应、Ca2+超载等而病理性刺激Bcl-2家族蛋白Bax上调表达并移位到线粒体膜、导致膜通透性改变,细胞色素C(Cyt C)释放,从而启动细胞凋亡。Cyt C是Caspase家族蛋白的主要激活因子,其中Cleaved Caspase-3将通过剪切细胞结构蛋白等而诱导细胞凋亡,是细胞凋亡最重要的执行者;Bcl-2蛋白位于线粒体膜,能够与Bax形成异源二聚体而抑制Bax促凋亡活性,保护线粒体膜通透性,表现出抑凋亡活性[12]。LC3蛋白位于于自噬溶酶体膜,能够与线粒体受体蛋白结合而诱导期降解,因此LC3可作为细胞自噬活性的标志蛋白[13]。LC3以LC3-Ⅰ和LC3-Ⅱ两种亚型存在,LC3-Ⅱ具有自噬活性,当细胞自噬发生时无活性的LC3-Ⅰ将转化为LC3-Ⅱ,因此LC3-Ⅱ/LC3-Ⅰ比值能够反映细胞自噬水平[14]。本研究发现,经葛根素干预能够明显上调人肝癌HepG2细胞Cleaved Caspase-3、Bax、LC3-I、LC3-Ⅱ表达并下调Bcl-2表达,提高Bax/Bcl-2、LC3-Ⅱ/LC3-Ⅰ比值,并且葛根素200 μg/mL组对上述蛋白表达的调节作用优于顺铂20 μg/mL组。
Akt是一种原癌基因,被磷酸化(p-Akt)激活后能够诱导Caspase家族蛋白磷酸化而失活,抑制Bax表达与转移[15]。mTOR为Akt下游基因,能够被p-Akt诱导mTOR磷酸化(p-mTOR)而激活,进而诱导细胞周期素上调表达而促进细胞增殖、清除泛素蛋白而抑制细胞自噬[16]。此外,p-mTOR能够诱导下游自噬特征蛋白Beclin1磷酸化而失活,Beclin1是介导LC3等自噬蛋白位移至自噬体的关键因子,从而间接促进细胞自噬[17]。本研究发现,经葛根素干预能够明显下调p-Akt、p-mTOR表达并抑制Akt磷酸化,上调Beclin1表达,并且葛根素200 μg/mL组对p-Akt、p-mTOR、Beclin1表达及Akt磷酸化的调控作用优于顺铂20 μg/mL组,提示葛根素对HepG2细胞凋亡、自噬的调控作用可能与抑制Akt/mTOR/Beclin1通路有关。
综上所述,葛根素具有诱导人肝癌HepG2细胞凋亡与自噬的药理学作用,抑制Akt/mTOR/Beclin1通路进而诱导促凋亡、促自噬相关蛋白表达与活化可能是其重要的分子机制。本研究为体外细胞实验,结果提示葛根素具有较良好的抗肝癌细胞活性,但肝癌的发生发展具有复杂的病理机制,受多种因素影响,因此葛根素抗肝癌作用及相关机制仍需体内实验进一步研究。
| [1] |
陈金东. 中国各类癌症的发病率和死亡率现状及发展趋势[J]. 遵义医学院学报, 2018, 41(6): 653-662. CHEN J D. Trends of cancer incidence and mortality in China[J]. JournaI of Zunyi Medical University, 2018, 41(6): 653-662. DOI:10.3969/j.issn.1000-2715.2018.06.001 |
| [2] |
曹宏伟, 李赛华, 胡海龙. 原发性肝癌手术治疗的生存率及影响因素研究[J]. 中国卫生标准管理, 2019, 10(24): 17-20. CAO H W, LI S H, HU H L. Study on survival rate and influencing factors of surgical treatment of primary hepatocellular carcinoma[J]. China Health Standard Management, 2019, 10(24): 17-20. DOI:10.3969/j.issn.1674-9316.2019.24.007 |
| [3] |
徐兆景. 葛根素药理作用机制探讨及临床应用[J]. 中国现代药物应用, 2016, 10(8): 256-257. XU Z J. Discussion on pharmacological mechanism of puerarin and its clinical application[J]. Chinese Journal of Modern Drug Application, 2016, 10(8): 256-257. |
| [4] |
金鑫, 孙盼盼, 洪云, 等. 葛根素对人非小细胞肺癌A549细胞凋亡的作用[J]. 中国应用生理学杂志, 2017, 33(5): 466-469. JIN X, SUN P P, HONG Y, et al. Puerarin induces apoptosis in A549 cells[J]. Chinese Journal of Applied Physiology, 2017, 33(5): 466-469. |
| [5] |
刘银莉, 王营. 葛根素抗肿瘤作用机制的研究进展[J]. 中国综合临床, 2017, 33(1): 87-89. LIU Y L, WANG Y. Research progress of puerarin antitumor mechanism[J]. Clinical Medicine of China, 2017, 33(1): 87-89. DOI:10.3760/cma.j.issn.1008-6315.2017.01.024 |
| [6] |
孙玉成, 刘晓巍, 片光哲. β-谷甾醇诱导人胃癌细胞自噬与凋亡的作用及机制研究[J]. 中国医师杂志, 2019, 21(6): 866-871. SUN Y C, LIU X W, PIAN G Z. Effect and mechanism study on the autophagy and apoptosis induced by β-sitosterol in human gastric cancer cells[J]. Journal of Chinese Physician, 2019, 21(6): 866-871. DOI:10.3760/cma.j.issn.1008-1372.2019.06.015 |
| [7] |
刘银莉, 王营. 葛根素对人胰腺癌PANC-1细胞增殖凋亡的影响[J]. 实用药物与临床, 2017, 20(11): 1244-1248. LIU Y L, WANG Y. Effects of puerarin on proliferation and apoptosis of human pancreatic cancer PANC-1 cells[J]. Practical Pharmacy and Clinical Remedies, 2017, 20(11): 1244-1248. |
| [8] |
那文婷, 韩景春, 吴亚猛, 等. 胡桃醌联合顺铂对肝癌HepG2细胞增殖的影响[J]. 吉林医药学院学报, 2014, 35(1): 23-25. NA W T, HAN J C, WU Y M, et al. Effect of juglone combined with cisplatin on the proliferation of liver cancer HepG2 cells[J]. Journal of Jilin Medical College, 2014, 35(1): 23-25. |
| [9] |
CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA: A Cancer Journal for Clinicians, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [10] |
ZHU B, JIANG Q, QUE G, et al. Role of autophagy and apoptosis in atrophic epithelium in oral submucous fibrosis[J]. Journal of Oral Science, 2020, 62(2): 184-188. DOI:10.2334/josnusd.19-0170 |
| [11] |
胡青峰, 赵宏磊, 白涛, 等. 生存素通过线粒体途径影响K5诱导的血管内皮细胞凋亡[J]. 中国循证心血管医学杂志, 2019, 11(11): 1311-1314. HU Q F, ZHAO H L, BAI T, et al. Influence of survivin on apoptosis of vascular endothelial cells induced by Kringle 5 through mitochondrial pathway[J]. Chinese Journal of Evidence-Bases Cardiovascular Medicine, 2019, 11(11): 1311-1314. DOI:10.3969/j.issn.1674-4055.2019.11.08 |
| [12] |
ZHU L, HAO J, CHENG M, et al. Hyperglycemia-induced Bcl-2/Bax-mediated apoptosis of Schwann cells via mTORC1/S6K1 inhibition in diabetic peripheral neuropathy[J]. Experimental Cell Research, 2018, 367(2): 186-195. DOI:10.1016/j.yexcr.2018.03.034 |
| [13] |
YUAN L, LIU Q, WANG Z, et al. EI24 tethers endoplasmic reticulum and mitochondria to regulate autophagy flux[J]. Cellular and Molecular Life Sciences, 2020, 77(8): 1591-1606. DOI:10.1007/s00018-019-03236-9 |
| [14] |
TAMRAKAR S, YASHIRO M, KAWASHIMA T, et al. Clinicopathological significance of autophagy-related proteins and its association with genetic alterations in gliomas[J]. Anticancer Research, 2019, 39(3): 1233-1242. DOI:10.21873/anticanres.13233 |
| [15] |
TAKINO J I, SATO T, NAGAMINE K, et al. The inhibition of Bax activation-induced apoptosis by RasGRP2 via R-Ras-PI3K-Akt signaling pathway in the endothelial cells[J]. Scientific reports, 2019, 9(1): 16717-16723. DOI:10.1038/s41598-019-53419-4 |
| [16] |
ZHANG Y, ZHENG Y, FAHEEM A, et al. Anovel AKT inhibitor, AZD5363, inhibits phosphorylation of AKT downstream molecules, and activates phosphoryIation of mTOR and SMIG-1 dependent on the liver cancer cell type[J]. Oncology Letters, 2016, 11(3): 1685-1692. DOI:10.3892/ol.2016.4111 |
| [17] |
WON K Y, GOU Y K, LIM S J, et al. Autophagy is related to the hedgehog signaling pathway in human gastric adenocarcinoma: Prognostic significance of Beclin-I and GIi2 expression in human gastric adenocarcinoma[J]. Pathology Research and Practice, 2015, 211(4): 308-315. DOI:10.1016/j.prp.2014.11.005 |
 2021, Vol. 38
2021, Vol. 38