文章信息
- 孙大娟, 王晗潞, 王帅, 迟莉丽
- SUN Dajuan, WANG Hanlu, WANG Shuai, CHI Lili
- 安肠愈疡汤对溃疡性结肠炎大鼠肠黏膜屏障的修复作用及机制研究
- Research of repair effect and mechanism of Anchang Yuyang decoction on intestinal mucosal barrier in ulcerative colitis rats
- 天津中医药, 2021, 38(12): 1590-1596
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(12): 1590-1596
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.12.21
-
文章历史
- 收稿日期: 2021-10-11
2. 山东中医药大学第一临床医学院, 济南 250000
溃疡性结肠炎(UC)是一种涉及感染、免疫、遗传等多因素的慢性非特异性炎症性肠病[1]。近20年来,中国UC的发病率急剧增加[2],但其发病机制仍未完全阐明,目前认为肠黏膜屏障功能受损是其重要病理改变,与疾病的发生发展密切相关[3],故维护肠黏膜屏障的完整性和通透性是其治疗的关键[4-5]。目前西医治疗药物主要以5-氨基水杨酸、糖皮质激素、生物制剂等为主[6],疗效确切、起效快,但不良反应大、复发率高[7]。中药具有修复肠黏膜损伤等作用,可长期维持缓解、降低复发率,在防治UC方面具有独特优势[8-11]。前期临床实验[12-15]发现安肠愈疡汤具有健脾理气、化湿助运、清热解毒的作用。本研究在前期研究基础上,进一步从动物实验方面观察安肠愈疡汤对UC大鼠咬合蛋白(Occludin)、紧密连接蛋白1(Claudin-1)及白细胞介素-13(IL-13)/酪氨酸激酶(JAK1)/信号转导与转录激活因子6(STAT6)信号通路的调控作用,探讨其修复肠黏膜屏障的机制,为中医药治疗UC提供实验依据。
1 材料与方法 1.1 材料 1.1.1 实验动物36只SPF级雄性SD大鼠购自济南朋悦实验动物繁育有限公司,体质量(200±20)g,动物合格证号:SCXK(鲁)20190003,动物伦理审查批件号:AWE-2019-002。动物饲养于山东中医药大学附属医院动物实验中心,温度20~26 ℃,相对湿度40%~70%,12 h光照和12 h避光循环交替。
1.1.2 实验药品安肠愈疡汤是山东省名中医迟莉丽教授自拟方,药物组成:生黄芪30 g,败酱草30 g,黄连9 g,黄芩9 g,炒白术30 g,薏苡仁30 g,木香9 g,槟榔15 g,地榆炭15 g,白及15 g,当归9 g,炒白芍12 g,防风6 g,生甘草9 g。药材购于山东中医药大学附属医院中药房,并在本院制剂室浸泡、煎煮、过滤、浓缩,按照所需配成高、中、低浓度药液,生药含量为分别为0.375、0.75、1.5 g/mL,置于4 ℃冰箱保存。美沙拉嗪缓释颗粒(法国Ethypharm公司,批号:190108)。
1.1.3 主要试剂和仪器葡聚糖硫酸钠(DSS,MW36000-50000)(美国MP Biomedicals公司,批号:0216011080);苏木精-伊红(HE)染色试剂盒(北京索莱宝科技有限公司,批号:G1120);兔多克隆IL-13抗体(北京博奥森生物技术有限公司,批号:bs-0560R);兔单克隆STAT6抗体、JAK1抗体(英国Abcam公司,批号:ab217998、ab133666);兔单克隆Occludin抗体、Claudin-1抗体(英国Abcam公司,批号:ab167161、ab180158);辣根酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司,批号:Cat.#ZB-2301);Claudin-1、Occludin、JAK1、STAT6、IL-13、PCR引物均由宝日医生物技术(北京)有限公司设计合成。全自动样品快速研磨仪(上海净信实业发展有限公司);冷冻高速离心机(美国Thermo Scientific公司);RT-6000自动酶标仪(深圳雷杜生命科学股份有限公司);FluorChem Q蛋白印迹成像和定量分析系统(美国Proteinsimple公司);电泳、电转系统(美国BIO-RAD公司);PCR仪(德国Roche公司)。
1.2 实验方法 1.2.1 建模及分组给药大鼠适应性饲养1周后,采用随机数字表法随机分为6组:空白组(6只),模型组(6只),中药低、中、高剂量组(各6只,简称低、中、高剂量组)和美沙拉嗪对照组(6只)。除空白组外,其余各组均连续7 d自由饮用4.5% DSS溶液,并于饮用DSS溶液第2天开始进行药物灌胃,依据《实验动物和动物实验技术》动物给药量计算,根据大鼠与人的体表面积等效剂量比值进行折算,中药低、中、高剂量组分别给予含生药为0.375、0.75、1.5 g/mL的中药灌胃,美沙拉嗪对照组以0.035 g/mL的美沙拉嗪混悬液灌胃,空白组、模型组均以去离子水灌胃,以上各组均每次2 mL,每日1次,连续2周。
1.2.2 标本的采集与处理干预结束后,将大鼠麻醉后取距肛门1 cm以上的结肠组织,冲洗干净后,肉眼观察炎症、溃疡情况,取病变最明显的组织,一部分结肠组织固定、包埋、切片后,HE染色,由2名经验丰富的病理科医师显微镜下观察,并参照文献[16]进行组织病理学评分。另一部分结肠组织于-80 ℃冰箱冻存,分别用于Occludin、Claudin-1蛋白、基因表达及IL-13、JAK1、STAT6的基因表达。
1.2.3 Western Blot法检测Occludin、Claudin-1蛋白的表达先于液氮中研磨、裂解结肠组织,离心收集上清液,提取总蛋白,采用蛋白浓度测定(BCA)测定其浓度。取含有40 μg的蛋白溶液为上样量,经电泳、转膜、封闭后,分别加入结合一抗、二抗,再分别洗膜后,避光显色2 min,再置于全自动化学发光图像分析系统中进行扫描。量化标准为目标蛋白灰度值与标准蛋白灰度值的比。
1.2.4 逆转录-聚合酶链反应(RT-PCR)法检测结肠组织Occludin、Claudin-1、IL-13、JAK1、STAT6的表达参照RNAiso Plus说明书采用RNAiso Plus提取总RNA,逆转录为cDNA、荧光定量PCR试剂盒进行荧光定量PCR反应,以GADPH为内参,2-ΔΔCt法计算,引物序列见表 1。扩增引物见表 1。

|
除空白组外,将各组中检测的Occludin和Claudin-1基因表达量逐一与JAK1、STAT6、IL-13的基因表达量使用Spearman相关分析,计算出相关系数(γ),测定P值,从而分析各指标之间的相关性。
1.4 统计学分析采用SPSS 24.0统计软件,计量资料用均值±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。相关性分析采用Pearson线性相关,P < 0.05表示差异有统计学意义。
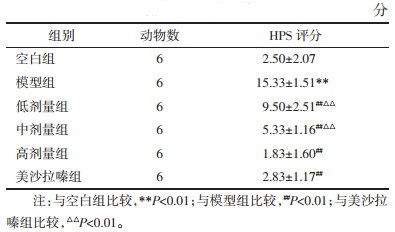
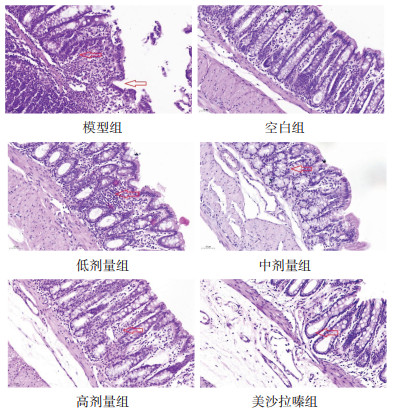
2 结果 2.1 大鼠结肠组织病理学变化 2.1.1 病理学观察结果模型组结肠组织结构不完整,局部可见隐窝消失及隐窝炎,大量淋巴浆细胞浸润,炎症累及黏膜下层。空白组结肠组织结构完整,隐窝结构存在,密集排列,固有层少量淋巴浆细胞浸润。低剂量组结肠组织结构较模型组好转,隐窝结构轻度改建,固有层大量炎性细胞浸润。高剂量组、美沙拉嗪组结肠组织趋于正常,隐窝结构改建,少量炎细胞浸润。中剂量组结肠组织病理变化程度介于低剂量组和高剂量组之间。见图 1。
|
| 图 1 各组大鼠结肠组织病理改变(HE,×200) Fig. 1 Pathological changes of colon tissue in rats of each group (HE, ×200) |
与空白组比较,模型组结肠组织病理学(HPS)评分升高(P < 0.01);与模型组比较,各用药组HPS评分均下降(P < 0.01),其中高剂量组低于低、中剂量组(P < 0.01或P < 0.05),差异均具有统计学意义;高剂量组与美沙拉嗪组比较,差异无统计学意义(P > 0.05)。见表 2。
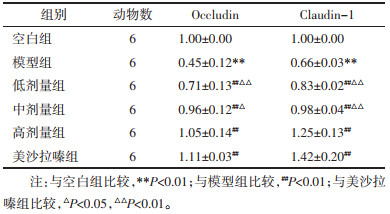
1)Occludin表达:模型组较空白组明显下调(P < 0.01),各用药组较模型组均明显上调(P < 0.01);美沙拉嗪组不同程度优于低、中剂量组(P < 0.01或P < 0.05),差异均具有统计学意义。与高剂量组差异无统计学意义(P > 0.05)。2)Claudin-1表达:模型组较空白组下调(P < 0.01),各用药组较模型组均上调(P < 0.01),美沙拉嗪组优于低、中剂量组(P < 0.01),差异均具有统计学意义。与高剂量组比较,差异无统计学意义(P > 0.05)。见表 3、图 2。
|

|
| 注:1.模型组;2.空白组;3.低剂量组;4.中剂量组;5.高剂量组;6.美沙拉嗪组。 图 2 各组大鼠结肠组织Occludin、Claudin-1蛋白变化 Fig. 2 Changes of Occludin and Claudin-1 protein in colonic tissues of rats in each group |
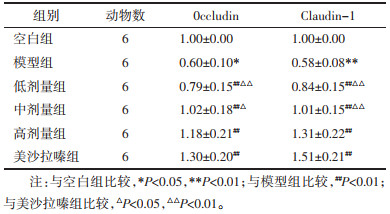
1)Occludin基因表达:模型组较空白组下调(P < 0.05),各用药组较模型组均上调(P < 0.01),美沙拉嗪组不同程度优于低、中剂量治疗组(P < 0.01或P < 0.05),差异均具有统计学意义。与高剂量组比较,差异无统计学意义(P > 0.05)。2)Claudin-1基因表达:模型组较空白组下调(P < 0.01),各用药组较模型组均上调(P < 0.01),美沙拉嗪组优于低、中剂量组(P < 0.01),差异均具有统计学意义。与高剂量组比较,差异无统计学意义(P > 0.05)。见表 4。
|
模型组较空白组下调(P < 0.01),中、高剂量组及美沙拉嗪组较模型组均上调(P < 0.01),差异具有统计学意义;低剂量组与模型组比较,差异无统计学意义(P > 0.05);美沙拉嗪组优于中、低剂量组(P < 0.01),差异具有统计学意义。与高剂量组比较,差异无统计学意义(P > 0.05)。见图 3。
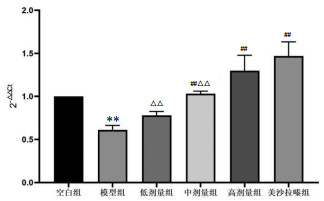
|
| 注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与美沙拉嗪组比较,△△P<0.01。 图 3 各组大鼠结肠组织IL-13基因变化 Fig. 3 Changes of IL-13 gene in colon tissue of rats in each group |
模型组与空白组相比,差异有统计学意义(P < 0.01),中、高剂量组及美沙拉嗪组较模型组均不同程度下调,差异具有统计学意义(P < 0.05或P < 0.01),低剂量组与模型组比较,差异无统计学意义(P > 0.05);美沙拉嗪组优于低剂量组,差异具有统计学意义(P < 0.05),与高剂量组、中剂量组比较差异无统计学意义(P > 0.05)。见图 4。
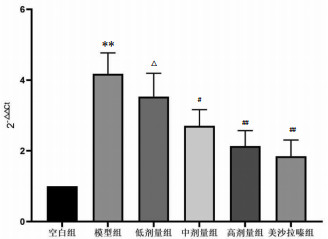
|
| 注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与美沙拉嗪组比较,△P<0.05。 图 4 各组大鼠结肠组织JAK1基因变化 Fig. 4 Changes of JAK1 gene in colonic tissues of rats in each group |
模型组与空白组相比,差异有统计学意义(P < 0.01),各用药组与模型组相比,差异有统计学意义(P < 0.01);美沙拉嗪优于低、中剂量组,差异具有统计学意义(P < 0.01),与高剂量组比较,差异无统计学意义(P > 0.05),见图 5。

|
| 注:与空白组比较,**P<0.01;与模型组比较,##P<0.01;与美沙拉嗪组比较,△△P<0.01。 图 5 各组大鼠结肠组织STAT6基因变化 Fig. 5 Changes of STAT6 gene in colon tissue of rats in each group |
对Occludin和Claudin-1基因表达量逐一与JAK1、STAT6、IL-13的基因表达量使用Spearman相关分析,结果发现,Occludin和Claudin-1与JAK1、STAT6表达水平呈负相关,Occludin和Claudin-1与IL-13表达水平呈正相关,Occludin、Claudin-1与JAK1、STAT6、IL-13的基因表达量具有相关性,具体数值见表 5。

|
UC的治疗目标逐渐由诱导并维持临床缓解、黏膜愈合、防治并发症转变为快速诱导缓解、长期维持缓解、完全的黏膜愈合等[17]。最近更提出了深度缓解和达标治疗的新策略[18-20],即经过治疗后,达到和缓解,这是治疗UC的终极目标。因此治疗的关键是修复受损的肠黏膜屏障。Claudin-1蛋白作为肠黏膜机械屏障中紧密连接蛋白Claudins家族的一员,主要维护肠黏膜机械屏障的完整性和通透性[21]。Occludin蛋白是紧密连接中最重要的结构蛋白,参与紧密连接形成的信号调节[22-23],研究表明,Occludin、Claudin-1表达下调,肠道通透性增加,导致肠腔内的细菌、抗原物质移位激活免疫细胞反应,是UC发生的重要机制之一[24]。因此,上调Occludin、Claudin-1表达水平可以修复肠黏膜屏障,可能是治疗UC的重要靶点。
近年来研究发现[25],针对JAK/STAT通路的靶向治疗是修复肠黏膜屏障功能的重要突破点。STAT家庭共有7个成员,其中STAT6被证明在UC发病过程中可能发挥着重要的负性调节作用[26-28]。研究表明[29-30],IL-13主要的信号通路为JAK/STAT途径,在UC中,抗炎细胞因子IL-13与IL-13RA结合,通过JAK/STAT途径,磷酸化STAT6,启动转录以调节免疫应答反应,参与肠上皮细胞的紧密连接、抗凋亡和黏膜修复过程。所以,通过激活IL-13/JAK/STAT6信号通路,加速肠道屏障功能的修复,是治疗UC的核心环节。
Kim等[31]研究发现:细胞模型实验中STAT3核转位增多,Occludin等多种肠屏障结构的蛋白基因表达降低。卫江鹏等[32]研究亦显示,UC患者肠黏膜Occludin和Claudin-1蛋白表达低于正常肠黏膜,而STAT3蛋白高于正常肠黏膜,两者间呈负相关,且病情越严重,相关性越明显。本研究结果也显示,安肠愈疡汤各用药组Occludin、Claudin-1基因、蛋白表达水平较模型组均不同程度上调,且高剂量组效果较好。除低剂量组外其余用药组不同程度激活IL-13/JAK1/STAT6通路的基因表达,高剂量组、美沙拉嗪组效果最好。Occludin和Claudin-1与JAK1、STAT6表达水平呈负相关,与IL-13表达水平呈正相关,提示Occludin、Claudin-1基因表达可能与IL-13/JAK/STAT信号通路有相关性,中药安肠愈疡汤可能通过激活IL-13/JAK1/STAT6信号通路,上调Occludin和Claudin-1的表达水平,促进UC大鼠肠黏膜修复。通过激活IL-13/JAK1 /STAT6信号转导通路修复肠黏膜屏障,可能是治疗UC的一个新靶点。
| [1] |
SCHIRMER M, DENSON L, VLAMAKIS H, et al. Compositional and temporal changes in the gut microbiome of pediatric ulcerative colitis patients are linked to disease course[J]. Cell Host Microbe, 2018, 24(4): 600-610. DOI:10.1016/j.chom.2018.09.009 |
| [2] |
CUI G, YUAN A. A systematic review of epidemiology and risk factors associated with Chinese inflammatory bowel disease[J]. Frontiers of Medicine (Lausanne), 2018, 5: 183. |
| [3] |
ZHOU K, CHENG R, LIU B, et al. Eupatilin ameliorates dextran sulphate sodium-induced colitis in mice partly through promoting AMPK activation[J]. Phytomedicine, 2018, 46: 46-56. DOI:10.1016/j.phymed.2018.04.033 |
| [4] |
施嫣红, 汤茂春, 黄林生, 等. 传统药物联合酪酸梭菌对溃疡性结肠炎患者肠屏障功能及疗效的影响[J]. 同济大学学报(医学版), 2020, 41(4): 443-448. SHI Y H, TANG M C, HUANG L S, et al. Efficacy of Clostridium butyricum combined with conventional therapy in treatment of patients with ulcerative colitis[J]. Journal of Tongji University (Medical Edition), 2020, 41(4): 443-448. |
| [5] |
王俊珊, 刘占举. 炎症性肠病的诊断和药物治疗相关指南解读[J]. 世界临床药物, 2015, 36(12): 809-813. WANG J S, LIU Z J. Guidelines interpretation of inflammatory bowel disease diagnosis and medication[J]. World Clinical Drugs, 2015, 36(12): 809-813. |
| [6] |
沈洪, 邢敬, 朱磊, 等. 炎症性肠病中西医结合治疗策略的探索与实践[J]. 北京中医药, 2020, 39(3): 191-195. SHEN H, XING J, ZHU L, et al. Exploration and practice of integrated traditional Chinese and Western medicine treatment strategies for inflammatory bowel disease[J]. Beijing Journal of Traditional Chinese Medicine, 2020, 39(3): 191-195. |
| [7] |
钱家鸣, 杨红. 中国炎症性肠病研究的历史回顾现状和展望[J]. 中国实用内科杂志, 2015, 35(9): 727-730. QIAN J M, YANG H. History, current situation and progress of inflammatory bowel disease in China[J]. Chinese Journal of Practical Internal Medicine, 2015, 35(9): 727-730. |
| [8] |
王新月, 王建云. 溃疡性结肠炎中医药治疗的关键问题与优势对策[J]. 中华中医药杂志, 2012, 27(2): 263-267. WANG X Y, WANG J Y. Key issues and superiority in Chinese medical treatment of ulcerative colitis[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2012, 27(2): 263-267. |
| [9] |
刘素萍, 蒋青青, 金晶, 等. 中医药调节溃疡性结肠炎肠道菌群研究概况[J]. 中华中医药学刊, 2021, 39(3): 208-212. LIU S P, JIANG Q Q, JIN J, et al. Research overview of traditional Chinese medicine regulating intestinal flora in ulcerative colitis[J]. Chinese Archives of Traditional Chinese Medicine, 2021, 39(3): 208-212. |
| [10] |
陈继超. 中医药对溃疡性结肠炎肠黏膜屏障调控作用的研究进展[J]. 世界华人消化杂志, 2020, 28(15): 725-729. CHEN J C. Research progress on regulation of intestinal mucosal barrier of patients with ulcerative colitis with traditional Chinese medicine[J]. World Chinese Journal of Digestology, 2020, 28(15): 725-729. |
| [11] |
孙大娟, 迟莉丽. 安肠愈疡汤合加味生肌散治疗溃疡性结肠炎30例[J]. 山东中医药大学学报, 2009, 33(5): 402-403. SUN D J, CHI L L. Treatment of 30 cases of ulcerative colitis with Anchang Yuyang decoction and Jiawei Shengji powder[J]. Journal of Shandong University of Traditional Chinese Medicine, 2009, 33(5): 402-403. |
| [12] |
迟莉丽, 戴霞. 安肠愈疡汤口服合加味生肌散灌肠对实验性溃疡性结肠炎大鼠的影响[J]. 中华中医药杂志, 2009, 24(10): 1337-1339. CHI L L, DAI X. Study on effect and mechanism of Anchang Yuyang decoction with Jiawei Shengji powder on ulcerative colitis in rats[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2009, 24(10): 1337-1339. |
| [13] |
石敏, 迟莉丽, 戴霞, 等. 安肠愈疡汤合加味生肌散对实验性溃疡性结肠炎大鼠的药效学研究[J]. 时珍国医国药, 2010, 21(9): 2286-2288. SHI M, CHI L L, DAI X, et al. Pharmacodynamics study of Anchang Yuyang decoction and Jiawei Shengji powder on experimental ulcerative colitis in rats[J]. Lishizhen Medicine and Materia Medica Research, 2010, 21(9): 2286-2288. DOI:10.3969/j.issn.1008-0805.2010.09.075 |
| [14] |
迟莉丽, 孙大娟, 程艳, 等. 安肠愈疡汤对溃疡性结肠炎大鼠结肠组织中TFF3、MUC2及TLR4基因表达的影响[J]. 胃肠病学, 2016, 21(2): 85-89. CHI L L, SUN D J, CHENG Y, et al. Effect of Anchang Yuyang decoction on colon tissue TFF3, MUC2 and TLR4 expressions in rats with ulcerative colitis[J]. Chinese Journal of Gastroenterology, 2016, 21(2): 85-89. DOI:10.3969/j.issn.1008-7125.2016.02.005 |
| [15] |
迟莉丽, 孙大娟, 梁峻尉, 等. 中药安肠愈疡汤对溃疡性结肠炎大鼠结肠组织中IL-6、IL-13含量及NF-κB表达的影响[J]. 世界中医药, 2016, 11(1): 113-116. CHI L L, SUN D J, LIANG J W, et al. Effect of Anchang Yuyang decoction on the expression of IL-6, IL-13 and NF-κB in ulcerative colitis mice[J]. World Chinese Medicine, 2016, 11(1): 113-116. DOI:10.3969/j.issn.1673-7202.2016.01.030 |
| [16] |
郑文潇, 吴翔. 溃疡性结肠炎动物模型的研究进展[J]. 中国病原生物学杂志, 2016, 11(9): 861-864, 867. ZHENG W X, WU X. A review on animal models of ulcerative colitis[J]. Journal of Parasitic Biology, 2016, 11(9): 861-864, 867. |
| [17] |
沈洪, 邢敬. 中西医结合治疗溃疡性结肠炎的优势及临床应用[J]. 医学研究生学报, 2019, 32(6): 586-587. SHEN H, XING J. Integrated traditional Chinese and Western medicine for the treatment of ulcerative colitis: advantages and clinical application[J]. Journal of Medical Postgraduates, 2019, 32(6): 586-587. |
| [18] |
吴开春, 梁洁, 冉志华, 等. 炎症性肠病诊断与治疗的共识意见(2018年北京)[J]. 中国实用内科杂志, 2018, 38(9): 796-813. WU K C, LIANG J, RAN Z H, et al. Chinese consensus on diagnosis and treatment of inflammatory bowel disease (Beijing, 2018)[J]. Chinese Journal of Practical Internal Medicine, 2018, 38(9): 796-813. |
| [19] |
DANESE S, RODA G, PEYRIN-BIROULET L. Evolving therapeutic goals in ulcerative colitis: towards disease clearance[J]. Nature Reviews Gastroenterology & Hepatology, 2020, 17(1): 1-2. |
| [20] |
王承党, 郭晓雄. 炎症性肠病治疗的理想目标: 深度缓解的意义和对策[J]. 世界华人消化杂志, 2015, 23(24): 3824-3830. WANG C D, GUO X X. The ideal goal of the treatment of inflammatory bowel disease: the significance and countermeasures of deep relief[J]. World Chinese Journal of Digestology, 2015, 23(24): 3824-3830. |
| [21] |
马军宏, 于向阳. 紧密连接蛋白与肠黏膜屏障损伤研究进展[J]. 中国中西医结合外科杂志, 2015, 34(1): 238-242. MA J H, YU X Y. Research progress on tight junction proteins and intestinal mucosal barrier injury[J]. Chinese Journal of Surgery of Integrated Traditional and Western Medicine, 2015, 34(1): 238-242. |
| [22] |
张慧利, 罗序睿, 李爱连, 等. 大鼠心脏骤停心肺复苏后脑Occludin蛋白表达及其对血脑屏障的影响[J]. 中国医药, 2016, 11(4): 506-510. ZHANG H L, LUO X R, LI A L, et al. Expression of Occludin protein and its influence on blood brain barrier after cardiopulmonary resuscitation in sudden cardiac arrest rats[J]. China Medicine, 2016, 11(4): 506-510. DOI:10.3760/cma.j.issn.1673-4777.2016.04.011 |
| [23] |
石永言, 富建华, 姚丽, 等. 维生素D调节坏死性小肠结肠炎新生大鼠肠道上皮occludin蛋白表达的研究[J]. 中国小儿急救医学, 2017, 24(1): 60-64. SHI Y Y, FU J H, YAO L, et al. Regulatory effect of vitamin D on the expression of occludin in the intestinal epithelial cells of neonatal; rats with necrotizing enterocolitis[J]. Chinese Pediatric Emergency Medicine, 2017, 24(1): 60-64. DOI:10.3760/cma.j.issn.1673-4912.2017.01.013 |
| [24] |
谭悦, 郑长清. 紧密连接蛋白occludin、ZO-1在溃疡性结肠炎中的表达及其临床意义[J]. 现代药物与临床, 2018, 33(7): 1803-1808. TAN Y, ZHENG C Q. Expression and clinical significance of tight junction protein occludin and ZO-1 in ulcerative colitis[J]. Drugs & Clinic, 2018, 33(7): 1803-1808. |
| [25] |
薛翔, 刘红梅, 邵旦兵, 等. JAK/STAT信号通路调节机制的研究进展[J]. 现代生物医学进展, 2015, 15(11): 2161-2165. XUE X, LIU H M, SHAO D B, et al. Research progress of regulating mechanism on JAK/STAT signaling pathway[J]. Progress in Modern Biomedicine, 2015, 15(11): 2161-2165. |
| [26] |
ELROD J W, LAROUX F S, HOUGHTON J, et al. DSS induced colitis is exacerbated in STAT6 knockout mice[J]. Inflammatory Bowel Diseases, 2005, 11(10): 883-889. DOI:10.1097/01.MIB.0000182871.76434.57 |
| [27] |
FAN H, LIANG L, TANG Q, et al. Effects of Wumei Wan on the expression of STAT6 in rats with ulcerative colitis[J]. Research of Integrated Traditional Chinese and Western Medicine, 2011, 3(3): 127-131. |
| [28] |
杨立, 肖明明. STAT6蛋白在实验性结肠炎大鼠中的表达及其对细胞因子IFN-γ和IL-4的影响[J]. 胃肠病学和肝病学杂志, 2015, 24(11): 1341-1345. YANG L, XIAO M M. Expression of STAT6 in the intestinal mucosa of rats with TNBS induced experimental colitis and its influence on cytokines IFN-γ and IL-4[J]. Chinese Journal of Gastroenterology and Hepatology, 2015, 24(11): 1341-1345. |
| [29] |
熊绍恒, 熊丽霞. IL-13受体介导的融合蛋白在肿瘤靶向治疗中的研究进展[J]. 中国细胞生物学学报, 2015, 37(10): 1418-1424. XIONG S H, XIONG L X. The progress of IL-13 receptor mediated fusion protein in tumor-targeted therapy[J]. Chinese Journal of Cell Biology, 2015, 37(10): 1418-1424. DOI:10.11844/cjcb.2015.10.0155 |
| [30] |
WALCZAK A, PRZYBYLOWSKA K, DZIKI L, et al. The IL-8 and IL-13 gene polymorphisms in inflammatory bowel disease and colorectal cancer[J]. DNA and Cell Biology, 2012, 31(8): 1431-1438. DOI:10.1089/dna.2012.1692 |
| [31] |
KIM C Y, KIM K H. Curcumin prevents leptin-induced tight junction dysfunction in intestinal Caco-2 BBe cells[J]. Journal of Nutritional Biochemistry, 2014, 25(1): 26-35. DOI:10.1016/j.jnutbio.2013.08.011 |
| [32] |
卫江鹏, 刘刚, 刘彤, 等. 溃疡性结肠炎患者肠道机械屏障变化与STAT3信号通路关系的研究[J]. 胃肠病学和肝病学杂志, 2016, 25(1): 47-50. WEI J P, LIU G, LIU T, et al. The relationship between the change of intestinal mechanical barrier function in patients with ulcerative colitis and STAT3 pathway[J]. Chinese Journal of Gastroenterology and Hepatology, 2016, 25(1): 47-50. |
2. The First Clinical College of Shandong University of Traditional Chinese Medicine, Jinan 250000, China
 2021, Vol. 38
2021, Vol. 38