文章信息
- 武学润, 杨东, 王铭歆, 赵树君, 叶艳
- WU Xuerun, YANG Dong, WANG Mingxin, ZHAO Shujun, YE Yan
- 仙芪眩宁颗粒对豚鼠耳蜗膜迷路积水AQP2表达的影响
- Effects of Xianqi Xuanning Granule on the expression of aquaporin-2 in the cochlea of guinea pig with endolymphatic hydrops
- 天津中医药, 2021, 38(12): 1597-1601
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(12): 1597-1601
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.12.22
-
文章历史
- 收稿日期: 2021-06-28
2. 天津医科大学总医院耳鼻喉科, 天津 300050;
3. 天津医科大学朱宪彝纪念医院内分泌研究所, 卫生部激素与发育重点实验室, 天津 300134
梅尼尔病(MD)是以膜迷路积水为主要病理特征的内耳疾病,表现为反复发作性眩晕,感音神经性耳聋,耳鸣、耳闷胀感。膜迷路积水也称内淋巴积水,病理表现为诱因所导致的内耳缺氧、变态反应使毛细血管壁通透性增高,内淋巴产生过多或内淋巴囊吸收障碍[1]。研究已证实与水通透性相关的转运蛋白-水通道蛋白(AQPs)之一的内耳水通道蛋白2(AQP2)表达增加参与膜迷路积水发生的病理过程[2-3]。临床发现以仙鹤草、黄芪、白术、泽泻为主的仙芪眩宁颗粒对于痰湿中阻型MD具有一定辅助治疗作用。本研究在构建醋酸去氨加压素诱导的豚鼠膜迷路积水模型的基础上,观察仙芪眩宁颗粒治疗后的豚鼠内耳AQP2的表达变化,进而从分子水平探讨其机制。
1 材料与方法 1.1 实验材料 1.1.1 动物与分组由北京隆安实验动物养殖中心提供[许可证号:SCXK(京)2019-0006]SPF级健康白化豚鼠50只,体质量300 g左右,耳廓Preyer反射灵敏,耳镜检查无中耳疾病。按随机数字表法分为5组,每组10只:正常对照组(Control组)、模型组(Model组)、低剂量治疗组(LT组)、中剂量治疗组(MT组)、高剂量治疗组(HT组)。
1.1.2 构建模型及干预治疗Model组与各治疗组豚鼠均参照文献[3-4]方法,腹腔注射醋酸去氨加压素4 μg/kg,连续7 d,第8天以6 μg/kg再注射3 d,建立膜迷路积水模型,Control组予1 mL生理盐水腹腔注射。仙芪眩宁颗粒溶解于双蒸水,自第11天开始分组喂饲,LT组、MT组、HT组剂量分别为6.1、12.2、24.4 g/kg,连续治疗7 d,Control组、Model组以双蒸水替代。
1.1.3 主要试剂及设备醋酸去氨加压素(海南中和制药股份有限公司,批号:20181202)、抗AQP2多克隆抗体(Biorbyt公司,orb10123)、抗β-actin抗体(武汉爱博泰克,AC028)、兔SP试剂盒(北京中杉金桥生物技术有限公司,SP-9001)、二氨基联苯胺(DAB)试剂盒(北京中杉金桥生物技术有限公司,ZLI-9019)、辣根酶标记羊抗兔二抗(北京中杉金桥生物技术有限公司,ZB-2301);国际听力客观听觉测试平台(丹麦,Eclipse EP25型)、数字扫描电镜(HITACHI公司,Regulus 8100型)、多样品组织研磨机(上海净信实业发展有限公司,Tissuelyser-48型)、全波长扫描酶标仪(BioTek公司,SynergyMx型)、化学发光成像仪(北京赛智创业科技有限公司,MiniChemi 610型)等。
1.2 实验方法 1.2.1 听性脑干反应(ABR)阈值检测隔音电屏蔽室内操作,10%水合氯醛按250 mg/kg剂量将豚鼠进行腹腔注射麻醉,麻醉后将豚鼠俯卧位放置于固定台上,记录电极分别插入双侧耳后皮下,参考电极插于额部正中皮下,接地电极置于臀背部皮下。刺激声为短声,插入式耳机给声,刺激频率19.1 Hz,低通滤波1 500 Hz,高通滤波150Hz。给声强度从80 dB nHL开始以10 dB nHL递减,叠加次数2 000次,接近阈值时以5 dB nHL递减,以能分辨出可重复的Ⅲ波的最低刺激强度为ABR阈值。
1.2.2 耳蜗取材及切片制取豚鼠麻醉方法同上,腹主动脉取血处死后快速断头取听泡,打开听泡暴露耳蜗,将耳蜗置于4%多聚甲醛固定48 h,10%乙二胺四乙酸(EDTA)脱钙液(pH 7.2)在4 ℃下脱钙3周,梯度乙醇逐级脱水,石蜡包埋,平行蜗轴连续制取4 μm厚切片。用于蛋白定量的豚鼠耳蜗组织直接冻存于液氮中待用。
1.2.3 膜迷路积水评价耳蜗石蜡切片常规HE染色,采集图像运用Image J图像处理软件测定耳蜗切片各回中阶和前庭阶横截面积,计算R值=中阶面积/中阶+前庭阶面积和,取平均值评价各组豚鼠膜迷路积水程度的差异[5]。
1.2.4 耳蜗Corti器超微结构观察豚鼠耳蜗以2%戊二醛固定,10%EDTA脱钙,1%锇酸固定1 h,磷酸盐缓冲溶液(PBS)漂洗后剥除耳蜗骨壳揭除前庭膜,暴露内外毛细胞,以30%~100%梯度乙醇脱水,100%丙酮液中过夜。二氧化碳临界点干燥、粘托,真空喷金,日立数字扫描电镜观察耳蜗Corti器区域。
1.2.5 免疫组化方法检测豚鼠耳蜗AQP2表达耳蜗切片常规梯度脱蜡,按照SP免疫组化试剂盒说明书操作,AQP2抗体工作液(1∶200),DAB显色、苏木素复染、脱水、透明、封片,图像采集。Image J图像处理软件测定AQP2积分光密度(IOD)。
1.2.6 蛋白免疫印迹(Western Blot)法测定豚鼠耳蜗AQP2表达耳蜗组织于蛋白裂解液,经超声粉碎、离心取上清蛋白提取液,经10%SDS-PAGE凝胶电泳、转膜、5%BSA封闭,AQP2抗体工作液(1∶2 000),β-actin抗体工作液(1∶5 000),二抗工作液(1∶3 000),ECL发光液避光孵膜、曝光,采集图像,Image J图像处理软件分析条带灰度值。
1.3 统计学方法采用SPSS 24.0统计学软件对数据进行处理分析。计量资料以均数±标准差(x±s)表示,组间均数比较采用单因素方差分析,多重比较采用LSD-t检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 听力ABR阈值比较Model组ABR阈值高于Control组(P < 0.05),差异有统计学意义,提示Model组豚鼠听力受损;LT组、MT组、HT组各治疗组均可使听力受损得以恢复,表现为3个治疗组ABR阈值与Control组比较,差异无统计学意义(P > 0.05)。见表 1。
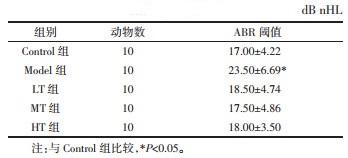
Control组豚鼠耳蜗前庭阶、中阶、鼓阶等组织结构正常,R值中阶面积约占中阶、前庭阶面积和的30%左右;Model组豚鼠耳蜗切片HE染色显示前庭膜向前庭阶膨隆,表现为不同程度的膜迷路积水,提示膜迷路积水模型成功,各治疗组R值均低于Model组,与Control组比较,差异无统计学意义(P > 0.05)。Model组豚鼠耳蜗前庭膜向前庭阶膨隆,中阶面积与中阶及前庭阶面积和的比值R增高,与Control组比较,差异具有统计学意义(P < 0.01)。见图 1。
|
| 注:与Control组相比,**P<0.01。 图 1 各组豚鼠耳蜗形态学改变(×100) Fig. 1 Morphological changes of the cochleas of guinea pigs in each group detected with HE staining (×100) |
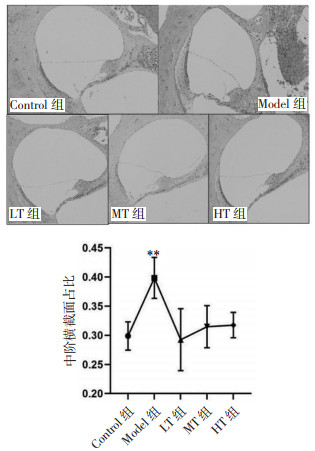
Control组豚鼠耳蜗Corti器外毛细胞的静纤毛呈V形排列整齐,Model组外毛细胞静纤毛有明显融合、倒伏,缺失,排列紊乱甚至消失,LT组、MT组、HT组组外毛细胞静纤毛呈V字形排列整齐,僵直度趋于正常。见图 2。
|
| 图 2 各组豚鼠耳蜗Corti器扫描电镜(×1 000) Fig. 2 Morphological changes of the cochlear organ of Corti in guinea pig by scanning electron micrograph (×1 000) |
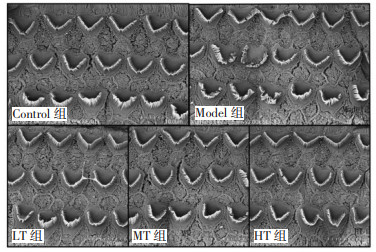
与Control组相比,Model组血管纹、螺旋韧带、Corti器、基底膜AQP2均有较高表达(P < 0.01),而仙芪眩宁颗粒LT组、MT组、HT组治疗组AQP2表达水平较Model组有所降低,并趋于正常表达水平,Control组与各治疗组间比较,差异无统计学意义(P > 0.05)。见图 3。
|
| 注:与Control组相比,** P<0.01。 图 3 各组豚鼠耳蜗AQP2表达(DAB染色,×100) Fig. 3 Expression of AQP2 in cochleas of guinea pigs in each group detected by DAB staining (×100) |
与Control组相比,Model组、LT组AQP2蛋白表达增高,而HT组其表达减低,差异具有统计学意义(P < 0.01),各治疗组AQP2表达水平低于Model组,并随治疗剂量的增高而减少。见图 4。
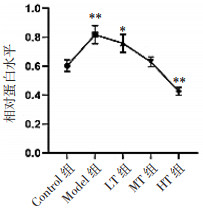
|
| 注:与Control组相比,*P<0.05,**P<0.01。 图 4 Western-blot法测定各组豚鼠耳蜗AQP2表达水平 Fig. 4 The expression level of AQP2 in cochlea of guinea pigs in each group detected by Western blot |
MD在中医纳入“眩晕”范畴,强调头眩之证多因于痰,有“无痰不作眩”理论。现代医家结合膜迷路积水的病理本质,认为痰饮内停为MD发病的关键[6]。MD病理基础是内淋巴液稳态失衡造成的膜迷路积水,作为一种与水代谢相关的内耳疾病与AQPs紧密相关。AQPs对维持生物体的液体平衡和内环境的稳定起着重要的作用,分布于各组织器官AQPs的表达失衡或功能障碍会导致多种疾病,现代中医也提出AQPs调控异常与痰饮的形成有关[7]。人体AQPs的11种亚型中AQP1-5表达于内耳,其中特异性AQP2与MD紧密相关[8]。韩红蕾等[9]研究发现广泛分布于豚鼠内耳的AQP1表达较稳定,而特异性AQP2主要分布于内耳的血管纹、Corti器、螺旋神经节细胞和内淋巴囊中,在膜迷路积水的豚鼠模型中AQP2的表达上调。冷辉等[10]也提出AQP2高表达与AQP5低表达可能协同参与了豚鼠膜迷路积水的形成。
Takeda等[11]发现MD患者血浆中血管加压素(AVP)水平明显增高,将AVP持续小剂量微泵注射豚鼠皮下后,豚鼠耳蜗出现轻-中度内淋巴积水,由此推测膜迷路积水与血浆AVP异常分泌有关。值得关注的是AQP2是AQPs中唯一对AVP敏感的蛋白通道,内耳AVP-AQP2通路异常已成为MD膜迷路积水的重要机制之一[12]。天然AVP的长效衍生物去氨加压素为AVP的V2受体激动剂,特异性作用于V2受体,可启动AVP-AQP2通路诱导AQP2表达上调,由此采用腹腔注射去氨加压素法可简单易行诱发豚鼠膜迷路积水模型,形态学可见耳蜗前庭膜向前庭阶膨隆[3, 13]。
传统中医在MD治疗中独具特色,基础研究也逐渐深入,蒋丽元等[6]通过艾灸听宫穴可下调AQP2的表达进而减轻大鼠膜迷路积水程度。罗炽琼等[7]研究发现苓桂术甘汤合泽泻汤对前庭膜上AQP2的表达有下调作用,从而减轻膜迷路积水豚鼠模型的积水程度。临床实践证实中成药仙芪眩宁颗粒治疗MD具有一定疗效,其中仙鹤草不但具有收敛止血,补脾益气的功效,也可用于利水消肿的治疗;黄芪则有补气固表、利水消肿作用;白术、泽泻为治疗痰饮眩晕的传统药物,其配伍具有健脾燥湿,升清降浊和利水除痰的功效。然而仙芪眩宁颗粒在治疗MD中的机制尚未明确,本研究在构建豚鼠内耳膜迷路积水模型的基础上予以治疗,模型组豚鼠听力受损ABR阈值升高,而仙芪眩宁颗粒LT组、MT组、HT组均可有效缓解豚鼠膜迷路积水程度,表现为听力ABR阈值下降,与Control相比均未见统计学差异(P > 0.05)。通过形态学观察到治疗组豚鼠膜迷路积水明显缓解,前庭膜膨出得以恢复。扫描电镜结果也表现在超微结构上,Model组较Control组外毛细胞静纤毛融合、倒伏、缺失、排列紊乱,而LT、MT、HT组外毛细胞的静纤毛均排列整齐,僵直度趋于正常。针对内耳特异性AQP2的表达,免疫组组织化学法观察到Model组AQP2表达高于Control组(P < 0.01),而各治疗组趋于正常表达水平,组间也未见统计学差异(P > 0.05)。Western Blot法验证Model组AQP2的高表达,LT组、MT组、HT组可明显降低AQP2的表达水平,并随治疗剂量的增高而减少,其中HT组AQP2表达水平低于Control组(P < 0.01)。本研究表明仙芪眩宁颗粒可通过抑制AVP-AQP2通路纠正内耳膜迷路积水,从而达到治疗MD的目的。本研究较为深入地对仙芪眩宁颗粒治疗MD的分子机制进行探讨,进而为临床治疗提供一定的理论依据。
| [1] |
KAKIGI A, TAKEDA T. Antidiuretic hormone and osmolality in patients with Meniere's disease[J]. Journal for Oto-Rhino-Laryngology, Head and Neck Surgery, 2009, 71(1): 11-13. |
| [2] |
蒋丽元, 王学仲, 钟山, 等. 针刺百会穴对膜迷路积水模型大鼠耳蜗形态及水通道蛋白2表达的影响[J]. 中华中医药杂志, 2016, 31(12): 5281-5284. JIANG L Y, WANG X Z, ZHONG S, et al. Effects of needling Baihui (GV20) on the morphology of cochlea and the AQP2 expression in rats with endolymphatic hydrops[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2016, 31(12): 5281-5284. |
| [3] |
史莹莺, 朱敏, 叶恬恬, 等. 电针干预豚鼠膜迷路积水的参数优选及其对耳蜗AQP2表达的影响[J]. 浙江中医药大学学报, 2020, 44(2): 133-139. SHI Y Y, ZHU M, YE T T, et al. Parametric optimization of electroacupuncture against endolymphatic hydrops in guinea pigs and its effects on cochlea aqp2 expression[J]. Journal of Zhejiang Chinese Medical University, 2020, 44(2): 133-139. |
| [4] |
马海珠, 钟时勋, 温雅. 醋酸去氨加压素对豚鼠耳蜗水通道蛋白2表达的调节作用[J]. 听力学及言语疾病杂志, 2014, 22(3): 286-289. MA H Z, ZHONG S X, WEN Y. The regulatory functions of aquaporin 2 by deamino arginine vasopression in cochleas of guinea pigs[J]. Journal of Audiology and Speech Pathology, 2014, 22(3): 286-289. DOI:10.3969/j.issn.1006-7299.2014.03.014 |
| [5] |
贾贤浩, 梁琴, 池涨才, 等. 豚鼠内淋巴积水早期低频听力损失的形态学变化[J]. 生理学报, 2012, 64(1): 48-54. JIA X H, LIANG Q, CHI Z C, et al. Morphological changes associated with low-tone hearing loss in guinea pig models of early endolymphatic hydrops[J]. Acta Physiologica Sinica, 2012, 64(1): 48-54. |
| [6] |
蒋丽元, 孙雪娇, 陈茜茜, 等. 艾灸听宫对大鼠膜迷路积水的影响[J]. 中华中医药学刊, 2017, 35(10): 2625-2629. JIANG L Y, SUN X J, CHEN X X, et al. Effects of moxibustion at Tinggong (SI19) on rats endolymphatic hydrops[J]. Chinese Archives of Traditional Chinese Medicine, 2017, 35(10): 2625-2629. |
| [7] |
罗炽琼, 李倩, 张琦. 苓桂术甘汤合泽泻汤对膜迷路积水豚鼠前庭膜AQP2表达的影响[J]. 中华中医药杂志, 2015, 30(2): 578-580. LUO C Q, LI Q, ZHANG Q. Effects of Linggui Zhugan Decoction combined with Zexie Decoction on the expression of AQP2 in vestibular membrane of guinea pig with membranous labyrinth hydrops[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2015, 30(2): 578-580. |
| [8] |
TEGGI R, CARPINI S D, ZAGATO L. Endolymphatic hydrops and ionic transporters: genetic and biohumoral aspects[J]. Journal of Neurology, 2019, 266(Suppl1): S47-S51. DOI:10.1007/s00415-019-09399-6 |
| [9] |
韩红蕾, 张连山, 顾凤明. 正常和膜迷路积水豚鼠内耳水通道蛋白的表达及意义[J]. 听力学及言语疾病杂志, 2010, 18(4): 363-366. HAN H L, ZHANG L S, GU F M. Expression of aquaporins in the inner ear of normal guinea pigs and guinea pigs with endolymphatic hydrops[J]. Journal of Audiology and Speech Pathology, 2010, 18(4): 363-366. DOI:10.3969/j.issn.1006-7299.2010.04.015 |
| [10] |
冷辉, 刘欣旭, 张琦. AQP2、AQP5蛋白在豚鼠膜迷路积水模型中表达及其相关性研究[J]. 临床军医杂志, 2020, 48(1): 8-11. LENG H, LIU X X, ZHANG Q. The expression and correlation of AQP2 and AQP5 proteins in the hydrocephalic model of guinea pig[J]. Clinical Journal of Medical Officers, 2020, 48(1): 8-11. |
| [11] |
TAKEDA T, TAKEDA S, KITANO H, et al. Endolymphatic hydrops induced by chronic administration of vasopressin[J]. Hearing Research, 2000, 140(1-2): 1-6. |
| [12] |
JIANG L Y, HE J J, CHEN X X, et al. Arginine vasopressin-aquaporin-2 pathway-mediated dehydration effects of electroacupuncture in guinea pig model of avp-nduced endolymphatic hydrops[J]. Chinese Journal of Integrative Medicine, 2019, 25(10): 763-769. |
| [13] |
游玉龙, 陈华德. 膜迷路积水豚鼠模型的研究进展[J]. 江西中医药大学学报, 2017, 29(1): 113-116. YOU Y L, CHEN H D. Advances in establishment of endolymphatic hydrops guinea pig models[J]. Journal of Jiangxi Chinese Medical University, 2017, 29(1): 113-116. |
2. Department of Otorhinolaryngology, Tianjin Medical University General Hospital, Tianjin 300050, China;
3. Key Laboratory of Hormones and Development of Ministry of Health, Institute of Endocrinology of ZHU Xianyi Memorial Hospital of Tianjin Medical University, Tianjin 300134, China
 2021, Vol. 38
2021, Vol. 38