文章信息
- 吕清波, 潘均华, 王玉晶, 徐津鹏, 王怡, 舒乐新
- LYU Qingbo, PAN Junhua, WANG Yujing, XU Jinpeng, WANG Yi, SHU Lexin
- 通脉养心丸对阿霉素慢性心脏毒性大鼠的保护作用研究
- Study on the protective effect of Tongmai Yangxin Pill on doxorubicin rats with chronic cardiac toxicity
- 天津中医药, 2021, 38(12): 1602-1608
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(12): 1602-1608
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.12.23
-
文章历史
- 收稿日期: 2021-08-10
2. 天津中新药业集团股份有限公司乐仁堂制药厂, 天津 300112
阿霉素是一种周期非特异性药物,对各种生长周期的肿瘤细胞都有杀灭作用,常作为一线抗肿瘤药物用于多种肿瘤的治疗,但阿霉素毒性较大,长期应用可导致机体脏器组织毒性损伤,其中临床上以心脏毒性损伤最常见,这限制了阿霉素的临床应用[1]。阿霉素导致的心脏毒性可分为急性、慢性和迟发性[2],急性心脏毒性可在治疗结束后2周内出现临床表现;慢性心脏毒性常发生在用药后1年内,表现为左心室功能障碍,病情呈进展性改变,最终可发展为心力衰竭;迟发性慢性心脏毒性在化疗结束后数年甚至数十年后才发生[3]。此外,阿霉素心脏毒性反应呈剂量依赖性[4],研究发现患者因服用阿霉素所诱发的心脏疾病事件随着阿霉素治疗累积剂量的增加而增加[5]。阿霉素致心脏毒性机制目前尚不明确,普遍认为是多因素共同作用的结果[6],如自由基的产生[7]、钙超载[8]、炎症反应[9]、线粒体损伤[10]、细胞凋亡[11]和细胞自噬[12-13]等。研究和防治阿霉素慢性心脏毒性具有重大意义。
目前西医防治阿霉素心脏毒性的药物较少,右雷佐生(DRZ)是唯一一种经美国食品药品监督管理局(FDA)批准的可减轻阿霉素引起的心脏毒性的药物[14],为打破治疗单一现状,许多研究者将目光转向中医药,并且发现中医药在减轻阿霉素引起的心脏毒性方面亦可发挥作用,通脉养心丸便是其一,通脉养心丸源于汉代张仲景《伤寒论》记载的炙甘草汤,后经由名老中医董晓初、阮士怡在经方炙甘草汤和生脉饮基础上进一步改良成的一种中成药[15-16]。临床上,通脉养心丸常用于治疗冠心病心绞痛、心律失常、心力衰竭等心血管疾病,并表现出了良好的临床效果[17]。此外黄景玉等[18]通过临床观察发现通脉养心丸可缓解阿霉素所致心脏损伤,改善患者的生活质量。现代药理研究发现,通脉养心丸具有较好的氧自由基清除能力,可减轻氧化应激损伤,可通过抑制炎症因子的表达来发挥抗炎作用[19],此外,还可通过抑制钙超载来减少心肌细胞的凋亡[20]。本研究将通过建立阿霉素致慢性心脏毒性大鼠模型,探讨通脉养心丸对阿霉素慢性心脏毒性大鼠的保护作用,期望为研究阿霉素致心脏毒性动物研究提供参考,为通脉养心丸拮抗阿霉素致慢性心脏毒性的临床应用提供依据。
1 实验材料 1.1 主要仪器万分之一天平(型号:BP121S,德国Sartorius公司);Ⅱ导联心电图(型号:ML408,天津开发区福斯特科技发展有限公司);电子天平(型号:TD5002G,天津天马衡基仪器有限公司);全自动生化分析仪(型号:ZSE,日本日立公司);Visual Sonics Vevo® 2100小动物超声成像系统(加拿大)。
1.2 药品及试剂通脉养心丸(批号:1070353,天津中新药业集团乐仁堂制药厂);阿霉素(批号:427D023,索莱宝公司);羧甲基纤维素纳(CMC-Na,批号:C8621,北京索莱宝科技有限公司);异氟烷(批号:C002160404,河北一品制药股份有限公司);肌酸激酶(CK,YZB/0695-2010中生北控生物科技股份有限公司);乳酸脱氢酶(LDH)(A006-2中生北控生物科技股份有限公司)。
1.3 实验动物Wistar大鼠,雄性,体质量(200±20)g,SPF级,由北京维通利华实验动物技术有限公司提供,许可证编号:SCXK(京)2016-0006。
2 实验方法 2.1 实验分组及给药健康的雄性Wistar大鼠共44只,按随机数字表法随机分为3组,分别为:空白对照组(n=8),模型组(n=24)和给药组(n=12)。分笼喂养,各组大鼠均给予普通饮食,自由饮水,记录所有大鼠每次给药前后体质量,同时观察大鼠的一般状况。
空白对照组:按体质量2.5 mg/kg腹腔注射生理盐水,每周1次,持续注射8周。按体质量10 mL/kg灌胃CMC-Na,每日1次,连续8周。
模型组:参照文献方法[21],用生理盐水将阿霉素粉剂溶解成0.1 mg/mL的溶液,按体质量2.5 mg/kg腹腔注射阿霉素溶液,每周1次,连续8周,阿霉素累积剂量20 mg/kg;按体质量10 mL/kg灌胃CMC-Na,每日1次,连续8周。
给药组:按体质量2.5 mg/kg腹腔注射阿霉素,每周1次,持续注射8周,阿霉素剂量20 mg/kg;用CMC-Na将通脉养心丸溶解成0.1 g/mL溶液,给药组按体质量1 g/kg灌胃通脉养心丸溶液,每日1次,连续8周。
8周后各组均停药,连续观察2周。期间每天喂养,观察记录。
2.2 大鼠一般状态观察整个实验过程中详细记录大鼠的体质量,饮水量和饮食量,每周称质量2次以便调整给药量。观察各组大鼠的精神状态、毛色光泽、活动强度,体毛有无脱落,粪便,是否腹泻等情况,同时记录各组大鼠死亡情况。
2.3 大鼠心电图检测实验开始前先将各组大鼠进行心动图检测,实验开始第1、4、8及10周分别对大鼠进行心电图检测,异氟烷气体麻醉大鼠,麻醉后仰卧位固定大鼠,再将相应电极插入到右上肢及左下肢皮下,记录大鼠心电图数据。
2.4 大鼠超声心动检测第1、4、8及10周对大鼠进行心动超声检测。将大鼠胸部褪毛,称质量标记,用异氟烷麻醉大鼠,麻醉后用胶带将大鼠腹部向上固定于操作台,均匀涂抹一层超声耦合剂于大鼠胸部,通过调整操作台位置,得到最佳的左心室,主动脉和二尖瓣瓣叶,获得图像。位置不变,选取M型超声长轴切面,获得M型图像,连续采集15 s,进行测量。获得左室射血分数(EF)、左室短轴缩短率(FS)、左室舒张末期内径(LVIDd)和左室收缩末期内径(LVIDs)数值。
2.5 大鼠心脏指数第10周将大鼠处死,迅速开胸,先找到腹主动脉,再沿主动脉根部游离出心脏,用手术剪将大血管残端、筋膜和脂肪组织剔除,分离出全心,用预先配制好的生理盐水冲洗去残留的血液,用滤纸将水分吸干,在分析天平上称量全心湿质量,并根据以下公式计算心脏指数。
心脏指数(%)=全心湿质量(g)/大鼠体质量(g)×100%。
2.6 心肌酶学生化检测第1、4及8周大鼠眼眶取血;第10周大鼠腹主动脉取血。取血后标记,静置30 min,3 500 r/min,离心半径8.3 cm,离心10 min,取血清分装于1.5 mL离心管,一部分-4 ℃冰箱冷藏,24 h之内用全自动生化检查仪进行CK及LDH的检测。另一部分置于-80 ℃冰箱冷冻保存,备用。
2.7 大鼠心肌组织形态学观察第10周将各组大鼠处死,分离心脏,迅速取心脏,用甲醛液固定,待组织完全固定后,经过修整、常规脱水、组织透明、包埋、切片和苏木素-伊红(HE)染色等实验操作后,制成病理切片,在光镜下观察心肌组织形态学改变。
2.8 结果统计学处理使用SPSS 24.0统计软件系统进行分析,各组的数据结果用均值±标准差(x±s)表示,多组间均数比较采用单因素方差分析(One-way,ANOVA),组间两两比较采用LSD法。P < 0.05为差异有统计学意义。
3 实验结果 3.1 大鼠的一般状态变化模型组大鼠精神状况较差,先出现狂躁,后变得喜蜷缩,甚至出现精神萎靡,毛色失去光泽,饮食量下降,活动强度减弱,消瘦等,但给予通脉养心丸治疗后,大鼠一般情况好转,给药组大鼠精神情况较好于模型组。各组大鼠体质量在第4周时逐渐增长,但与空白对照组相比,模型组及给药组体质量低于空白对照组大鼠体质量,增长较慢。各组大鼠平均周饮食量、饮水量比较无统计学差异(P > 0.05)。见图 1。
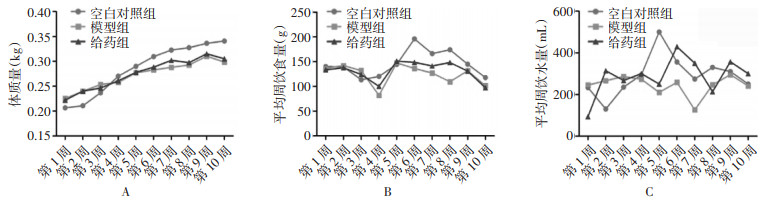
|
| 注:A.大鼠体质量变化率;B.平均每周饮食量;C.平均每周饮水量。 图 1 大鼠一般情况变化(x±s) Fig. 1 Changes in general conditions of rats(x±s) |
给予阿霉素4周时,空白对照组大鼠死亡3只;模型组大鼠死亡3只;给药组大鼠死亡3只。给予阿霉素8周时,模型组大鼠死亡5只;给药组大鼠死亡4只。给予阿霉素10周时,模型组大鼠死亡7只,给药组大鼠死亡5只。其中空白组大鼠是在心电图及超声检测时麻醉而死亡,模型组及给药组大鼠由于阿霉素的作用,腹泻严重,体质较差而死亡。
3.2 大鼠心电图检测结果第1周,与模型组相比,给药组呼吸频率(RR)间期显著缩短(P < 0.01),心率显著升高(P < 0.01),差异均具有统计学意义。第4周,与空白对照组相比,模型组RR间期显著延长(P < 0.01)、心率显著降低(P < 0.01);与模型组相比,给药组RR间期缩短(P < 0.05),心率升高(P < 0.05),差异均具有统计学意义;第8周,测定结果无统计学差异(P > 0.05);第10周,与空白对照组相比,模型组QRS间期延长(P < 0.05),差异具有统计学意义。见图 2。
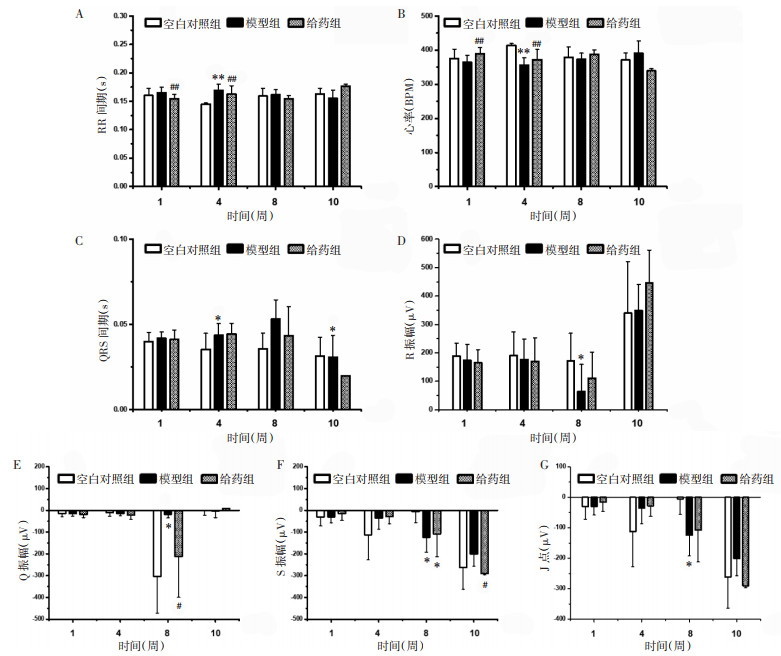
|
| 注:与空白对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。 图 2 心电图变化结果(x±s) Fig. 2 Results of ECG changes(x±s) |
给药第1周,与模型组比较,给药组LVIDd增高(P < 0.01),差异具有统计学意义;给药第4周,与空白对照组相比,模型组EF、FS显著降低(P < 0.01),LVIDs、LVIDd显著增高(P < 0.01),差异均具有统计学意义;与模型组相比,给药组FS显著增高(P < 0.05),差异具有统计学意义。给药第8周,与空白对照组相比,模型组EF降低(P < 0.05),FS显著降低(P < 0.01),LVIDs增高(P < 0.05),差异均具有统计学意义;第10周,与空白对照组相比,模型组与给药组EF、FS显著降低(P < 0.01),差异具有统计学意义。见图 3。
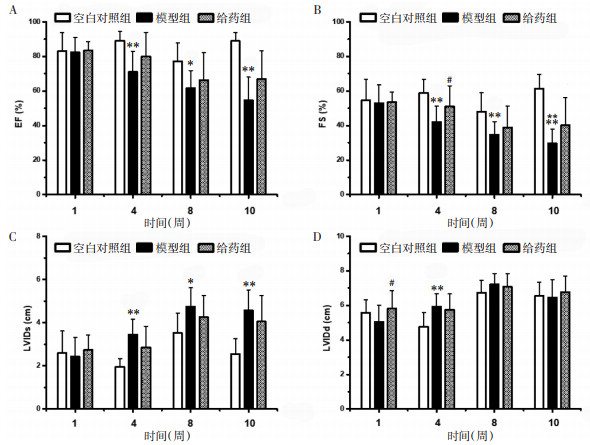
|
| 注:A.EF;B.FS;C.LVIDs;D.LVIDd。与空白对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05。 图 3 超声心动图检测结果(x±s) Fig. 3 Results of echocardiography(x±s) |
与空白对照组比较,模型组大鼠的心脏质量显著降低(P < 0.01),差异具有统计学意义;心脏指数组间差异无统计学意义。见图 4。
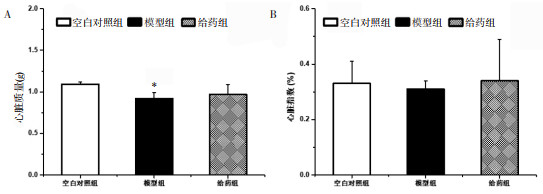
|
| 注:A.心脏质量;B.心脏指数。与空白对照组相比,*P<0.01。 图 4 大鼠心脏指数的检测结果(x±s) Fig. 4 Results of cardiac index of rats(x±s) |
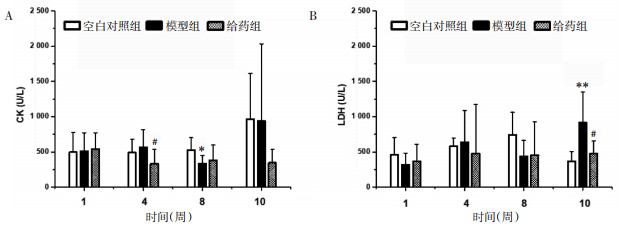
给药第1周,各组比较差异均无统计学意义;给药第4周,与模型组相比,给药组CK水平降低(P < 0.05),差异具有统计学意义。给药第10周,与空白对照组相比,模型组LDH增高(P < 0.01);与模型组相比,给药组LDH降低(P < 0.05),差异均具有统计学意义。见图 5。
|
| 注:A.CK;B.LDH。与空白对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05。 图 5 大鼠血清心肌酶检测结果(x±s) Fig. 5 Serum myocardial enzyme test results of rats(x±s) |
HE染色可见空白对照组大鼠心肌细胞排列整齐,心肌间隙正常,无炎性细胞浸润;模型组心肌细胞排列紊乱,出现不同程度的空泡变性与水肿,细胞间隙较对照组明显增宽,大量炎性细胞浸润,部分肌原纤维溶解,心肌纤维断裂;给药组心肌细胞排列较整齐,少量空泡和水肿出现,少量炎性细胞浸润,心肌细胞间隙明未见明显增宽。见图 6。

|
| 图 6 大鼠心肌组织HE染色结果 Fig. 6 HE staining results of rat myocardial tissue |
根据阿霉素致心脏毒性的临床表现,可将其归属为中医的“心悸”[22],病机为虚实两端,气虚为本,因虚致实,辨证分型为气阴两虚,脉络瘀阻[23]。通脉养心丸由地黄、鸡血藤、麦冬、甘草、五味子、党参等11味中药组成,具有益气养阴、通脉止痛之功,对冠心病兼有心悸、心律失常之气阴两虚证有很好的治疗效果。通过观察通脉养心丸对大鼠原代心肌细胞缺氧损伤作用发现,通脉养心丸能够显著上调超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH)活性,降低丙二醛(MDA)含量及炎性因子白介素6、白介素1β浓度[19-20],这表明通脉养心丸可降低缺氧诱导的心肌细胞内钙离子浓度的升高以及心肌细胞凋亡。
目前,较为常见的评价蒽环类药物心脏毒性的指标是超声心动图,用其显示的EF值和FS值降低来评估心脏功能受损[24-26]。本次实验结果表明,第4、8、10周时模型组较空白对照组EF、FS显著降低,给药组LVIDs升高,给药组与模型组相比FS显著增高,表明服用通脉养心丸后,阿霉素大鼠心脏功能改善;CK、LDH是评价心肌损害程度的客观指标,阿霉素可引起血清中CK、LDH水平升高。模型组CK水平呈上升趋势,给予通脉养心丸后CK水平呈下降趋势,模型组LDH水平呈明显上升趋势,给予通脉养心丸4周后LDH呈下降趋势,说明通脉养心丸可减轻阿霉素致心脏毒性大鼠的心肌损伤;此外,与空白对照组比较,模型组与给药组大鼠的心脏质量显著降低,给药后其心脏质量及心脏指数均呈上升趋势,差异有统计学意义,说明通脉养心丸能改善阿霉素大鼠左心室结构,增强心脏功能。综合以上结果,表明通脉养心丸能有效抑制阿霉素对心肌组织的毒性损伤作用,改善阿霉素导致的慢性心脏毒性。
通过对给药不同时间段的药效学指标进行评价,明确了阿霉素诱导的慢性心脏毒性的阿霉素累积剂量范围,通过通脉养心丸进行干预,结果显示通脉养心丸对阿霉素的慢性毒性有一定的保护作用。但由于本实验只是作为观察通脉养心丸是否对阿霉素心脏毒性有保护作用的一个初期探讨,在实验中只设计了同于临床有效剂量的中剂量组,接下来将围绕通脉养心丸的不同给药剂量对阿霉素慢性心脏毒性的影响进行探讨,并探讨通脉养心丸保护阿霉素慢性心脏毒性作用机制。
| [1] |
PEREZ I E, TAVERAS A S, HERNANDEZ G A, et al. Cancer therapy-related cardiac dysfunction: an overview for the clinician[J]. Clinical Research in Cardiology, 2019, 13: 1179546819866445. |
| [2] |
马军, 朱军, 石远凯, 等. 脂质体阿霉素治疗恶性淋巴瘤和多发性骨髓瘤的中国专家共识(2019年版)[J]. 临床肿瘤学杂志, 2019, 24(5): 445-453. MA J, ZHU J, SHI Y K, et al. Clinical significance of liposomal adriamycin in the treatment of malignant lymphoma and multiple myeloma[J]. Chinese Clinical Oncology, 2019, 24(5): 445-453. DOI:10.3969/j.issn.1009-0460.2019.05.012 |
| [3] |
石远凯, 巴一, 冯继锋, 等. 中国蒽环类药物特性专家共识[J]. 中国肿瘤临床, 2018, 45(3): 110-112. SHI Y K, BA Y, FENG J F, et al. Anthracyclines in China[J]. Chinese Journal of Clinical Oncology, 2018, 45(3): 110-112. |
| [4] |
TORO-SALAZAR O H, FERRANTI J, LORENZONI R, et al. Feasibility of echocardiographic techniques to detect subclinical cancer therapeutics-related cardiac dysfunction among high-dose patients when compared with cardiac magnetic resonance imaging[J]. Journal of the American Society of Echocardiography, 2016, 29(2): 119-131. DOI:10.1016/j.echo.2015.10.008 |
| [5] |
WENNINGMANN N, KNAPP M, ANDE A, et al. Insights into doxorubicin-induced cardiotoxicity: molecular mechanisms, preventive strategies, and early monitoring[J]. Molecular Pharmacology, 2019, 96(2): 219-232. DOI:10.1124/mol.119.115725 |
| [6] |
顾觉奋. 多柔比星毒副作用机制及其防治研究进展[J]. 国外医药(抗生素分册), 2017, 38(4): 145-151. GU J F. Current views on the mechanism of doxorubicin-induced cardiotoxicity and its prevention[J]. World Notes on Antibiotics, 2017, 38(4): 145-151. DOI:10.3969/j.issn.1001-8751.2017.04.001 |
| [7] |
SONGBO M, LANG H, XINYONG C, et al. Oxidative stress injury in doxorubicin-induced cardiotoxicity[J]. Toxicology Letters, 2019, 307: 41-48. DOI:10.1016/j.toxlet.2019.02.013 |
| [8] |
XIONG C, WU Y Z, ZHANG Y, et al. Protective effect of berberine on acute cardiomyopathy associated with doxorubicin treatment[J]. Oncology Letters, 2018, 15(4): 5721-5729. |
| [9] |
WEI S, MA W, LI X, et al. Involvement of ROS/NLRP3 inflammasome signaling pathway in doxorubicin-induced cardiotoxicity[J]. Cardiovascular Toxicology, 2020, 20(5): 507-519. DOI:10.1007/s12012-020-09576-4 |
| [10] |
OSATAPHAN N, PHROMMINTIKUL A, CHATTIPAKORN S C, et al. Effects of doxorubicin-induced cardiotoxicity on cardiac mitochondrial dynamics and mitochondrial function: insights for future interventions[J]. Journal of Cellular and Molecular Medicine, 2020, 24(12): 6534-6557. DOI:10.1111/jcmm.15305 |
| [11] |
LI Z, CHINNATHAMBI A, ALI ALHARBI S, et al. Plumbagin protects the myocardial damage by modulating the cardiac biomarkers, antioxidants, and apoptosis signaling in the doxorubicin-induced cardiotoxicity in rats[J]. Environmental Toxicology, 2020, 35(12): 1374-1385. DOI:10.1002/tox.23002 |
| [12] |
ZHANG J, WANG M, DING W, et al. Resolvin E1 protects against doxorubicin-induced cardiotoxicity by inhibiting oxidative stress, autophagy and apoptosis by targeting AKT/mTOR signaling[J]. Biochemical Pharmacology, 2020, 180: 114188. DOI:10.1016/j.bcp.2020.114188 |
| [13] |
GUO Z, TANG N, LIU F Y, et al. TLR9 deficiency alleviates doxorubicin-induced cardiotoxicity via the regulation of autophagy[J]. Journal of Cellular and Molecular Medicine, 2020, 24(18): 10913-10923. DOI:10.1111/jcmm.15719 |
| [14] |
DENG S, YAN T, JENDRNY C, et al. Dexrazoxane may prevent doxorubicin-induced DNA damage via depleting both topoisomerase Ⅱ isoforms[J]. BMC Cancer, 2014, 14: 842. DOI:10.1186/1471-2407-14-842 |
| [15] |
CHEN R, CHEN T, WANG T, et al. Tongmai Yangxin Pill reduces myocardial No-reflow via endothelium-dependent NO-cGMP signaling by activation of the cAMP/PKA pathway[J]. Journal of Ethnophar- macology, 2021, 267: R96. |
| [16] |
CHEN R, CHEN T, WANG T, et al. Tongmai Yangxin Pill reduces myocardial no-reflow by regulating apoptosis and activating PI3K/Akt/eNOS pathway[J]. Journal of Ethnopharmacology, 2020, 261: R96. |
| [17] |
王建茹, 朱明军, 王新陆, 等. 通脉养心丸治疗室性早搏随机对照试验的系统评价[J]. 中药药理与临床, 2020, 36(2): 215-220. WANG J R, ZHU M J, WANG X L, et al. Tongmai Yangxin Pill in the treatment of ventricular premature beats: a systematic review of randomized clinical trails[J]. Pharmacology and Clinics of Chinese Materia Medica, 2020, 36(2): 215-220. |
| [18] |
黄景玉, 黄博. 通脉养心丸治疗阿霉素所致心脏损伤的疗效观察[J]. 中西医结合心脑血管病杂志, 2019, 17(14): 2186-2188. HUANG J Y, HUANG B. Effect of Tongmai Yangxin Pill in the treatment of cardiac injury caused by adriamycin[J]. Chinese Journal of Integrative Medicine on Cardio/Cerebrovascular Disease, 2019, 17(14): 2186-2188. DOI:10.12102/j.issn.1672-1349.2019.14.033 |
| [19] |
王怡, 张玲, 肖扬, 等. 通脉养心丸对缺氧诱导心肌细胞损伤炎症因子及氧化应激的影响[J]. 中医杂志, 2011, 52(4): 326-328. WANG Y, ZHANG L, XIAO Y, et al. Effect of Tongmai Yangxin Pill on inflammatory factors and oxidative stress of cardiomyocyte injury induced by hypoxia[J]. Journal of Traditional Chinese Medicine, 2011, 52(4): 326-328. |
| [20] |
肖扬, 张家福, 张玲, 等. 从钙超载角度探讨通脉养心丸心肌保护作用的机制[J]. 中西医结合心脑血管病杂志, 2011, 9(5): 562-563. XIAO Y, ZHANG J F, ZHANG L, et al. Investigation of protection mechanism of Tongmai Yangxin Pill on myocardium from the perspective of calcium overload[J]. Chinese Journal of Integrative Medicine on Cardio/Cerebrovascular Disease, 2011, 9(5): 562-563. DOI:10.3969/j.issn.1672-1349.2011.05.030 |
| [21] |
徐建虎, 张琦, 杨子庆, 等. 阿霉素诱导大鼠慢性心衰模型的制备[J]. 宁夏医科大学学报, 2016, 38(3): 348-351. XU J H, ZHANG Q, YANG Z Q, et al. The preparation of chronic heart failure model induced by adriamycin in rats[J]. Journal of Ningxia Medical University, 2016, 38(3): 348-351. |
| [22] |
李田宏. 蒽环类药物所致心脏毒性与中医证型相关性及中药防治的临床研究[D]. 沈阳: 辽宁中医药大学, 2019. LI T H. Anthracycline-induced cardiotoxicity and its correlation with TCM syndrome types and clinical study on the prevention and treatment of TCM[D]. Shenyang: Liaoning University of Traditional Chinese Medicine, 2019. |
| [23] |
郭金栋. 益气活血方对阿霉素心肌损伤大鼠SOD、MDA、CK-MB影响的实验研究[D]. 昆明: 云南中医学院, 2016. GUO J D. Effect of Yiqi Huoxue Recipe on SOD, MDA and CK-MB in rat myocardial injure with adriamycin[D]. Kunming: Yunnan University of Chinese Medicine, 2016. |
| [24] |
GEORGIADIS N, TSAROUHAS K, REZAEE R, et al. What is considered cardiotoxicity of anthracyclines in animal studies[J]. Oncology Reports, 2020, 44(3): 798-818. DOI:10.3892/or.2020.7688 |
| [25] |
ZAMORANO J L, LANCELLOTTI P, RODRIGUEZ MUNOZ D, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC)[J]. European Heart Journal, 2016, 37(36): 2768-2801. |
| [26] |
ZACCHIGNA S, PALDINO A, FALCAO-PIRES I, et al. Toward standardization of echocardiography for the evaluation of left ventricular function in adult rodents: a position paper of the ESC working group on myocardial function[J]. Cardiovascular Research, 2020, 117(1): 43-59. |
2. Tianjin Zhongxin Pharmaceutical Group Co., Ltd. Le Ren Tang Pharmaceutical Factory, Tianjin 300112, China
 2021, Vol. 38
2021, Vol. 38




