文章信息
- 高利兴, 王丽明, 隋洪飞, 韩立峰
- GAO Lixing, WANG Liming, SUI Hongfei, HAN Lifeng
- 荷叶碱降尿酸的1H-NMR代谢组学研究
- Metabolomic study on regulation of uric acid by nuciferine based on 1H-NMR spectra
- 天津中医药, 2021, 38(12): 1614-1620
- Tianjin Journal of Traditional Chinese Medicine, 2021, 38(12): 1614-1620
- http://dx.doi.org/10.11656/j.issn.1672-1519.2021.12.25
-
文章历史
- 收稿日期: 2021-08-21
2. 天津中医药大学, 组分中药国家重点实验室, 天津 301617
近年来,随着社会经济的发展,人们生活方式和饮食结构发生了很大改变,高尿酸血症作为一种代谢性疾病,其发病率持续升高,严重危害患者身体健康。高尿酸血症是一种嘌呤代谢异常引起的疾病,是导致痛风发病的主要诱导因素和直接病因,高尿酸血症还可诱发中风、糖尿病、冠心病和脑血管病、冠状动脉疾病、肾脏损伤等严重性疾病[1-3]。高尿酸血症的特点是在正常嘌呤饮食状态下,非同日两次测空腹血尿酸水平男性为血清尿酸盐大于70 mg/L,女性为大于60 mg/L[4]。高尿酸血症的危害除了引发痛风外[5-6],还可加重冠心病或高血压病等病症[7-8]。此外,长期高尿酸血症可破坏胰腺β细胞功能而诱发糖尿病[9]。大量尿酸长期从肾小管通过,形成尿酸结晶、结石沉积于肾脏,还会引发痛风性肾病,肾功能损害,甚至尿毒症[10-12]。
荷叶碱是荷叶中主要的阿朴啡型生物碱,为荷叶生物碱中主要活性成分[13-14]。近年来,荷叶碱的药理作用日益显著,有文献报道在小鼠高尿酸血症模型中,荷叶碱的抗高尿酸和抗炎作用是通过调节肾有机离子转运体和炎症信号通路发挥作用,但是荷叶碱对生命体整体代谢网络的影响仍有待进一步研究[15]。
代谢组学是一种被广泛应用于植物学、疾病诊断和毒理学等领域的系统研究方法[16-19]。代谢组学研究常用的样本有尿液、血浆或血清、唾液、脑脊液等生物体液及细胞提取物、细胞培养液和组织等,针对这些样本的代谢产物研究可以反映机体健康状态或疾病状态下的重要信息。目前,代谢组学技术分析方法有许多,应用最广泛的是气相色谱-质谱联用法(GC-MS)、液相色谱-质谱联用法(LC-MS)及核磁共振法(NMR)[20]。NMR作为代谢组学的一个重要研究手段,具有分析全面、样品制备简单、重现性好的特点,而且可以同时提供代谢物定性、定量两方面的信息[21]。
本研究主要运用核磁共振氢谱(1H-NMR)技术,将荷叶碱对氧嗪酸钾诱导的高尿酸小鼠的血浆和尿液进行非靶向代谢组学研究,较为系统地分析氧嗪酸钾诱导的高尿酸血症模型小鼠及荷叶碱治疗后的代谢物水平变化,通过多元统计分析找出变化显著的代谢物,揭示氧嗪酸钾诱导的高尿酸血症模型动物的潜在生物标志物,同时为探讨荷叶碱治疗高尿酸血症的作用机制提供参考。
1 实验材料 1.1 实验仪器Bruker ASCEND 500 MHz超导傅里叶变换核磁共振谱仪(瑞士Bruker公司);3K15型高速离心机(美国Sigma公司);XW-80A型涡旋混合器(上海沪西分析仪器厂);HSS型电热恒温水浴锅(上海博讯实业有限公司医疗设备厂);电热真空干燥箱(天津市天宇实验仪器有限公司);KQ-250E超声波清洗器(昆山市超声仪器有限公司)。
1.2 实验试剂重水(D2O,99.9%D)用于锁场(剑桥同位素实验室,美国);2,2,3,3,-d4-3(三甲基硅基)丙酸钠盐(TSP),阿法埃莎化学有限公司]用于化学位移定标及定量分析;超纯水(优级,屈臣氏公司);磷酸氢二钾(K2HPO4·3H2O,天津市光复科技发展有限公司);磷酸二氢钠(NaH2PO4·2H2O,天津市风船化学试剂科技有限公司);羧甲基纤维素钠(CMC-Na,天津市光复科技发展有限公司,用于溶解灌胃样品)。
1.3 实验药材荷叶碱标准品购自成都瑞芬思生物科技有限公司,纯度大于98%;氧嗪酸钾购自西格玛奥德里奇(上海)贸易有限公司,纯度大于98%。
1.4 实验动物昆明雄性小鼠24只,体质量为(20±2)g,由北京维通利华实验动物技术有限公司提供。小鼠在实验动物室进行为期1周的环境适应饲养,它们允许自由饮食及饮水,实验动物房条件为:温度:22~24 ℃,湿度:50%~65%的湿度,12 h光/暗周期。给药前12 h禁食不禁水。所有动物实验程序严格按照中国实验动物学会标准进行,并经天津中医药大学医学伦理委员会批准(小鼠合格证号:11400700389190)。
将荷叶碱和氧嗪酸钾分别溶解在0.5%的羧甲基纤维素钠混悬液中,根据前期研究,荷叶碱与氧嗪酸钾的给药剂量分别为25 mg/kg和200 mg/kg。
将小鼠按照每组8只随机分为空白组、模型组和荷叶碱组。在本实验中,空白组给予0.5%的羧甲基纤维素钠灌胃;荷叶碱组先给予氧酸钾灌胃,1 h后给予荷叶碱灌胃;模型组给予氧嗪酸钾灌胃;均连续灌胃14 d。对于尿液样品按照上述方法给药后第13天将3组小鼠分别放入代谢笼过夜24 h,收集尿液,14 000 r/min,离心10 min,离心半径10 cm,取上清液分装存放-80 ℃冰箱,冷冻待用;血浆样品在收集完尿样后按照上述方法给药后分别于2 h后眼眶静脉丛取血,7 000 r/min离心10 min,离心半径10 cm,取上清液,置于-80 ℃待测。
2 实验方法 2.1 核磁实验方法 2.1.1 缓冲溶液的配制0.045 mol/L K2HPO4- NaH2PO4缓冲溶液的配制:按照K2HPO4∶NaH2PO4的质量比为4∶1,加10%D2O和0.6 mmol/L TSP溶液溶解,用pH计调节pH=7.4用于血浆样品检测。
2.1.2 1.5 mol/L K2HPO4-NaH2PO4缓冲溶液的配制K2HPO4∶NaH2PO4=4∶1,加入10%的D2O及0.01%的TSP溶解,用pH计调节pH=7.4,用于尿样检测。
2.1.3 待测样品的配制将尿液放在室温下自然解冻,14 000 r/min离心10 min,离心半径10 cm,取上清液,550 μL尿液加入55 μL 1.5 mol/L K2HPO4- NaH2PO4的缓冲溶液,涡旋5 min,14 000 r/min离心5 min,离心半径10 cm,取上清液550 μL至5 mm核磁管中分析。将血浆样品放在室温下自然解冻,涡旋5 min,取200 μL血浆加入400 μL的0.045 mol/L K2HPO4-NaH2PO4的缓冲溶液,涡旋5 min,14 000 r/min离心5 min,取上清液550 μL至5 mm核磁管中分析。
2.1.4 NMR实验参数Bruker ASCEND 500 MHz采集1H-NMR谱,反相检测探头(BBI),采集温度为298 K,noesypr1d脉冲序列。此序列采用预饱和方式压制溶剂峰,从而抑制溶剂信号的检测。循环时间(D1),混合时间(D8)以及90°脉冲时间(P1)分别为2 s,0.2 s,12.91 μs,中心激发频率(O1P)为4.69 ppm,预饱和水峰压制功率(PLW9)为23 dB。采样点数为32 k,谱宽(SW)为10,330 Hz,扫描次数(NS)为160次。
2D NMR谱图均采用标准脉冲序列,其中包括COSY(1H-1H相关),HSQC,(1H-13C直接相关)HMBC(1H-13C远程相关),TOCSY(1H-1H全相关),J-RES(J-分辨光谱)。COSY脉冲序列为cosygpmfqf,梯度恢复时间(D16)为0.2 μs,F1(1H)和F2(1H)谱宽均为4 464.286 Hz,采样点数阵为t2×t1=2048×128,NS为128次,2k数据点。HSQC的脉冲序列为hsqcetgpsi,其F1(13C)和F2(1H)SW为2 0831.980 Hz和4 464.286 Hz,弛豫时间为1.457 811 s,采集时间为0.118 834 s,采集数据点阵t2×t1=1 024×256,NS为80次,1 k数据点。HMBC的脉冲序列为hmbcgpndqf,其F1(13C)和F2(1H)SW为27 932.973 Hz和4 464.286 Hz,弛豫时间为1.332 064 03 s,采集时间为0.475 186 s,预扫描延迟时间为6.50 μs,采集数据点阵t2×t1=4 096×256,NS为160次,4k数据点。TOCSY脉冲序列为mlevphpp,其F1(13C)和F2(1H)SW均为4 464.286 Hz,弛豫时间为1.898 965 s,采集时间为0.237 618 s,D8为0.08 s,采集数据点阵t2×t1=2 048×256,NS为100次。J-RES的脉冲序列为jresqf,弛豫时间为2 s,采集时间为0.102 450 s,F1和F2维SW分别为20.000 Hz和10 000.000 Hz,采样数据点阵为t2×t1=2 048×256,NS为32次,2 k数据点。
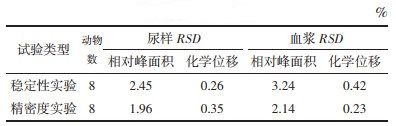
2.1.5 方法学考察本实验主要以样品某一特征峰对应的化学位移以及相对峰面积考察样品的稳定性及仪器的精密度。
稳定性实验:任意选取一个样品放置2﹑4﹑8﹑10﹑12﹑18﹑24及36 h后检测特征峰的化学位移和相对峰面积,分别计算RSD(相对标准偏差)值。
精密度实验:同一个样品连续采集6次1H-NMR谱图,计算特征峰的化学位移和相对峰面积RSD值。
2.1.6 数据处理与分析1D NMR及2D NMR图谱预处理使用Topspin(V3.5)软件,包括指数窗函数变换、相位校正及基线矫正﹑化学位移漂移矫正(使用TSP)。多元统计分析用1H-NMR数据处理采用MestReNova 9.0.1软件,线宽因子设为0.3 Hz,自由感应衰变为零填充到64 k数据点。除去TSP δ 0.00~0.02 ppm,水峰δ 4.65~4.85 ppm。核磁共振光谱区以0.003 ppm积分段对化学位移区间δ 0.45~12.50 ppm进行分段积分。积分所得数据进行归一化,并转换为二维矩阵,保存为CSV格式,使用SIMCA-P+(v14.0)软件进行多变量分析,主要通过PCA(主成分分析)和OPLS-DA(正交偏最小二乘法判别分析)模型进行分析。PCA模型主要看样本间分组趋势以及样本组内的离散程度;OPLS-DA模型主要得到得分散点图和pearson图。在得分散点图中,每一个点代表不同的样本,以样本类别为变量(Y)建立一个PLS(最小二乘)模型,并获得几个与Y不相关的自变量(X)信息并将其替换,从而提高了模型识别能力。其中主要包括R2X,Q2两个质量评价指标,越接近于1,代表预测的结果真实,模型可靠。在pearson图中,核磁共振光谱区颜色越红代表化合物差异越显著,从而揭示了不同实验方法中的代谢物的显著变化。将OPLS-DA模型所给出的每一个变量的VIP值中大于1的变量作为对模型分组贡献最大,并将此数据导出,结合t检验,筛选VIP > 1且P < 0.05的变量进行分析。
将上述所得到的潜在差异代谢物的信息,通过2D NMR谱图,数据库(Human Metabolome Database,https://hmdb.ca/)检索,以及Chenomx NMR Suite软件数据库(Chenomx Inc.)等方法进行结构鉴定。
3 实验结果 3.1 血浆尿酸检测结果将收集的血浆样品室温下自然解冻,涡旋5 min,混旋均匀,血浆中的尿酸水平用尿酸试剂盒进行检测,所有血浆样本均放于96孔板进行检测,血浆尿酸的处理方法按照试剂盒使用说明书所描述的方法在自动生化分析仪(TECAN,瑞士)中测量,2 h后结果空白组是(132.70±4.30)μmol/L、模型组是(188.14±4.81)μmol/L、荷叶碱组是(130.46±4.70)μmol/L,模型组与空白组相比(P < 0.01),荷叶碱组与模型组相比(P < 0.01),差异均具有统计学意义。
3.2 核磁实验结果 3.2.1 方法学考察样品稳定性实验特征峰的化学位移RSD值及相对峰面积RSD值如表 1所示,结果表明样品36 h内稳定。精密度实验血样和尿样的特征峰的化学位移RSD值和相对峰面积RSD值均小于5 %,说明仪器测量精密度良好。
|
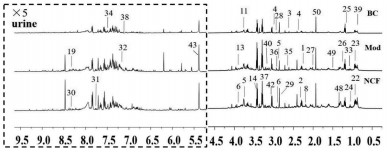
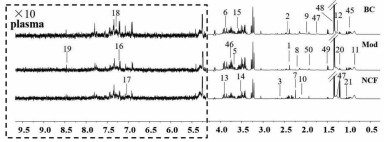
荷叶碱作用于氧嗪酸钾诱导的高尿酸血症小鼠的血浆和尿液的核磁共振图谱如图 1和2所示。其中δ 0.05~4.00 ppm为氨基酸及有机酸区,δ 4.00~5.50 ppm为碳水化合物区,δ 5.50~8.70 ppm为芳香区。代谢产物的鉴定主要是基于文献,在线数据库(HMDB)以及Chenomx软件,并结合2D NMR图谱进行分析,共筛选出50个化合物。
|
| 注:1.丙酮酸;2.琥珀酸;3.柠檬酸;4.2-酮戊二酸;5.二甲基甘氨酸;6.肌酸;8.乙酰乙酸;13.甜菜碱;14.甘氨酸;19.甲酸;22.丙二酸乙酯. 23.异戊基甘氨酸;24.丙酸;25.丙二酸甲酯;26.3-羟基异戊酸;27.N- 乙酰谷氨酸;28.肌酐;29.三甲胺;30.胡卢巴碱;31.苯甲酸;32.硫酸吲哚酚;33.乙醇;34.马尿酸;35.二甲胺;36.2-氧化戊二酸.37.牛磺酸;38.4-羟基苯乙酸;39.泛酸;40.胆碱;41.三甲胺N-氧化物;42.DMSO2;43.尿囊素;44.磷酰胆碱;48.乳酸;49.丙氨酸;50.乙酸。 图 1 空白组、模型组和荷叶碱组小鼠尿液样品的1H-NMR谱图 Fig. 1 1H-NMR spectra of mice urine samples in blank control group, model group and nuciferine treatment group |
|
| 注:1.丙酮酸;2.琥珀酸;3.柠檬酸;5.二甲基甘氨酸;6.肌酸;7.丙酮;8.乙酰乙酸;9.N-乙酰糖蛋白;10.O-乙酰糖蛋白;11.脂质;12.赖氨酸;13.甜菜碱;14.甘氨酸;15.甘油;16.酪氨酸;17.组氨酸;18.苯丙氨酸;19.甲酸;20.3-羟基丁酸酯;21.乙醚;45.缬氨酸;46.亮氨酸;47.异亮氨酸;48.乳酸;49.丙氨酸;50.乙酸。 图 2 空白组、模型组和荷叶碱组小鼠血浆样品的1H-NMR谱图 Fig. 2 1H-NMR spectra of mice plasma samples in blank control group, model group and nuciferine treatment group |
将荷叶碱作用于氧嗪酸钾诱导的高尿酸血症小鼠的血浆和尿液在1H-NMR采集的数据进行PCA分析,1H-NMR数据采样模式下PCA的R2X和Q2值见表 2。
将血浆样品和尿样采集的数据进行PCA分析,制作PCA分析的得分图,如图 3所示。在无监督模式的PCA分析下分组不太明显,无法明显区分不同组间的差异。然后利用有监督模式的正交偏最小二乘-判别分析进行分组比较分析。
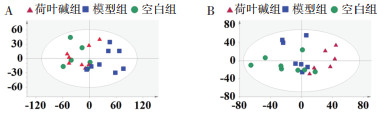
|
| 图 3 基于1H-NMR谱的尿液(A)和血浆(B)PCA分析得分图 Fig. 3 PCA scores plot of urine (A) and plasma (B) based on 1H-NMR spectra |
为进一步寻找给药前后荷叶碱作用于氧嗪酸钾诱导的高尿酸血症小鼠的血浆和尿液的影响,本实验采用OPLS-DA统计分析模型,用来寻找差异性化学成分,并利用得分图和载荷图表示,1H-NMR数据采样模式下OPLS-DA的不同分组和样品的模型结果参数见表 3,尿液和血浆样品的得分图及载荷图见图 4。

|
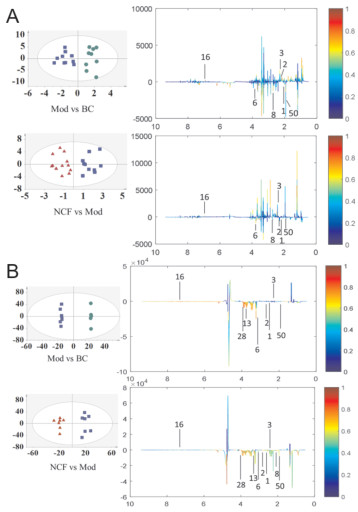
|
| 图 4 基于1H-NMR谱的尿液(A)和血浆(B)OPLS-DA得分图和载荷图 Fig. 4 OPLS-DA score plots and loading plots based on1HNMR spectrum of urine (A) and plasma (B) |
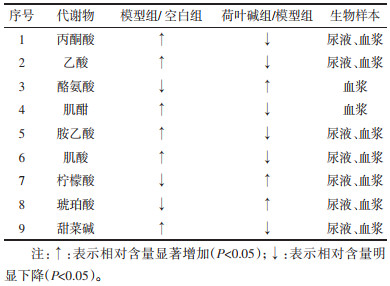
通过统计学数据分析,选择VIP > 1的化合物作为筛选荷叶碱作用于氧嗪酸钾诱导的高尿酸血症小鼠的血浆和尿液含量差异较大的化学成分,并根据候选差异化学成分在1H-NMR数据中的相对峰面积进行t检验分析,P < 0.05的数据可认为是潜在生物标志物,在血浆和尿液样品中共找到9个潜在生物标志物,9个生物标志物的变化趋势如表 4所示。
通过1H-NMR技术在血浆和尿液样品中共筛选出9个潜在生物标志物,为了进一步揭示这些差异代谢物之间的相关性,应用metaboanalyst网站(https://www.metaboanalyst.ca/)进行代谢通路富集分析,其中这9个潜在生物标志物均可以被数据库(KEGG,https://www.kegg.jp/)识别,涉及到多条代谢通路,结果如图 5所示,这些差异物主要涉及到酪氨酸代谢、柠檬酸代谢、精氨酸和脯氨酸代谢以及糖酵解和糖异生。
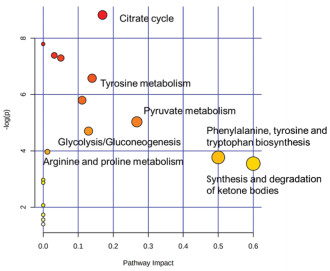
|
| 图 5 高尿酸血症相关代谢通路图 Fig. 5 Metabolic map of hyperuricemia-related pathways |
实验采用了核磁共振氢谱技术对正常对照小鼠、氧嗪酸钾诱导高尿酸血症模型小鼠,及荷叶碱给药治疗组小鼠的血浆、尿样进行了分析,实验分别考察了zgpr、cpmgpr1d及noesypr1d等脉冲序列,以及NS分别为64、160、200时的信号采集情况,同时考察了压水峰的功率PLW9分别为20、23、30、35 dB时的信号采集情况,结果表明,noesypr1d采集谱图信号较好,而且随着扫描次数的增加,血浆样品中特征峰的峰强度相应增强,但采样时间也相应增加,根据信号强度的变化并考虑实验时间等因素,最终选择采样次数为160次,通过调节预饱和压水峰的功率可以看出,当功率为23 dB时水峰的强度相对较小,对其他峰的影响也较小,样品的特征峰具有较强的峰强度和分辨率。
代谢物鉴定一般采用同核化学位移相关谱(COSY),异核单量子相关谱(HSQC),异核多键相关谱(HMBC),全相关谱(TOCSY)等常规二维谱,J-RES为一种通过J调制的自旋回波将化学位移与J耦合分开,从而使一维氢谱上重叠在一起的谱峰分散在平面上,是对拥挤谱峰指认的有效方法。本实验综合了各种二维谱及J-RES谱,实现了复杂谱峰的解析,为后续代谢通路分析提供数据支持。
本实验阐明高尿酸血症涉及的9个潜在生物标志物,它们涉及酪氨酸代谢、柠檬酸代谢、精氨酸和脯氨酸代谢以及糖酵解和糖异生等多个途径。
精氨酸和脯氨酸代谢途径:肌酐是肌酸的中间代谢产物,是骨骼肌的能量储备,通常在肾功能受损时观察到[22]。甜菜碱广泛分布于动物,植物和微生物中,也是动物胆碱氧化的代谢产物,甜菜碱是肌酐下游的代谢产物[23]。在模型组中,肌酐、肌酸、甜菜碱的含量升高,说明肾功能遭到破坏;而荷叶碱治疗组又恢复到正常水平,表明高尿酸血症干扰了精氨酸和脯氨酸代谢途径,荷叶碱具有较好的治疗效果。
酪氨酸代谢途径:酪氨酸是生酮生糖氨基酸,苯丙氨酸4-单加氧酶(PAH基因编码蛋白)是关键酶,PAH蛋白功能可以催化苯丙氨酸转化为酪氨酸,同时,苯丙氨酸在芳香族L-氨基酸脱羧酶的作用下转化为苯乙胺,模型组中酪氨酸含量降低,而荷叶碱组的含量升高至正常水平,说明高尿酸血症使酪氨酸代谢发生紊乱。
柠檬酸代谢途径:柠檬酸是三羧酸循环的代谢产物,主要存在于线粒体中,是能量代谢的中心。柠檬酸裂解酶是柠檬酸转化为醋酸盐的关键酶,柠檬酸含量降低,醋酸盐含量升高可能是柠檬酸酶被激活,使柠檬酸加速转化为醋酸盐。琥珀酸盐是三羧酸(TCA)循环的重要中间体,位于代谢途径的十字路口。在线粒体中,它在产生三磷酸腺苷中起关键作用,在模型组中琥珀酸的含量降低,而荷叶碱组又恢复到正常水平,提示高尿酸血症使能量代谢发生异常,而荷叶碱能够纠正这种异常。
糖酵解和糖异生途径:丙酮酸是糖代谢中具有关键作用的中间产物。它可以通过乙酰辅酶A和三羧酸循环实现体内糖、脂肪和氨基酸间的互相转化,为机体提供能量。与BC相比,丙酮酸的含量在模型组中增加,表明体内的能量代谢发生紊乱。
由于实验采用核磁共振氢谱法进行检测,该方法虽然通用,但也存在一定的不足,比如高尿酸血症典型特征为尿酸的升高,而尿酸的化学结构为7,9-二氢-2,6,8(3H)三酮-1H-嘌呤,该化合物含有4个氢,均为活泼氢,在核磁共振谱上未出现信号,最终导致该化合物未被检出,这提示1H-NMR代谢组学应与其他代谢组学技术(如LC-MS、GC-MS代谢组)相结合,取长补短,最终更加全面的反应生命体代谢特征。
5 结论荷叶具有升发清阳,凉血止血的功效,临床上主要用于治疗用于暑热烦渴,暑湿泄泻,脾虚泄泻,血热吐衄,便血崩漏等症。最近研究表明其主要成分荷叶碱具有显著降尿酸效果,但关于其药效的核磁代谢组学研究却鲜有报道。本研究首先建立基于核磁共振氢谱技术的代谢组学研究方法,分别优化了脉冲序列,采样扫描次数,预饱和压水峰脉冲功率等参数,最终确定最佳数据采集方法。在此基础上,本研究对小鼠的血浆和尿液进行代谢组学研究,较为系统地分析了氧嗪酸钾诱导的高尿酸血症模型小鼠的代谢特征,同时比较了经荷叶碱治疗后的代谢物变化差异,综合运用主成分分析及偏最小二乘法判别分析等多元统计分析方法,挖掘模型组与正常组及给药组与模型组之间变化显著的差异代谢物。在化合物的鉴定方面,本研究主要采用COSY、HSQC、HMBC、TOCSY等多种核磁二维谱技术,以及J-分辨谱,最终成功鉴定了50个化合物。多元统计结果显示:从各组别中共筛选出与高尿酸血症代谢通路密切相关的9个潜在生物标志物,分别为:丙酮酸、乙酸、酪氨酸、肌酸酐、乙酰乙酸、肌酸、柠檬酸、琥珀酸,以及甜菜碱。对这些代谢物进行进一步的通路富集分析说明了高尿酸血症的病理过程主要涉及到酪氨酸代谢、柠檬酸代谢、精氨酸与脯氨酸代谢以及糖酵解和糖异生代谢途径,预示着这些潜在生物标志物不仅在早期疾病诊断中起重要作用,而且在预防高尿酸血症中也有重大意义。
| [1] |
马艳菊, 朱润秀. 尿酸及高尿酸血症与血管性疾病[J]. 内蒙古医学杂志, 2019, 51(1): 35-37. MA Y J, ZHU R X. Uric acid, hyperuricemia and vascular diseases[J]. Inner Mongolia Medical Journal, 2019, 51(1): 35-37. |
| [2] |
孙佳. 治疗痛风和高尿酸血症药物进展[J]. 中国处方药, 2019, 17(1): 28-29. SUN J. Development of anti-gout and hyperuricemia drugs[J]. Journal of China Prescription Drug, 2019, 17(1): 28-29. DOI:10.3969/j.issn.1671-945X.2019.01.018 |
| [3] |
张雷, 闫成芸, 许净, 等. 高尿酸血症与冠心病相关性的研究进展[J]. 河南大学学报(医学版), 2018, 37(2): 82-85, 89. ZHANG L, YAN C Y, XU J, et al. Research progress on the relationship between hyperuricemia and coronary heart disease[J]. Journal of Henan University (Medical Science), 2018, 37(2): 82-85, 89. |
| [4] |
WORTMANN R L. Gout and hyperuricemia[J]. Current Opinion in Rheumatology, 2002, 14(3): 281-286. DOI:10.1097/00002281-200205000-00015 |
| [5] |
安玉芳, 李义, 王浩, 等. 痛风汤对高尿酸血症模型大鼠肾脏功能的影响[J]. 中国中医药科技, 2018, 25(1): 28-29, 59. AN Y F, LI Y, WANG H, et al. Effects of Tongfeng Tang on renal function in rats with hyperuricemia[J]. Chinese Journal of Traditional Medical Science and Technology, 2018, 25(1): 28-29, 59. |
| [6] |
SATO V H, SUNGTHONG B, RINTHONG P O, et al. Pharmacological effects of Chatuphalatika in hyperuricemia of gout[J]. Pharmaceutical Biology, 2018, 56(1): 76-85. DOI:10.1080/13880209.2017.1421235 |
| [7] |
马聪敏, 韩月珍, 刘瑞华. 高尿酸血症与脑血管病的相关性研究及其机制[J]. 中风与神经疾病杂志, 2015, 32(5): 476-477. MA C M, HAN Y Z, LIU R H. Study on the relationship between hyperuricemia and cerebrovascular disease[J]. Journal of Apoplexy and Nervous Diseases, 2015, 32(5): 476-477. |
| [8] |
KUWABARA M. Hyperuricemia, cardiovascular disease, and hypertension[J]. Pulse, 2016, 3(3-4): 242. |
| [9] |
刘静. 糖尿病患者高尿酸血症的发生及对并发症的影响[J]. 医学理论与实践, 2019, 32(3): 421-422. LIU J. Occurrence of hyperuricemia in diabetic patients and its influence on complications[J]. The Journal of Medical Theory and Practice, 2019, 32(3): 421-422. |
| [10] |
雷三霞, 于长国, 曾春艳. 高尿酸血症与肾损害相关性研究进展[J]. 医学综述, 2014, 20(10): 1775-1777. LEI S X, YU C G, ZENG C Y. Research progress in hyperuricemia associated with kidney damage[J]. Medical Recapitulate, 2014, 20(10): 1775-1777. |
| [11] |
陈芳, 李素梅. 高尿酸血症对肾脏损害的研究进展[J]. 临床与病理杂志, 2016, 36(3): 285-289. CHEN F, LI S M. The research progress of hyperuricemia induces kidney diseases[J]. International Journal of Pathology and Clinical Medicine, 2016, 36(3): 285-289. |
| [12] |
DOUALLA M, HALLE M P, MOUTCHIA J, et al. Determinants of hyperuricemia in non-dialysed chronic kidney disease patients in three hospitals in cameroon[J]. BMC Nephrology, 2018, 19(1): 169. |
| [13] |
袁谱龙, 陈亮, 刘小宇, 等. 荷叶生物碱分离及相关活性研究[J]. 中成药, 2014, 36(11): 2330-2333. YUAN P L, CHEN L, LIU X Y, et al. Alkaloids from lotus leaf and related bioactivities[J]. Chinese Traditional Patent Medicine, 2014, 36(11): 2330-2333. |
| [14] |
范婷婷, 法鲁克, 方芳, 等. 荷叶总生物碱降脂减肥作用的体内外试验[J]. 浙江大学学报(农业与生命科学版), 2013, 39(2): 141-148. FAN T T, FA L K, FANG F, et al. Effect of total alkaloids from lotus leaves on body mass and lipid regulation in vivo and in vitro[J]. Journal of Zhejiang University(Agriculture and Life Sciences), 2013, 39(2): 141-148. |
| [15] |
WANG M X, ZHAO X J, CHEN T Y, et al. Nuciferine alleviates renal injury by inhibiting inflammatory responses in fructose-fed rats[J]. Journal of Agricultural and Food Chemistry, 2016, 64(42): 7899-7910. |
| [16] |
KRASTANOV A. Metabolomicsthe state of art[J]. Biotechnology & Biotechnological Equipment, 2014, 24(1): 1537-1543. |
| [17] |
WILCOXEN K M, UEHARA T, MYINT K T, et al. Practical metabo- lomics in drug discovery[J]. Expert Opinion on Drug Discovery, 2010, 5(3): 249-263. |
| [18] |
马丽华, 杨宏静, 徐晓艳, 等. 代谢组学研究进展[J]. 现代医药卫生, 2017, 33(17): 2636-2639. MA L H, YANG H J, XU X Y, et al. Progress in metabonomics[J]. Journal of Modern Medicine & Health, 2017, 33(17): 2636-2639. |
| [19] |
鲁媛, 罗婷婷, 严诗楷, 等. 代谢组学在高脂血症的研究进展[J]. 广东化工, 2018, 45(10): 133-135. LU Y, LUO T T, YAN S K, et al. Metabolomics research progress in hyperlipidemia[J]. Guangdong Chemical Industry, 2018, 45(10): 133-135. |
| [20] |
BOITEAU R M, HOYT D W, NICORA C D, et al. Structure elucidation of unknown metabolites in metabolomics by combined NMR and MS/MS prediction[J]. Metabolites, 2018, 8(1): 8. |
| [21] |
HEUDE C, NATH J, CARRIGAN J B, et al. Nuclear magnetic resonance strategies for metabolic analysis[J]. Advances in Experimental Medicine and Biology, 2017, 965(8): 45-76. |
| [22] |
JIANG T, QIAN J, DING J, et al. Metabolomic profiles delineate the effect of Sanmiao Wan on hyperuricemia in rats[J]. Biomedical Chromatography, 2017, 31(2): e3792. |
| [23] |
LI S, WANG H, WANG X, et al. Betaine affects muscle lipid metabolism via regulating the fatty acid uptake and oxidation in finishing pig[J]. Journal of Animal Science and Biotechnology, 2017, 8(1): 72. |
2. State Key Laboratory of Component-based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 3001617, China
 2021, Vol. 38
2021, Vol. 38